KEYNOTE-048試験
国際共同第Ⅲ相試験(KEYNOTE-048試験)※
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-048試験)
Burtness B et al. Lancet 2019; 394: 1915-1928.(本試験はMSD社の資金提供により行われた。Burtness BはMSD社より謝礼や旅費などを受領している。その他の著者にMSD社より謝礼などを受領している者が含まれる。)
※本試験では2回の中間解析と最終解析が計画されていました。評価資料として審査された2回目の中間解析結果を中心にご紹介します。
試験概要
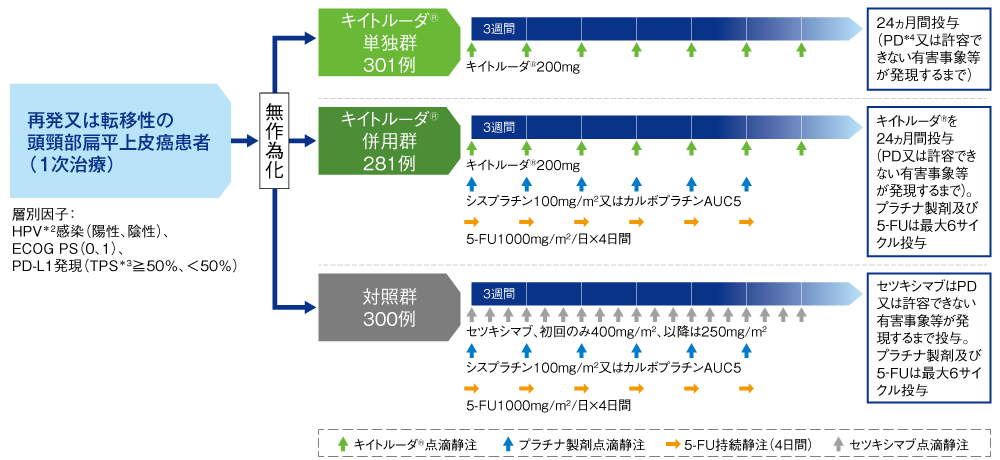
【目的】再発又は遠隔転移を有する頭頸部扁平上皮癌患者に対する1次治療としてのキイトルーダ®単独療法又はキイトルーダ®とプラチナ製剤及び5-FUの併用療法の有効性及び安全性について、標準治療(セツキシマブ+プラチナ製剤+5-FU)と比較検討する。
【デザイン】国際共同無作為化非盲検実薬対照第Ⅲ相試験[優越性検証試験][第2回中間解析結果(データカットオフ日:2018年6月13日)、最終解析結果(データカットオフ日:2019年2月25日)を追加]
【対象】再発又は遠隔転移を有する頭頸部扁平上皮癌で、化学療法歴のない患者†882例(日本人67例を含む)
† 局所進行癌の集学的治療の一環として、同意取得の6ヵ月より前に全身治療が完了している場合は適格
【方法】キイトルーダ®単独療法群(以下キイトルーダ®単独群:200mgを3週間間隔で点滴静注)、キイトルーダ®+プラチナ製剤及び5-FU併用群(以下キイトルーダ®併用群:キイトルーダ®200mgとシスプラチン100mg/m2又はカルボプラチンAUC5を1日目、5-FU1000mg/m2/日を1日目~4日目まで持続静注を3週間間隔で投与)、対照群(セツキシマブを1週間間隔投与で初回のみ400mg/m2、以降は250mg/m2、シスプラチン100mg/m2又はカルボプラチンAUC5を1日目、5-FU1000mg/m2/日を1日目~4日目まで持続静注を3週間間隔で投与)の3群に1:1:1の比で無作為に割り付けた*1。最初の画像評価は無作為化の9週間後、以降は6週間毎、12ヵ月経過後は9週間毎に画像診断により腫瘍縮小効果を判定し、疾患進行(PD)、許容できない有害事象の発現等による投与中止まで、最長24ヵ月間キイトルーダ®を継続した。各群とも、プラチナ製剤及び5-FUの投与は最大で6サイクルまでとした。
【評価項目】主要評価項目:ITT集団*5及びPD-L1発現別の全生存期間(OS)*6、無増悪生存期間(PFS)*7
副次評価項目:ITT集団及びPD-L1発現別の6ヵ月及び12ヵ月時点のPFS率、奏効率(ORR)、欧州がん研究・治療機構(EORTC)(QLQ-C30)の全般的健康状態(QoL)、全般的なQoL、疼痛及び嚥下能の悪化までの期間(TTD)及び安全性
探索的評価項目:奏効期間(DOR)
【判定基準】PFS、ORR、DORは盲検下独立判定委員会(BICR)がRECISTガイドライン1.1版に基づき評価した。
【解析計画】解析対象集団:有効性の解析はPD-L1陽性(CPS*8≧20)集団、PD-L1陽性(CPS≧1)集団、ITT集団の3つの患者集団を対象として実施した。安全性の解析についてはASaT集団*9を対象として実施した。
有効性評価の統計手法:OS、PFSはKaplan-Meier法を用いて推定し、優越性の検定には層別ログランク検定を用いた。ハザード比(HR)は層別Cox比例ハザードモデルを用いて算出した。6ヵ月、12ヵ月時点のPFS率及びDORについてはKaplan-Meier法を用いて推定した。また、PD-L1発現別、p16発現状況別、ECOG PS別、年齢別、性別、地域別、喫煙歴別、再発・転移の状態別などの部分集団解析を実施した。サブグループごとのOSについて、タイデータの処理にEfron法を用いた非層別Cox比例ハザードモデルによりHR及び名目上の95%CIを算出し、記述的に評価した。
多重性の調整:本試験では主要仮説である解析集団ごとのOSとPFSについて、2回の有効性の中間解析を計画し、主要仮説の多重性についてはMaurer & Bretzのgraphical approachを用いて片側有意水準が2.5%となるように厳密に制御した。OSは1回目及び2回目の中間解析並びに最終解析の3回の解析を行い、PFSは1回目及び2回目の中間解析を実施することとした。なお、中間解析に関する多重性はα消費関数にて厳密に制御した。キイトルーダ®併用群のOSとPFSの仮説はCPS≧20患者の優越性、CPS≧1患者の優越性の順で検定することとした。また、キイトルーダ®併用群についてはITT集団のOSの非劣性とPFSの優越性も最初に検定し、OSの優越性はOSの非劣性が示された場合に検定することとした。キイトルーダ®単独群のPFSの仮説はCPS≧20患者、CPS≧1患者、ITT集団での優越性の順で検定することとした。キイトルーダ®単独群のOSの仮説についてはCPS≧20患者の優越性、CPS≧1患者の優越性、ITT集団の非劣性、ITT集団の優越性の順に検定することとした。
*1 キイトルーダ®併用群は安全性評価のため一時的に登録が中断された。登録中断期間に対照群に割り付けられた22例は、キイトルーダ®併用群と有効性を検証する対照群から除外された。そのためキイトルーダ®単独群の対照群は300例、キイトルーダ®併用群の対照群は278例となった。
*2 p16発現の有無で、HPV(human papillomavirus:ヒトパピローマウイルス)感染状態を評価した。
*3 TPS(tumor proportion score):腫瘍細胞のうちPD-L1発現陽性細胞の割合
*4 PD(progressive disease):疾患進行
*5 ITT(intention-to-treat)集団:無作為化したすべての患者
*6 検証的解析項目
*7 第2回中間解析は検証的解析項目
*8 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
*9 ASaT(all subjects as treated)集団:治験薬を1回以上投与されたすべての患者
※ CPSによるPD-L1発現状態別の評価は、KEYNOTE-012試験等のバイオマーカーデータによって頭頸部癌におけるCPSでの評価⽅法の有⽤性が確認されたことから、解析計画に追加された。
※ PFSは第2回中間解析の結果を最終結果とした。OSは第2回中間解析で優越性が認められた場合、それを最終結果とした。
キイトルーダ®の効能又は効果、用法及び用量、重要な基本的注意
4. 効能又は効果(抜粋)
再発又は遠隔転移を有する頭頸部癌
5. 効能又は効果に関連する注意(抜粋)
〈再発又は遠隔転移を有する頭頸部癌〉
5.14 本剤の術後補助療法における有効性及び安全性は確立していない。
5.15 本剤単独投与の延命効果は、PD-L1発現率(CPS)により異なる傾向が示唆されている。CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.19参照]
5.16 「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.19参照]
<頭頸部癌又は頭頸部腫瘍における各薬剤の用法及び用量>
シスプラチン
用法・用量(抜粋)
頭頸部癌には、D法を標準的用法・用量とし、患者の状態によりB法を選択する。
D法:シスプラチンとして10~20mg/m2(体表面積)を1日1回、5日間連続投与し、少なくとも2週間休薬する。これを1クールとし、投与を繰り返す。
B法:シスプラチンとして50~70mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。
なお、投与量は疾患、症状により適宜増減する。
カルボプラチン
6. 用法及び用量(抜粋)
〈頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌〉
通常、成人にはカルボプラチンとして、1日1回300~400mg/m2(体表面積)を投与し、少なくとも4週間休薬する。これを1クールとし、投与を繰り返す。
なお、投与量は、年齢、疾患、症状により適宜増減する。
5-FU
6. 用法及び用量(抜粋)
6.3 頭頸部癌及び食道癌に対する他の抗悪性腫瘍剤との併用療法の場合
他の抗悪性腫瘍剤との併用療法において、通常、成人にはフルオロウラシルとして1日1000mg/m2(体表面積)までを、4~5日間連日で持続点滴する。投与を繰り返す場合には少なくとも3週間以上の間隔をあけて投与する。本剤単独投与の場合には併用投与時に準じる。なお、年齢、患者の状態などにより適宜減量する。
患者背景(ITT集団)
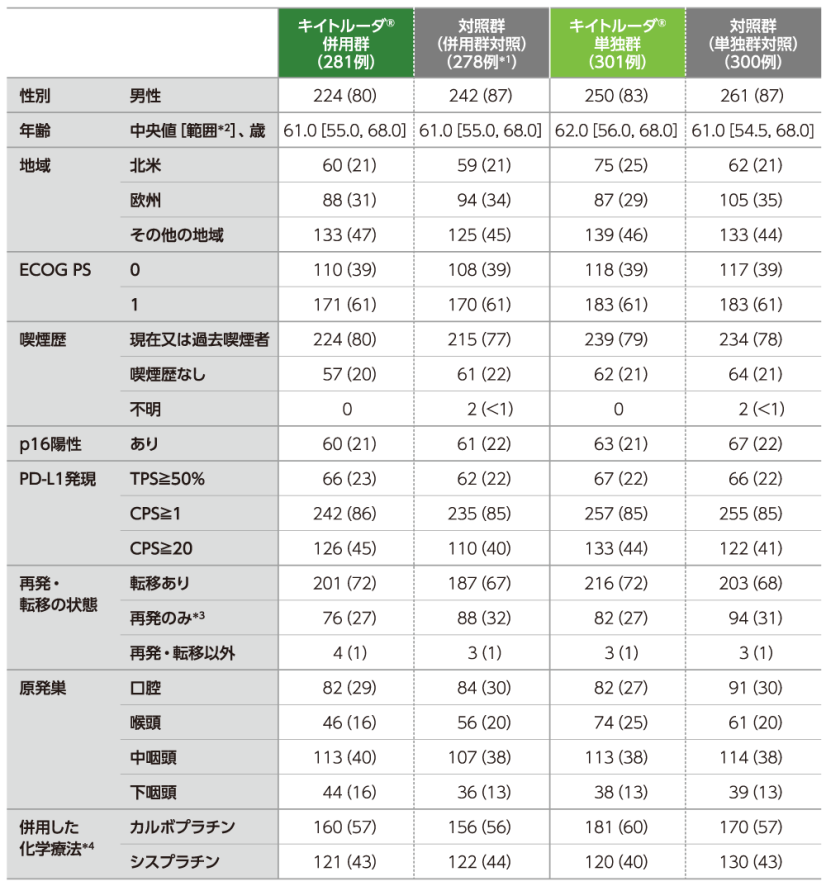
例数(%)。
*1 キイトルーダ®併用群への患者登録が行われている期間に対照群(併用群対照)に無作為に割り付けられた患者のみを含む。
*2 四分位範囲。
*3 局所再発及び頸部リンパ節に転移した癌を有する患者のみ含む。
*4 治験担当医には、患者への治験薬の無作為割り付けが行われる前に、どちらのプラチナ製剤を投与するかを選択するよう求めた。
キイトルーダ®併用群
主要評価項目 全生存期間:OS(優越性検証試験)
全生存期間(OS)のKaplan-Meier曲線(ITT集団)[第2回中間解析]*1
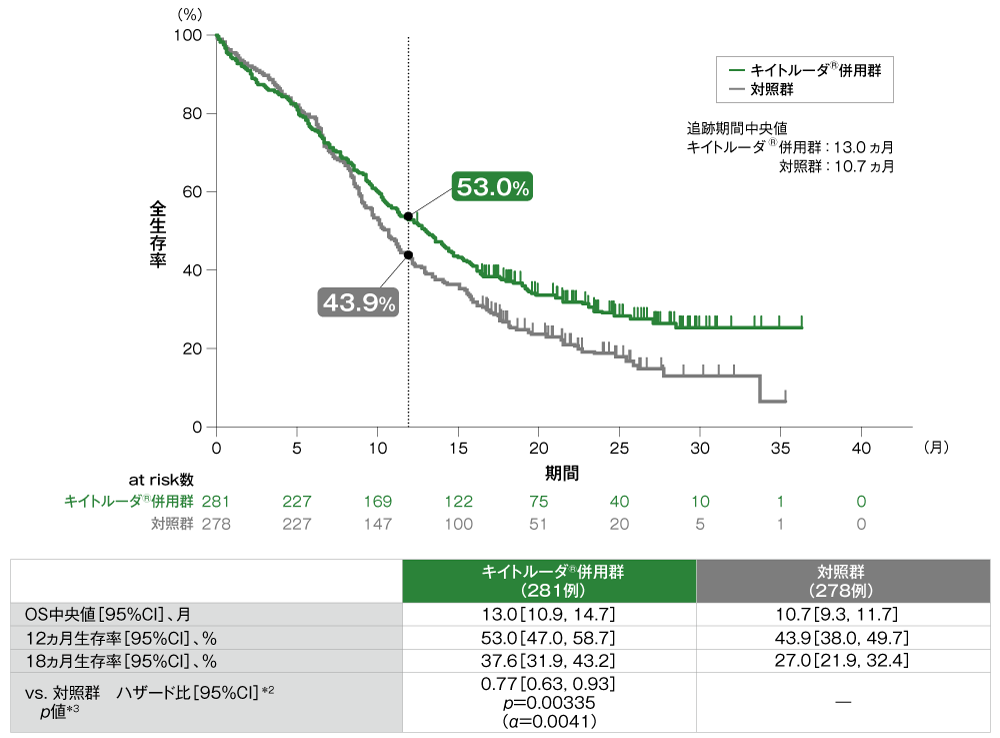
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。
*2 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
*3 ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]。いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
- ITT集団におけるOS中央値はキイトルーダ®併用群で13.0ヵ月(95%CI:10.9, 14.7)、対照群で10.7ヵ月(95%CI:9.3, 11.7)でした。対照群に対するキイトルーダ®併用群のハザード比は0.77(95%CI:0.63, 0.93)であり、OSを有意に延長しました(p=0.00335、層別ログランク検定[片側]、有意水準α=0.0041)(検証的解析結果)。
主要評価項目 PD-L1発現別にみた全生存期間:OS(優越性検証試験)
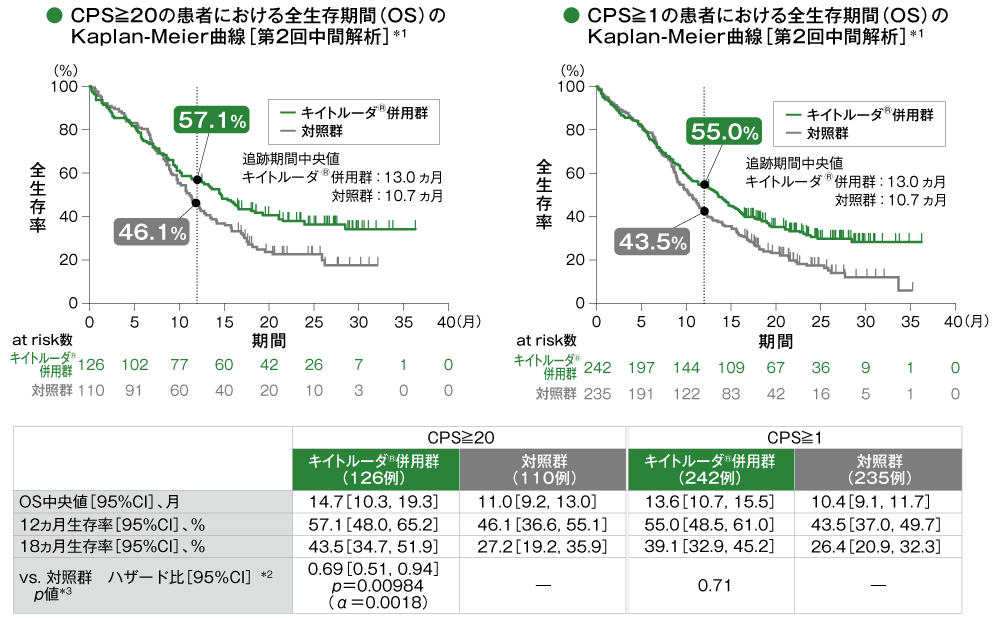
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。
*2 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
*3 ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]。いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
- CPS≧20の患者における対照群に対するキイトルーダ®併用群のハザード比は0.69(95%CI:0.51, 0.94)であり、統計学的な有意差は認められませんでした(p=0.00984、層別ログランク検定[片側]、有意水準α=0.0018)(検証的解析結果)。
CPS≧1の患者における対照群に対するキイトルーダ®併用群のハザード比は0.71でした。
多重性を考慮した解析方針に従って、CPS≧20で優越性が検証されなかったため、CPS≧1では有意差検定を実施しませんでした。
[補足]最終解析におけるPD-L1発現別にみた全生存期間(OS)
![[補足]最終解析におけるPD-L1発現別にみた全生存期間(OS)](https://www.msdconnect.jp/wp-content/uploads/sites/5/2023/05/head-neck-keynote-048_04-a.png)
*1 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
*2 ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]。いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
Burtness B et al. Lancet 2019; 394: 1915-1928. KEYNOTE-048試験はMSD社の資金提供により行われた。
Burtness BはMSD社より謝礼や旅費などを受領している。その他の著者にMSD社より謝礼などを受領している者が含まれる。
主要評価項目 無増悪生存期間:PFS(優越性検証試験)
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)[第2回中間解析]*1
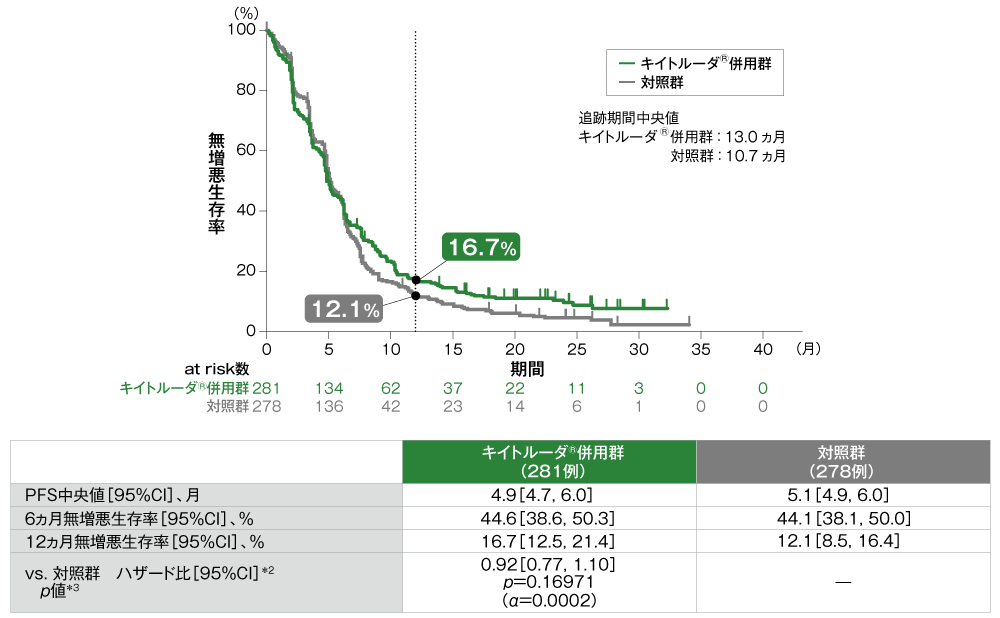
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。
*2 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
*3 ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]。いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
- ITT集団におけるPFS中央値はキイトルーダ®併用群で4.9ヵ月(95%CI:4.7, 6.0)、対照群で5.1ヵ月(95%CI:4.9, 6.0)でした。対照群に対するキイトルーダ®併用群のハザード比は0.92(95%CI:0.77, 1.10)であり、PFSの優越性は認められませんでした(p=0.16971、層別ログランク検定[片側]、有意水準α=0.0002)(検証的解析結果)。
主要評価項目 PD-L1発現別にみた無増悪生存期間:PFS(優越性検証試験)
- CPS≧20の患者における対照群に対するキイトルーダ®併用群のハザード比は0.73(95%CI:0.55, 0.97)であり、統計学的な有意差は認められませんでした(p=0.01622、層別ログランク検定[片側]*、有意水準α=0.0017)(検証的解析結果)。CPS≧1の患者における対照群に対するキイトルーダ®併用群のハザード比は0.82でした。多重性を考慮した解析方針に従って、CPS≧20で優越性が検証されなかったため、CPS≧1では有意差検定を実施しませんでした。
*ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
副次評価項目 奏効率:ORR[第2回中間解析]
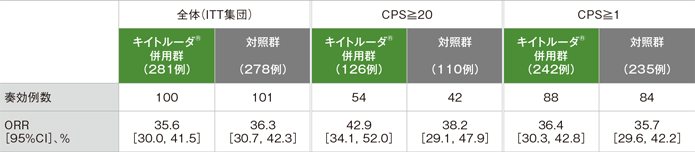
- ORRはキイトルーダ®併用群35.6%(95%CI:30.0, 41.5)、対照群36.3%(95%CI:30.7, 42.3)でした。奏効までの期間中央値はキイトルーダ®併用群2.1ヵ月(範囲:1.4, 13.7)、対照群2.1ヵ月(範囲:1.3, 6.2)でした。
探索的評価項目 奏効期間:DOR
奏効期間(DOR)のKaplan-Meier曲線(ITT集団)[第2回中間解析]
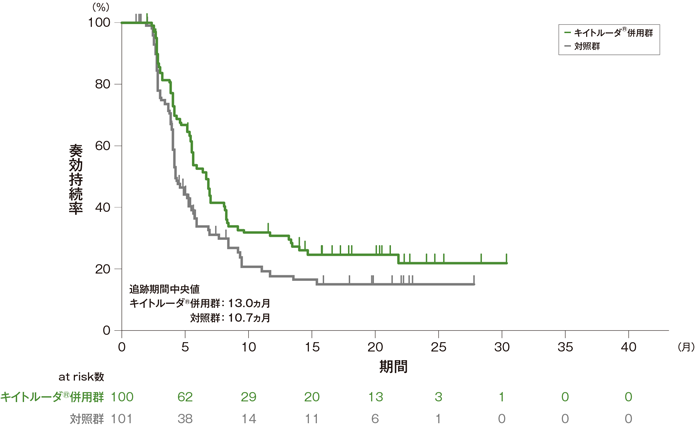
- 奏効が認められたITT集団におけるDOR中央値はキイトルーダ®併用群6.7ヵ月(範囲:1.6+, 30.4+)、対照群4.3ヵ月(範囲:1.2+, 27.9+)でした。
キイトルーダ®単独群
主要評価項目 全生存期間:OS(優越性検証試験)
全生存期間(OS)のKaplan-Meier曲線(ITT集団)[第2回中間解析]*1
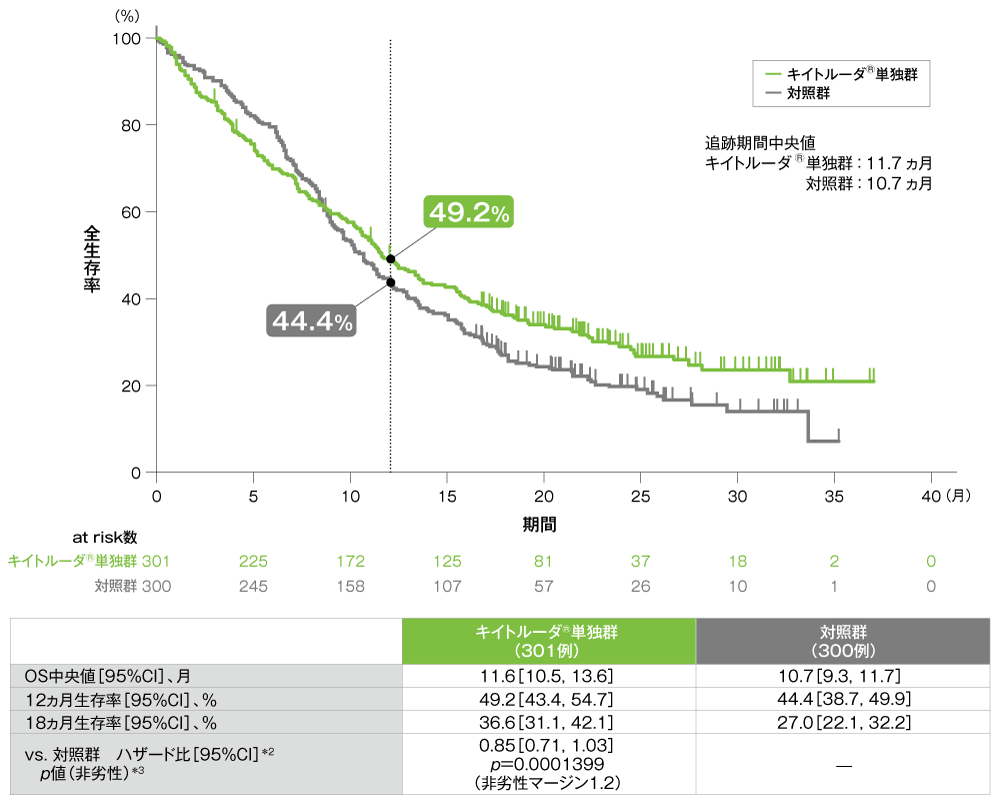
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。
*2 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
*3 ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]。いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
- ITT集団におけるOS中央値はキイトルーダ®単独群で11.6ヵ月(95%CI:10.5, 13.6)、対照群で10.7ヵ月(95%CI:9.3, 11.7)でした。対照群に対するキイトルーダ®単独群のハザード比は0.85(95%CI:0.71, 1.03)であり、OSの非劣性が示されました(p=0.0001399[非劣性p値]、層別ログランク検定[片側]、非劣性マージン:1.2)(検証的解析結果)。また、対照群に対するキイトルーダ®単独群の優越性は認められませんでした(p=0.04563[優越性p値]、層別ログランク検定[片側]、α=0.0117)(検証的解析結果)。
主要評価項目 PD-L1発現別にみた全生存期間:OS(優越性検証試験)
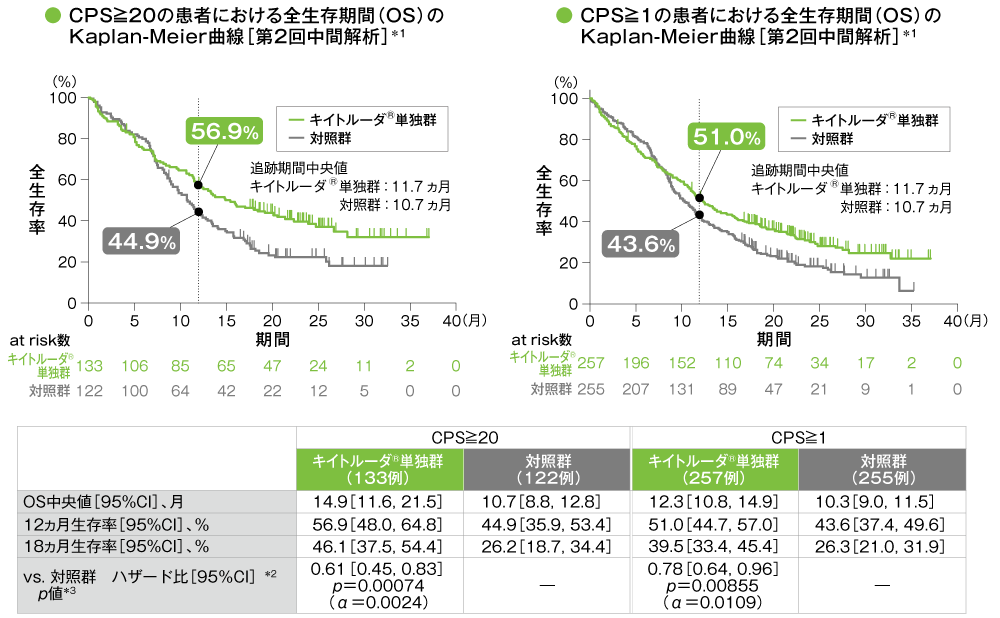
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
*3 ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
- CPS≧20の患者における対照群に対するキイトルーダ®単独群のハザード比は0.61(95%CI:0.45, 0.83)であり、OSを有意に延長しました(p=0.00074、層別ログランク検定[片側]、有意水準α=0.0024)(検証的解析結果)。
また、CPS≧1の患者における対照群に対するキイトルーダ®単独群のハザード比は0.78(95%CI:0.64, 0.96)であり、OSを有意に延長しました(p=0.00855、層別ログランク検定[片側]、有意水準α=0.0109)(検証的解析結果)
主要評価項目 無増悪生存期間:PFS(優越性検証試験)
無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)[第2回中間解析]*1
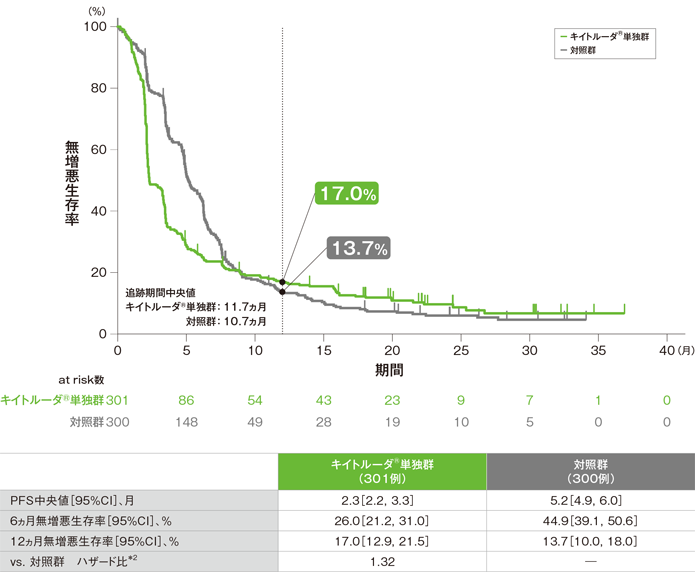
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、ECOG PS、p16発現、PD-L1発現を層別因子とし、タイデータにEfron法を用いた層別Cox比例ハザードモデルに基づき算出した。また、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
- ITT集団におけるPFS中央値はキイトルーダ®単独群で2.3ヵ月(95%CI:2.2, 3.3)、対照群で5.2ヵ月(95%CI:4.9, 6.0)でした。多重性を考慮した解析方針に従って、CPS≧20で優越性が検証されなかったため、ITT集団では有意差検定を実施しませんでした。
主要評価項目 PD-L1発現別にみた無増悪生存期間:PFS(優越性検証試験)
- CPS≧20の患者における対照群に対するキイトルーダ®単独群のハザード比は0.97(95%CI:0.74, 1.27)であり、統計学的な有意差は認められませんでした(p=0.41028、層別ログランク検定[片側]*、有意水準α=0.0016)(検証的解析結果)。CPS≧1の患者における対照群に対するキイトルーダ®単独群のハザード比は1.15でした。多重性を考慮した解析方針に従って、CPS≧20の患者で優越性が検証されなかったため、CPS≧1の患者では有意差検定を実施しませんでした。
*ECOG PS、p16発現、PD-L1発現を層別因子とする層別ログランク検定[片側]、いずれかの層別因子内でのイベント数が5以上になるまで、ECOG PS、p16発現、PD-L1発現の順に層別因子を除外した。
副次評価項目 奏効率:ORR[第2回中間解析]
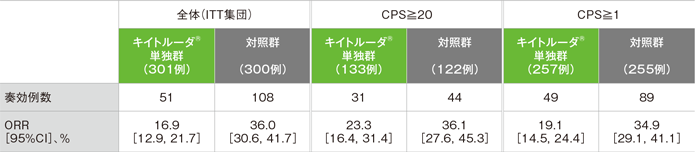
- ORRはキイトルーダ®単独群16.9%(95%CI:12.9, 21.7)、対照群36.0%(95%CI:30.6, 41.7)でした。奏効までの期間中央値はキイトルーダ®単独群2.1ヵ月(範囲:1.5, 9.1)、対照群2.1ヵ月(範囲:1.3, 6.2)でした。
探索的評価項目 奏効期間:DOR(探索的評価項目)
奏効期間(DOR)のKaplan-Meier曲線(ITT集団)[第2回中間解析]
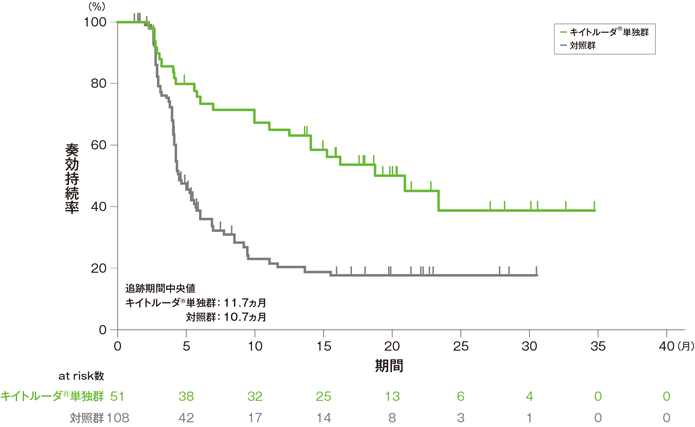
- 奏効が認められたITT集団におけるDOR中央値はキイトルーダ®単独群20.9ヵ月(範囲:1.5+, 34.8+)、対照群4.5ヵ月(範囲:1.2+, 30.6+)でした。
安全性
副作用*(いずれかの投与群で発現率5%以上)(ASaT集団)[第2回中間解析]
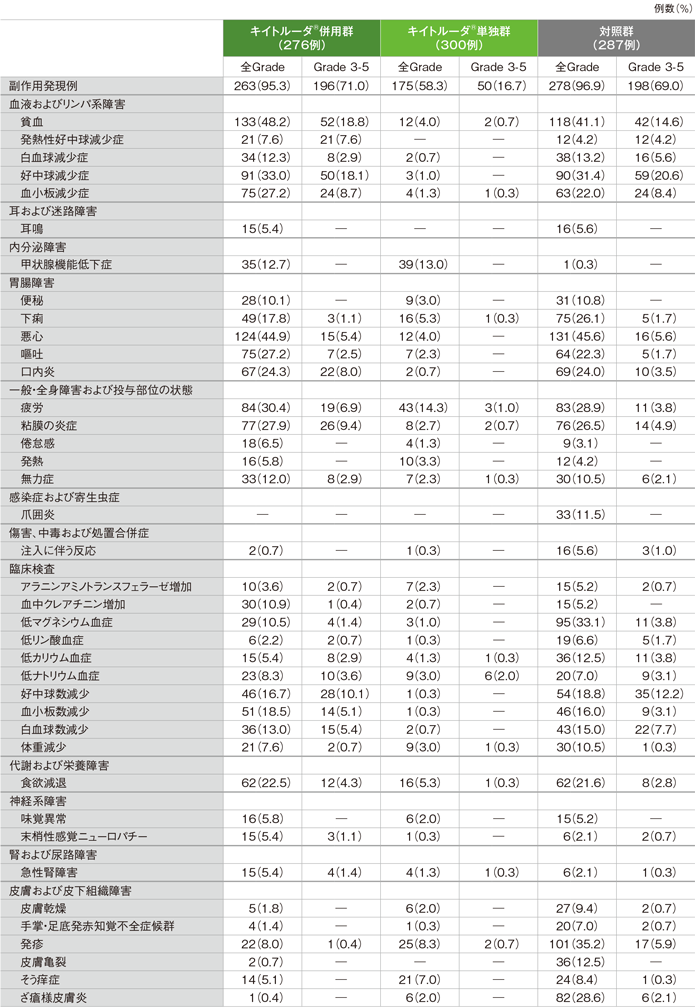
MedDRA/J version 21.0、GradeはCTCAE version 4.0
* 治験担当医が薬剤関連と判断。
キイトルーダ®併用群
キイトルーダ®併用群で副作用は263/276例(95.3%)に認められました。主な副作用(20%以上)は貧血133例(48.2%)、悪心124例(44.9%)、好中球減少症91例(33.0%)、疲労84例(30.4%)、粘膜の炎症77例(27.9%)、血小板減少症、嘔吐各75例(27.2%)、口内炎67例(24.3%)及び食欲減退62例(22.5%)でした。重篤な副作用は102例(37.0%)に認められ、2例以上にみられた重篤な副作用は発熱性好中球減少症14例(5.1%)、貧血11例(4.0%)、口内炎8例(2.9%)、好中球減少症7例(2.5%)、粘膜の炎症、悪心、敗血症性ショック、血小板減少症各6例(2.2%)、急性腎障害、食欲減退、肺炎各5例(1.8%)、低ナトリウム血症4例(1.4%)、間質性肺疾患、肺感染、血小板数減少、嘔吐各3例(1.1%)、肺臓炎2例(0.7%)でした。いずれかの治験薬で投与中止に至った副作用は63例(22.8%)に認められ、2例以上にみられた投与中止に至った副作用は血中クレアチニン増加5例(1.8%)、粘膜の炎症、好中球減少症、肺炎、敗血症性ショック各4例(1.4%)、悪心、末梢性感覚ニューロパチー、肺臓炎、血小板減少症、耳鳴各3例(1.1%)、急性腎障害、アラニンアミノトランスフェラーゼ増加、貧血、アスパラギン酸アミノトランスフェラーゼ増加、無力症、発熱性好中球減少症、間質性肺疾患、腎不全、口内炎、失神各2例(0.7%)でした。副作用による死亡は10例で、キイトルーダ®と関連ありとされた死亡例は敗血症性ショック2例、間質性肺疾患、腫瘍出血、出血各1例でした。また、キイトルーダ®と関連なしとされた死亡例は敗血症性ショック3例、敗血症、脳虚血各1例でした。
キイトルーダ®単独群
キイトルーダ®単独群で副作用は175/300例(58.3%)に認められました。主な副作用(10%以上)は疲労43例(14.3%)、甲状腺機能低下症39例(13.0%)でした。重篤な副作用は27例(9.0%)に認められ、2例以上にみられた重篤な副作用は肺臓炎3例(1.0%)、急性腎障害2例(0.7%)でした。投与中止に至った副作用は14例(4.7%)に認められ、2例以上にみられた投与中止に至った副作用は肺臓炎、自己免疫性肝炎各2例(0.7%)でした。副作用による死亡は3例で、その内訳は肺臓炎、播種性血管内凝固、自己炎症疾患各1例でした。
対照群
対照群で副作用は278/287例(96.9%)に認められました。主な副作用(20%以上)は悪心131例(45.6%)、貧血118例(41.1%)、発疹101例(35.2%)、低マグネシウム血症95例(33.1%)、好中球減少症90例(31.4%)、疲労83例(28.9%)、ざ瘡様皮膚炎82例(28.6%)、粘膜の炎症76例(26.5%)、下痢75例(26.1%)、口内炎69例(24.0%)、嘔吐64例(22.3%)、血小板減少症63例(22.0%)、食欲減退62例(21.6%)でした。重篤な副作用は73例(25.4%)に認められ、2例以上にみられた重篤な副作用は発熱性好中球減少症10例(3.5%)、貧血8例(2.8%)、悪心、肺炎各7例(2.4%)、好中球減少症5例(1.7%)、口内炎、疲労、下痢各4例(1.4%)、嘔吐、脱水、敗血症、注入に伴う反応、好中球数減少各3例(1.0%)、食欲減退2例(0.7%)でした。いずれかの治験薬で投与中止に至った副作用は57例(19.9%)に認められ、2例以上にみられた投与中止に至った副作用は注入に伴う反応、発疹各6例(2.1%)、貧血4例(1.4%)、好中球減少症、肺炎、悪心、耳鳴、過敏症、聴力低下、ざ瘡様皮膚炎各3例(1.0%)、粘膜の炎症、急性腎障害、アナフィラキシー反応、疲労、腎機能障害、敗血症各2例(0.7%)でした。副作用による死亡は8例で、その内訳は肺炎3例、敗血症2例、低酸素症、骨髄炎、肺動脈血栓症各1例でした。
[補足]最終解析時点における安全性の概要(ASaT集団)
キイトルーダ®併用群
●副作用*1: 264/276例(96%) 主な副作用(20%以上): 貧血134例(49%)、悪心125例(45%)、好中球減少症91例(33%)、疲労84例(30%)、粘膜の炎症77例(28%)、血小板減少症、嘔吐各75例(27%)、口内炎69例(25%)、食欲減退62例(22%)
● Grade 3-5の副作用*2: 198例(72%) Grade 3-5の副作用(2例以上):貧血54例(20%)、好中球減少症49例(18%)、好中球数減少27例(10%)、粘膜の炎症26例(9%)、血小板減少症24例(9%)、口内炎22例(8%)、疲労19例(7%)、悪心、白血球数減少各15例(5%)、血小板数減少14例(5%)、食欲減退12例(4%)、低カリウム血症9例(3%)、白血球減少症8例(3%)、嘔吐、無力症各7例(3%)、下痢、低マグネシウム血症各3例(1%)、体重減少2例(<1%)
●副作用による死亡: 11例 敗血症性ショック5例、気管支炎、肺敗血症、腫瘍出血、脳虚血、間質性肺疾患、出血各1例
●重篤な有害事象: 165例(59.8%) 重篤な有害事象(5例以上): 発熱性好中球減少症17例(6.2%)、肺炎16例(5.8%)、貧血14例(5.1%)、口内炎、誤嚥性肺炎各8例(2.9%)、発熱、肺感染、低ナトリウム血症各7例(2.5%)、好中球減少症、血小板減少症、悪心、粘膜の炎症、敗血症性ショック、脱水、腫瘍出血各6例(2.2%)、嘔吐、食欲減退、急性腎障害各5例(1.8%)
●治験薬で投与中止に至った有害事象: 90例(32.6%) 投与中止に至った有害事象(4例以上): 肺炎、血中クレアチニン増加各6例(2.2%)、粘膜の炎症5例(1.8%)、発熱性好中球減少症、好中球減少症、敗血症性ショック、誤嚥性肺炎各4例(1.4%)
キイトルーダ®単独群
●副作用*1 : 175/300例(58%) 主な副作用(10%以上): 疲労43例(14%)、甲状腺機能低下症39例(13%)
●Grade 3-5の副作用*2 : 51例(17%) Grade 3-5の副作用(2例以上): 疲労3例(1%)、貧血、粘膜の炎症、発疹各2例(<1%)
●副作用による死亡: 3例 播種性血管内凝固、自己炎症疾患、肺臓炎各1例
●重篤な有害事象: 123例(41.0%) 重篤な有害事象(5例以上):肺炎18例(6.0%)、腫瘍出血11例(3.7%)、呼吸困難7例(2.3%)、敗血症6例(2.0%)、誤嚥性肺炎5例(1.7%)
●治験薬で投与中止に至った有害事象: 36例(12.0%) 投与中止に至った有害事象(2例以上):敗血症3例(1.0%)、心筋梗塞、副腎機能不全、自己免疫性肝炎、肺炎、腫瘍出血、肺臓炎各2例(0.7%)
対照群
● 副作用*1 : 278/287例(97%) 主な副作用(20%以上): 悪心131例(46%)、貧血118例(41%)、発疹101例(35%)、低マグネシウム血症95例(33%)、好中球減少症89例(31%)、疲労83例(29%)、ざ瘡様皮膚炎82例(29%)、粘膜の炎症、下痢各76例(26%)、口内炎70例(24%)、嘔吐64例(22%)、血小板減少症、食欲減退各62例(22%)
● Grade 3-5の副作用*2 : 199例(69%) Grade 3-5の副作用(2例以上): 好中球減少症58例(20%)、貧血43例(15%)、好中球数減少35例(12%)、血小板減少症24例(8%)、白血球数減少22例(8%)、発疹17例(6%)、白血球減少症、悪心各16例(6%)、粘膜の炎症14例(5%)、疲労、低カリウム血症、低マグネシウム血症各11例(4%)、口内炎10例(3%)、血小板数減少9例(3%)、食欲減退8例(3%)、無力症、ざ瘡様皮膚炎各6例(2%)、嘔吐、下痢各5例(2%)
●副作用による死亡: 8例 肺炎3例、好中球減少性敗血症、骨髄炎、敗血症、低酸素症、肺動脈血栓症各1例
●重篤な有害事象: 141例(49.1%) 重篤な有害事象(5例以上): 肺炎18例(6.3%)、発熱性好中球減少症15例(5.2%)、貧血9例(3.1%)、悪心8例(2.8%)、肺塞栓症6例(2.1%)、嘔吐、腫瘍出血、失神各5例(1.7%)
●治験薬で投与中止に至った有害事象: 79例(27.5%) 投与中止に至った有害事象(2例以上): 注入に伴う反応、発疹各6例(2.1%)、肺炎5例(1.7%)、貧血4例(1.4%)、好中球減少症、心筋梗塞、聴力低下、耳鳴、悪心、疲労、過敏症、急性腎障害、ざ瘡様皮膚炎各3例(1.0%)、下痢、死亡、粘膜の炎症、アナフィラキシー反応、骨髄炎、敗血症性ショック、腫瘍出血、腎機能障害、肺塞栓症各2例(0.7%)
*1 治験担当医が薬剤関連と判断。
*2 内訳は、いずれかの投与群で発現率10%以上の副作用のうちGrade3-5が2例以上にみられた事象。
社内資料:KEYNOTE-048 安全性