KEYNOTE-775/309試験
子宮体癌:国際共同臨床試験成績
国際共同第Ⅲ相試験<KEYNOTE-775/309試験>1,2)
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-775/E7080-309試験)
2)Makker V et al. N Engl J Med 2022; 386:437-448
本試験はMSD社及びエーザイ株式会社の資金提供により行われた。Vicky MakkerはMSD社、エーザイ株式会社より顧問料などを受領している。その他の著者にMSD社、エーザイ株式会社より顧問料などを受領している者が含まれる。著者のうち、Steven Bird、Stephen Keefe、Robert J Orlowski はMSD社の社員、Lea Dutta、Alan D Smith はエーザイ株式会社の社員である。
試験概要
【目的】
プラチナ製剤を含む化学療法歴のある進行・再発の子宮体癌患者におけるキイトルーダ®+レンビマ®併用群と、化学療法(ドキソルビシン又はパクリタキセル)群の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化非盲検第Ⅲ相試験 [優越性試験]
[有効性:中間解析結果(データカットオフ日 2020年10月26日)、安全性:データカットオフ日 2021年2月8日]
【対象】
プラチナ製剤を含む化学療法歴のある進行・再発の子宮体癌患者827例(日本人患者104例を含む)
【方法】
キイトルーダ®+レンビマ®併用群(キイトルーダ®200mgを3週間間隔[Q3W]で点滴静注、レンビマ®20mgを1日1回[QD]連日経口投与)又は化学療法群(ドキソルビシン60mg/m2をQ3Wで点滴静注、又はパクリタキセル80mg/m2を1週間間隔[Q1W]で3週間点滴静注した後1週間休薬)に1:1の割合で無作為に割り付けた。画像診断を無作為割り付けから8週間毎又は臨床的に必要な場合にはより早期に行い、疾患進行、許容できない有害事象の発現等による投与中止又は投与完了まで継続した(キイトルーダ®投与は最大35サイクル)。
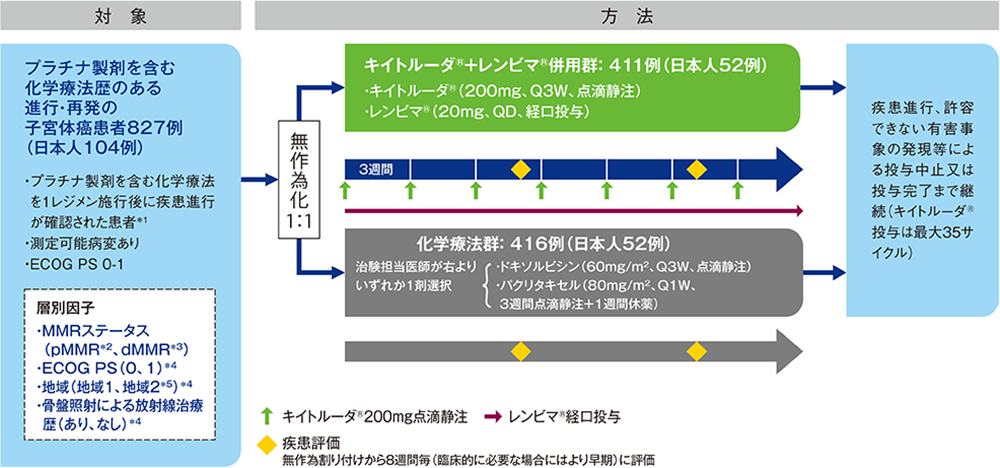
*1 プラチナ製剤を含む術前又は術後化学療法を施行した患者では、プラチナ製剤を含む化学療法を追加で1レジメンまで許容される
*2 pMMR(mismatch repair proficient)集団:ミスマッチ修復機構を有する患者
*3 dMMR(mismatch repair deficient)集団:ミスマッチ修復機構欠損を有する患者
*4 pMMRの患者のみ
*5 地域1:ヨーロッパ、アメリカ、カナダ、オーストラリア、ニュージーランド、イスラエル、地域2:その他の地域
【評価項目】
主要評価項目:全生存期間(overall survival: OS)※及び無増悪生存期間(progression free survival: PFS)※
副次評価項目:奏効率(overall response rate: ORR)※、健康関連QOLに関する患者報告アウトカム(patient reported outcome: PRO)、安全性など
探索的評価項目:奏効期間(duration of response: DOR)、病勢コントロール率(disease control rate: DCR)など
※検証的解析項目
【判定基準】
PFS、ORR、DOR及びDCRは盲検下独立判定委員会(blinded independent central review: BICR)がRECISTガイドライン1.1版に基づき評価した。健康関連QOLに関するPROはEORTC QLQ-C30のグローバルスコアを用いて評価した。
【解析計画】
解析対象集団:有効性はITT集団*6、安全性はAPaT集団*7を解析対象とした。
有効性評価の統計手法:OS及びPFSはKaplan-Meier法を用いて生存曲線を推定した。OS及びPFSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比及びその95%信頼区間を算出した。ORRの群間比較には層別Miettinen and Nurminen法を用いた。層別ログランク検定及び層別Cox比例ハザードモデルの層別因子には、無作為割り付けに用いた層別因子を用いた。OS、PFS、ORR、DOR及びDCRの解析は全体集団及びpMMR集団を対象として実施した。dMMR集団については、治験実施計画書に記載されていないが、OS、PFS及びORRについて算出し(日本人集団のサブグループ解析を含む)、評価資料として承認時に評価された。また、Cox比例ハザードモデルを用いて、年齢(65歳未満、65歳以上)、人種(白人、アジア人、その他)、地域(地域1、地域2)、MMRステータス(pMMR、dMMR)、ECOG PS(0、1)、骨盤照射による放射線治療歴(あり、なし)、組織型(類内膜癌、類内膜癌以外)、前治療ライン数(1、2、3以上)別のサブグループ解析を実施した。日本人集団については、治験実施計画書に記載されていないが、OS、PFS、ORR、DOR及びDCRについても全体集団及びpMMR集団を対象として算出し、評価資料として承認時に評価された。
多重性の調整:本試験では有効性の2回の中間解析を事前に計画し、PFSは1回目の中間解析を最終解析とし、OSは2回の中間解析及び最終解析を実施することとした。全体集団及びpMMR集団でのOS、PFS及びORRの全体の有意水準を片側2.5%となるように厳密に制御した。これらの多重性の調整には、Maurer & Bretzのgraphical approachを用いた。本試験では6つの仮説(H1:pMMR集団のPFS、H2:pMMR集団のOS、H3:pMMR集団のORR、H4:全体集団のPFS、H5:全体集団のOS、H6:全体集団のORR)を設定した。まず、H1に有意水準片側0.05%、H2に有意水準片側2.45%を配分する。H1が統計学的に有意であった場合、有意水準片側0.05%をH4に再配分する。H4が統計学的に有意であった場合、有意水準片側0.05%をH2に再配分し、H2を有意水準片側2.5%で検定する。H2が統計学的に有意であった場合、有意水準片側2.5%の9割をH5、1割をH3に再配分する。H5が統計学的に有意であった場合、H5の有意水準をH3に再配分しH2からH3へ再配分した有意水準と合わせ、H3を有意水準片側2.5%で検定する。H3が統計学的に有意であった場合、H3の有意水準をH6に再配分する。OSの中間解析及び最終解析における有意水準の配分には、α消費関数を用いた。ORRは1回目の中間解析のデータを用いて検定を実施することとした。
*6 ITT(intention to treat)集団:無作為化されたすべての患者
*7 APaT(all participants as treated)集団:無作為化され治験薬を1回以上投与されたすべての患者
ドキソルビシンの用法及び用量は以下のとおりです。
【用法及び用量】(抜粋) 子宮体癌(術後化学療法、転移・再発時化学療法)に対する他の抗悪性腫瘍剤との併用療法の場合 8)シスプラチンとの併用において、標準的なドキソルビシン塩酸塩の投与量及び投与方法は、1日量、ドキソルビシン塩酸塩として60mg(力価)/m2(体表面積)を日局注射用水または日局生理食塩液に溶解し、1日1回静脈内投与し、その後休薬し3週毎繰り返す。なお、年齢、症状により適宜減量する。またドキソルビシン塩酸塩の総投与量は500mg(力価)/m2(体表面積)以下とする。
パクリタキセルの用法及び用量は以下のとおりです。
【用法及び用量】(抜粋) 非小細胞肺癌及び子宮体癌にはA法を使用する。A法:通常、成人にはパクリタキセルとして、1日1回210mg/m2(体表面積)を3時間かけて点滴静注し、少なくとも3週間休薬する。これを1クールとして、投与を繰り返す。
患者背景(ITT集団)
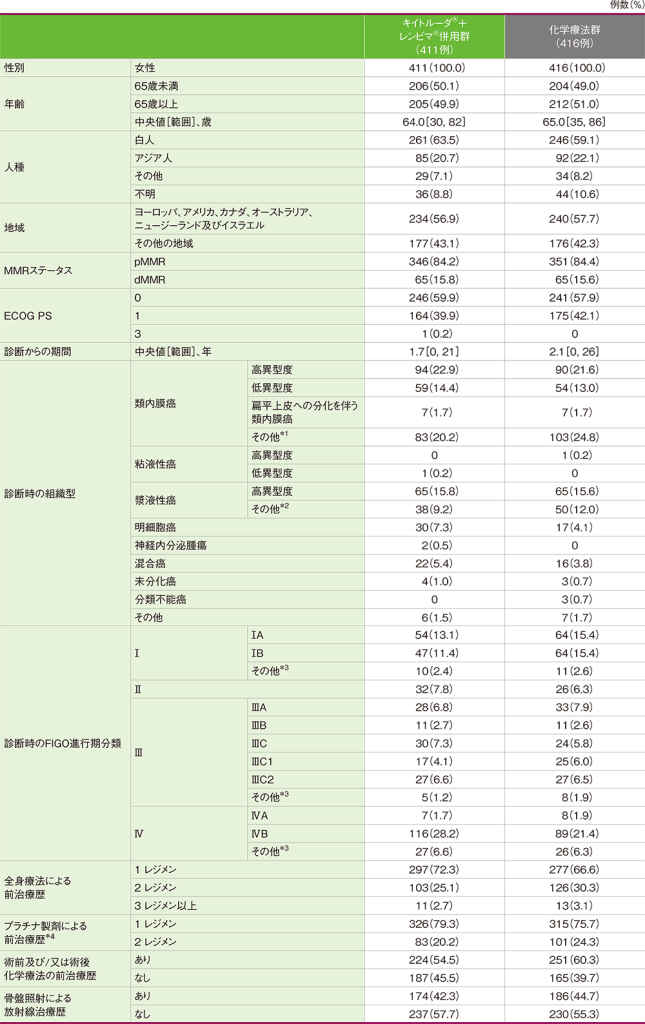
*1 異型度、亜型などの詳細の記載なし
*2 詳細の記載なし
*3 亜分類の記載なし
*4 キイトルーダ®+レンビマ®併用群にはプラチナ製剤による前治療歴のない患者が1例、3レジメン以上の患者が1例含まれる
主要評価項目:全体集団における全生存期間(OS)(優越性試験)
OS中央値は、キイトルーダ®+レンビマ®併用群で18.3ヵ月(95%CI: 15.2, 20.5)、化学療法群で11.4ヵ月(95%CI: 10.5, 12.9)でした。化学療法群に対するキイトルーダ®+レンビマ®併用群のハザード比は0.62(95%CI: 0.51, 0.75)であり、OSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.0064、検証的解析結果)。12ヵ月時点の全生存率はそれぞれ62.5%(95%CI: 57.5, 67.1)、47.9%(95%CI: 42.7, 53.0)でした。
■全体集団における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
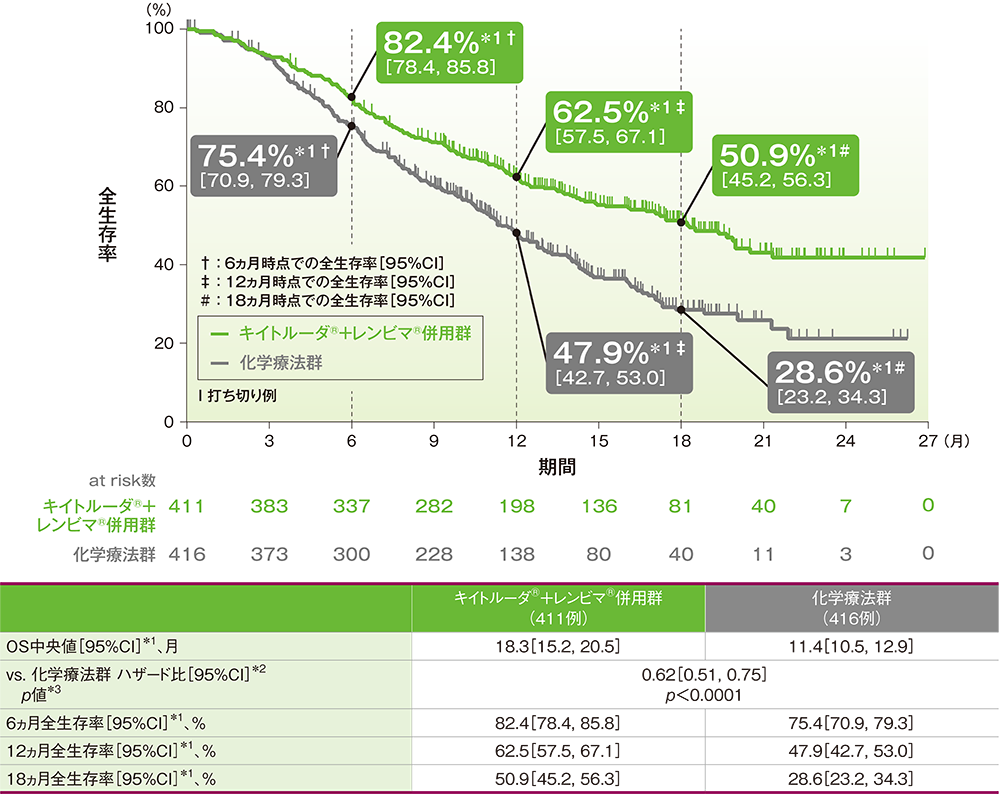
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[MMRステータス(pMMR、dMMR)、pMMR患者ではさらにECOG PS(0、1)、地域(地域1:ヨーロッパ・アメリカ・カナダ・オーストラリア・ニュージーランド・イスラエル、地域2:その他の地域)、骨盤照射による放射線治療歴(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0064(検証的解析結果)
(追跡期間中央値:キイトルーダ®+レンビマ®併用群 12.2ヵ月、化学療法群 10.7ヵ月、データカットオフ日:2020年10月26日)
サブグループ解析:部分集団因子別の全生存期間(OS)
■全体集団における全生存期間(OS)のハザード比のフォレストプロット(ITT集団)
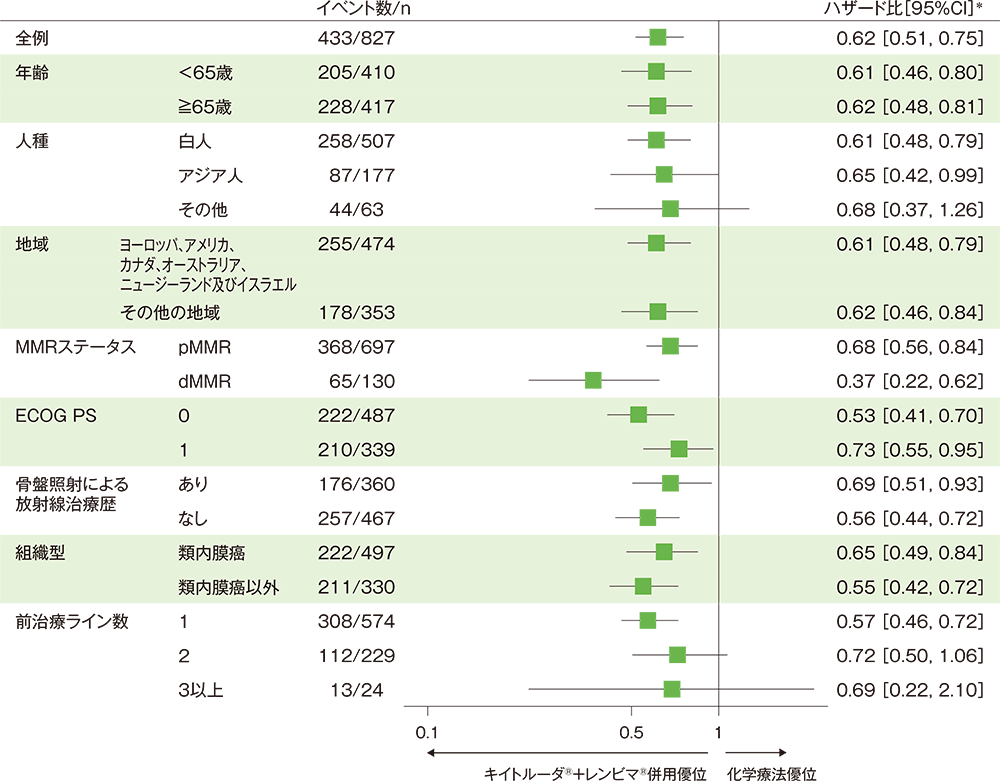
*全例、pMMR:投与群を共変量とし、無作為化に用いた層別因子[MMRステータス(pMMR、dMMR)、pMMR患者ではさらにECOG PS(0、1)、地域(地域1:ヨーロッパ・アメリカ・カナダ・オーストラリア・ニュージーランド・イスラエル、地域2:その他の地域)、骨盤照射による放射線治療歴(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく、サブグループ:Cox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®+レンビマ®併用群 12.2ヵ月、化学療法群 10.7ヵ月、データカットオフ日:2020年10月26日)
主要評価項目:全体集団における無増悪生存期間(PFS)(優越性試験)
PFS中央値は、キイトルーダ®+レンビマ®併用群で7.2ヵ月(95%CI: 5.7, 7.6)、化学療法群で3.8ヵ月(95%CI: 3.6, 4.2)でした。化学療法群に対するキイトルーダ®+レンビマ®併用群のハザード比は0.56(95%CI: 0.47, 0.66)であり、PFSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.0005、検証的解析結果)。12ヵ月時点の無増悪生存率はそれぞれ31.2%(95%CI: 26.4, 36.0)、13.2%(95%CI: 9.3, 17.8)でした。
■全体集団における無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
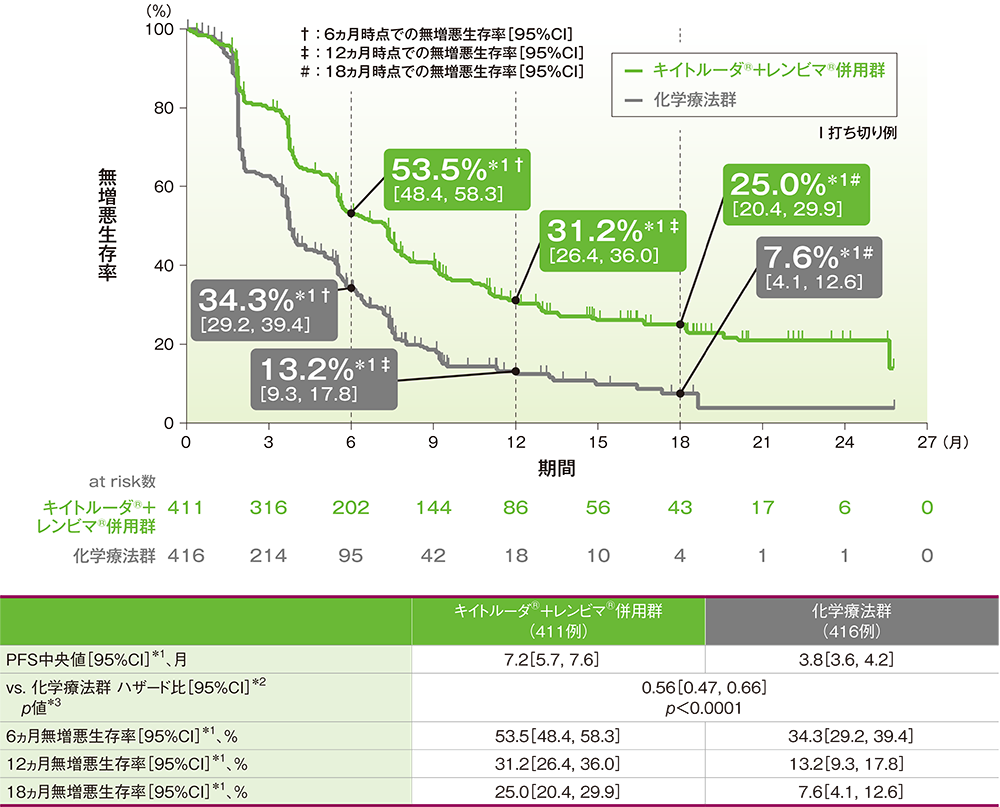
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為化に用いた層別因子[MMRステータス(pMMR、dMMR)、pMMR患者ではさらにECOG PS(0、1)、地域(地域1:ヨーロッパ・アメリカ・カナダ・オーストラリア・ニュージーランド・イスラエル、地域2:その他の地域)、骨盤照射による放射線治療歴(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく
*3 無作為化に用いた層別因子を層別因子とした層別ログランク検定[片側]、有意水準α=0.0005(検証的解析結果)
(追跡期間中央値:キイトルーダ®+レンビマ®併用群 12.2ヵ月、化学療法群 10.7ヵ月、データカットオフ日:2020年10月26日)
サブグループ解析:部分集団因子別の無増悪生存期間(PFS)
■全体集団における無増悪生存期間(PFS)のハザード比のフォレストプロット(ITT集団)
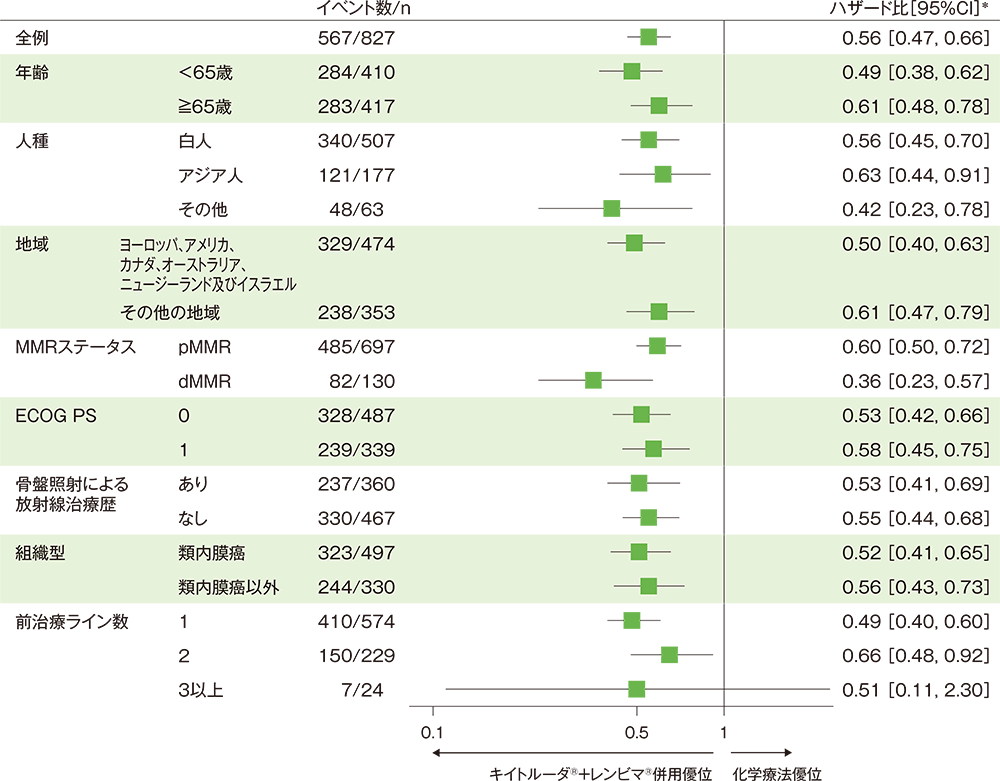
*全例、pMMR:投与群を共変量とし、無作為化に用いた層別因子[MMRステータス(pMMR、dMMR)、pMMR患者ではさらにECOG PS(0、1)、地域(地域1:ヨーロッパ・アメリカ・カナダ・オーストラリア・ニュージーランド・イスラエル、地域2:その他の地域)、骨盤照射による放射線治療歴(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく、サブグループ:Cox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®+レンビマ®併用群 12.2ヵ月、化学療法群 10.7ヵ月、データカットオフ日:2020年10月26日)
安全性
キイトルーダ®+レンビマ®併用群
キイトルーダ®+レンビマ®併用群では、副作用は395/406例(97.3%)に認められました。主な副作用(発現率20%以上)は、高血圧249例(61.3%)、甲状腺機能低下症222例(54.7%)、下痢171例(42.1%)、悪心158例(38.9%)、食欲減退151例(37.2%)、疲労113例(27.8%)、蛋白尿105例(25.9%)、嘔吐98例(24.1%)、体重減少91例(22.4%)、関節痛87例(21.4%)、手掌・足底発赤知覚不全症候群84例(20.7%)でした。
重篤な副作用は137例(33.7%)に認められ、2例以上にみられた重篤な副作用は、高血圧17例(4.2%)、大腸炎、食欲減退、嘔吐各7例(1.7%)、下痢6例(1.5%)、急性腎障害、発熱各4例(1.0%)、脱水、肺臓炎、甲状腺機能亢進症、胆嚢炎、1型糖尿病、女性生殖器瘻各3例(0.7%)、副腎機能不全、悪心、甲状腺機能低下症、心筋梗塞、胃腸出血、消化管穿孔、腸管穿孔、急性膵炎、疲労、免疫性肝炎、肝障害、過敏症、高血糖、低ナトリウム血症、関節炎、筋炎、脳血管発作、腎不全、低血圧各2例(0.5%)でした。
副作用によるキイトルーダ®及びレンビマ®の投与中止は20例(4.9%)に認められ、内訳は、血栓性微小血管症、心筋梗塞、心筋炎、虹彩毛様体炎、下痢、腸炎、消化管穿孔、全身健康状態悪化、多臓器機能不全症候群、アナフィラキシー反応、アラニンアミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加、血中アルカリホスファターゼ増加、血中ビリルビン増加、肝酵素上昇、トランスアミナーゼ上昇、関節炎、出血性卒中、視神経炎、自己免疫性腎炎、慢性腎臓病、腎不全、呼吸不全、スティーヴンス・ジョンソン症候群各1例(0.2%)でした。
副作用によるキイトルーダ®の投与中止は44例(10.8%)に認められ、2例以上にみられた副作用によるキイトルーダ®の投与中止は、アラニンアミノトランスフェラーゼ増加、肺臓炎各4例(1.0%)、免疫性肝炎、アスパラギン酸アミノトランスフェラーゼ増加、下痢各3例(0.7%)、大腸炎、血中アルカリホスファターゼ増加、斑状丘疹状皮疹各2例(0.5%)でした。
副作用によるレンビマ®の投与中止は98例(24.1%)に認められ、2例以上にみられた副作用によるレンビマ®の投与中止は、高血圧9例(2.2%)、無力症8例(2.0%)、体重減少7例(1.7%)、食欲減退6例(1.5%)、蛋白尿、下痢各5例(1.2%)、嘔吐4例(1.0%)、手掌・足底発赤知覚不全症候群3例(0.7%)、消化管穿孔、悪心、粘膜の炎症、血中クレアチニン増加、脳出血、脳血管発作、急性腎障害、女性生殖器瘻、肺塞栓症、低血圧各2例(0.5%)でした。
副作用による死亡は6例(1.5%)に認められ、内訳は、心筋梗塞、右室機能不全、大腸炎、多臓器機能不全症候群、骨髄異形成症候群、脳血管発作各1例(0.2%)でした。
化学療法群
化学療法群では、副作用は364/388例(93.8%)に認められました。主な副作用(発現率20%以上)は、悪心157例(40.5%)、貧血150例(38.7%)、好中球減少症129例(33.2%)、脱毛症117例(30.2%)、好中球数減少93例(24.0%)、疲労92例(23.7%)でした。
重篤な副作用は56例(14.4%)に認められ、2例以上にみられた重篤な副作用は、発熱性好中球減少症15例(3.9%)、貧血、好中球減少症各7例(1.8%)、心不全3例(0.8%)、嘔吐、下痢、肺炎、うっ血性心不全、上室性頻脈、敗血症各2例(0.5%)でした。
副作用による投与中止は23例(5.9%)に認められ、2例以上にみられた副作用による投与中止は、疲労、呼吸困難各2例(0.5%)でした。
副作用による死亡は9例(2.3%)に認められ、内訳は、肺炎2例(0.5%)、心不全、うっ血性心不全、心原性ショック、中毒性心筋症、敗血症、肺塞栓症、誤嚥各1例(0.3%)でした。
■主な副作用(いずれかの群で発現率5%以上)(APaT集団)
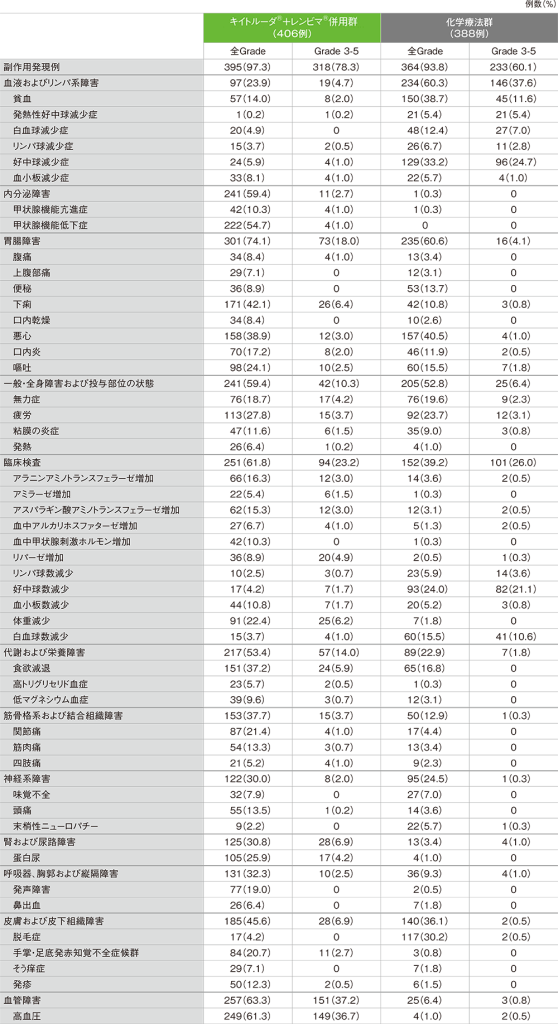
MedDRA/J v23.1、GradeはNCI CTCAE v4.03
(データカットオフ日:2021年2月8日)
■免疫関連など特に注目すべき有害事象(APaT集団)※
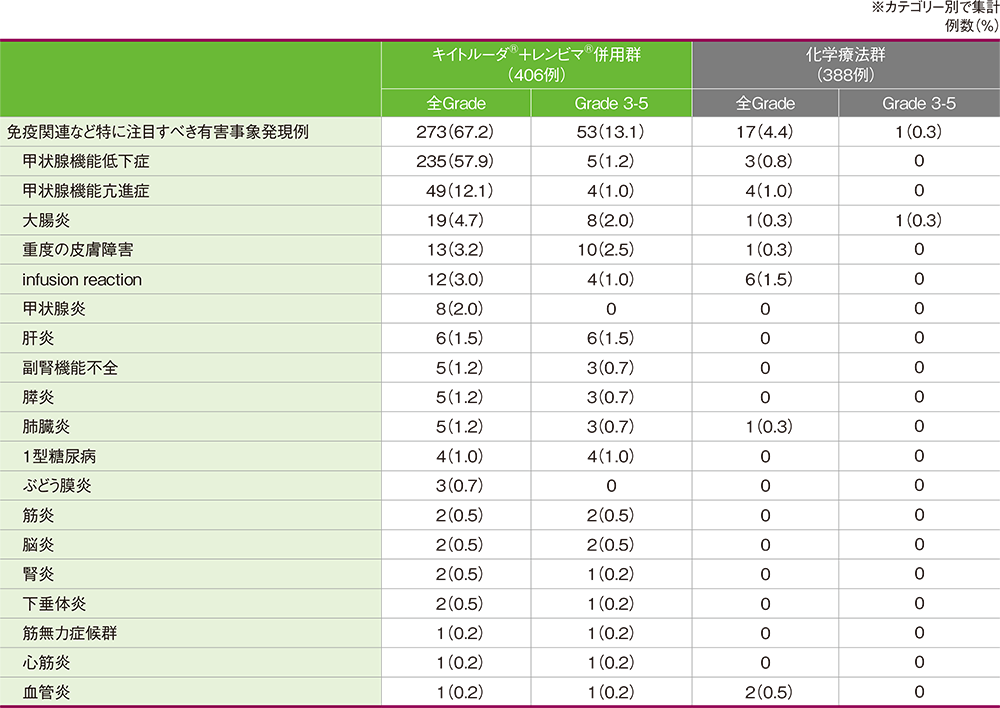
MedDRA/J v23.1、GradeはNCI CTCAE v4.03
(データカットオフ日:2021年2月8日)