KEYNOTE-775/309試験(日本人集団)
子宮体癌:国際共同臨床試験成績
国際共同第Ⅲ相試験<KEYNOTE-775/309試験>(日本人集団)1)
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-775/E7080-309試験)
患者背景(日本人集団)
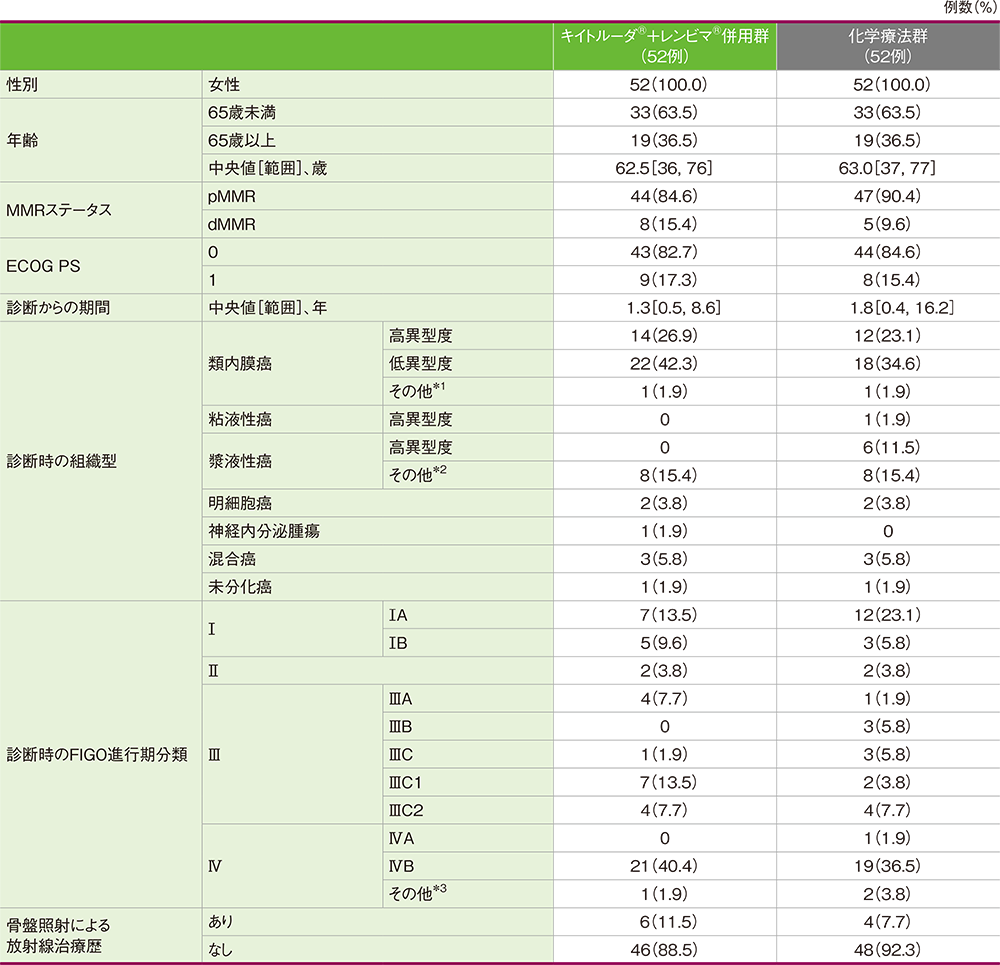
*1 異型度、亜型などの詳細の記載なし
*2 詳細の記載なし
*3 亜分類の記載なし
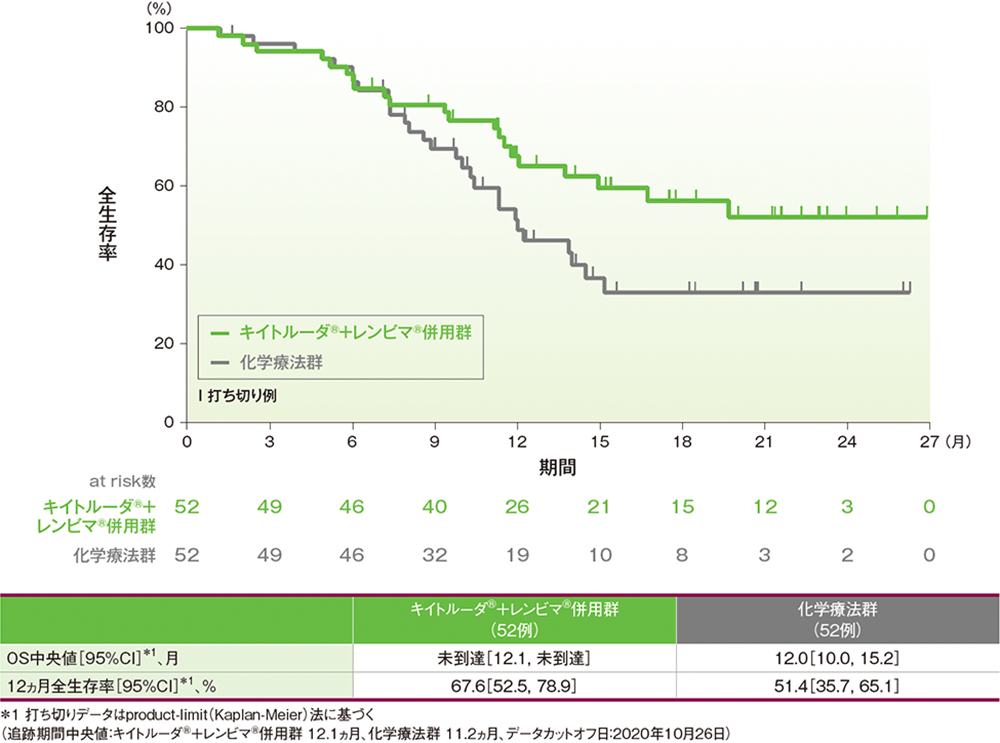
サブグループ解析:日本人集団における全生存期間(OS)
OS中央値は、キイトルーダ®+レンビマ®併用群で未到達(95%CI: 12.1, 未到達)、化学療法群で12.0ヵ月(95%CI: 10.0, 15.2)でした。12ヵ月時点の全生存率はそれぞれ67.6%(95%CI: 52.5, 78.9)、51.4%(95%CI: 35.7, 65.1)でした。
●日本人集団における全生存期間(OS)のKaplan-Meier曲線(ITT集団)
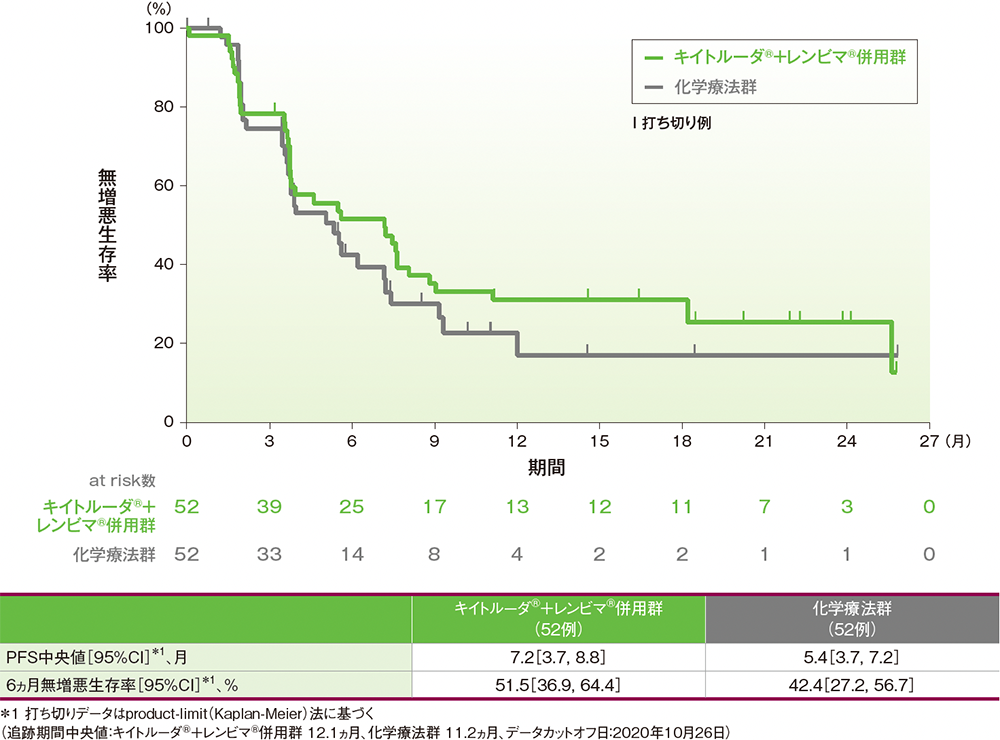
サブグループ解析:日本人集団における無増悪生存期間(PFS)
PFS中央値は、キイトルーダ®+レンビマ®併用群で7.2ヵ月(95%CI: 3.7, 8.8)、化学療法群で5.4ヵ月(95%CI: 3.7, 7.2)でした。6ヵ月時点の無増悪生存率はそれぞれ51.5%(95%CI: 36.9, 64.4)、42.4%(95%CI: 27.2, 56.7)でした。
●日本人集団における無増悪生存期間(PFS)のKaplan-Meier曲線(ITT集団)
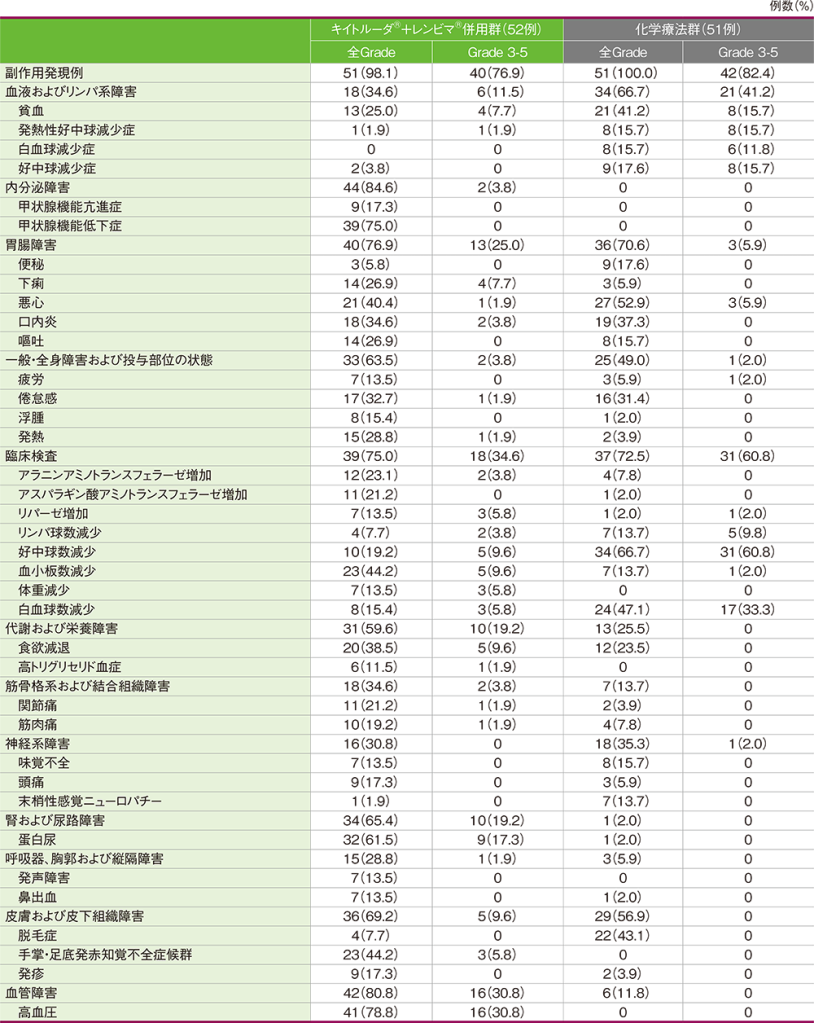
安全性
キイトルーダ®+レンビマ®併用群
キイトルーダ®+レンビマ®併用群では、51/52例(98.1%)に副作用が認められました。主な副作用(発現率20%以上)は、高血圧41例(78.8%)、甲状腺機能低下症39例(75.0%)、蛋白尿32例(61.5%)、血小板数減少、手掌・足底発赤知覚不全症候群各23例 (44.2%)、悪心21例(40.4%)、食欲減退20例(38.5%)、口内炎18例(34.6%)、倦怠感17例(32.7%)、発熱15例(28.8%)、下痢、嘔吐各14例(26.9%)、貧血13例(25.0%)、アラニンアミノトランスフェラーゼ増加12例(23.1%)、アスパラギン酸アミノトランスフェラーゼ増加、関節痛各11例(21.2%)でした。
重篤な副作用は23例(44.2%)に認められ、2例以上にみられた重篤な副作用は、食欲減退4例(7.7%)、消化管穿孔、過敏症、肝障害、発熱各2例(3.8%)でした。
副作用によるキイトルーダ®及びレンビマ®の投与中止は5例(9.6%)に認められ、内訳は、消化管穿孔、アナフィラキシー反応、肝酵素上昇、呼吸不全、スティーヴンス・ジョンソン症候群各1例(1.9%)でした。
副作用によるキイトルーダ®の投与中止は8例(15.4%)に認められ、内訳は、消化管穿孔、アナフィラキシー反応、薬疹、肝酵素上昇、肝炎、肺臓炎、呼吸不全、スティーヴンス・ジョンソン症候群各1例(1.9%)でした。
副作用によるレンビマ®の投与中止は17例(32.7%)に認められ、内訳は、消化管穿孔2例(3.8%)、アナフィラキシー反応、血中クレアチニン増加、脳梗塞、食欲減退、発熱性好中球減少症、肝酵素上昇、過敏症、腸管瘻、リパーゼ増加、下部消化管穿孔、黄斑虚血、機械的イレウス、蛋白尿、呼吸不全、網膜症、スティーヴンス・ジョンソン症候群各1例(1.9%)でした。
副作用による死亡は認められませんでした。
化学療法群
化学療法群では、51/51例(100.0%)に副作用が認められました。主な副作用(発現率20%以上)は、好中球数減少34例(66.7%)、悪心27例(52.9%)、白血球数減少24例(47.1%)、脱毛症22例(43.1%)、貧血21例(41.2%)、口内炎19例(37.3%)、倦怠感16例(31.4%)、食欲減退12例(23.5%)でした。
重篤な副作用は9例(17.6%)に認められ、2例以上にみられた重篤な副作用は、発熱性好中球減少症4例(7.8%)、心不全2例(3.9%)でした。
副作用による投与中止は4例(7.8%)に認められ、内訳は、心不全、労作性呼吸困難、末梢性ニューロパチー、中毒性心筋症各1例(2.0%)でした。
副作用による死亡は2例(3.9%)に認められ、内訳は、心不全、中毒性心筋症各1例(2.0%)でした。
■日本人集団における主な副作用(いずれかの投与群で発現率10%以上)(APaT集団)
MedDRA/J v23.1、GradeはNCI CTCAE v4.03
(データカットオフ日:2021年2月8日)