KEYNOTE-054試験(Adju., Stage Ⅲ)
悪性黒色腫:国際共同臨床試験成績:国際共同第Ⅲ相試験<EORTC-1325-MG/KEYNOTE-054試験>
承認時評価資料: 国際共同第Ⅲ相試験 パート1(EORTC-1325-MG/KEYNOTE-054試験)
Eggermont AMM et al. N Engl J Med 2018; 378: 1789-1801
Eggermont AMM et al. N Engl J Med 2018; 378: 1789-1801 protocol
本試験はMSD社の資金提供により行われた。Alexander M.M EggermontはMSD社から顧問料を受領している。その他の著者にMSD社から顧問料などを受領している者が含まれる。本試験は学術機関に所属の著者らによりデザインされた。データはEORTCにより収集・データベース化され、解析された。著者のうち、Nageatte IbrahimはMSD社の社員であり、MSD社の株式を保有している。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936 data supplement
本試験はMSD社の資金提供により行われた。著者にMSD社から顧問料などを受領している者が含まれる。著者のうち、Clemens Krepler、Nageatte IbrahimはMSD社の社員であり、MSD社の株式を保有している。
試験概要
【目的】
完全切除後の再発リスクが高いⅢ期*1の悪性黒色腫患者における術後補助療法としてのキイトルーダ®の有効性及び安全性をプラセボと比較検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性試験][中間解析結果(データカットオフ日: 2017年10月2日)及び3年フォローアップ解析結果(データカットオフ日: 2019年9月30日)]
【対象】
完全切除後のⅢA期*1(1mm超のリンパ節転移)、ⅢB期*1、ⅢC期*1の悪性黒色腫患者1,019例(日本人15例を含む)
【方法】
パート1: キイトルーダ®群(200mgを3週間間隔[Q3W]で点滴静注)又はプラセボ群(生理食塩液をQ3Wで点滴静注)に1:1の割合で無作為割り付けし、再発又は許容できない毒性が認められるまで最大18回(約1年間)投与した。疾患評価として、無作為割り付け前6週間以内に初回の画像診断を実施し、投与開始後の最初の2年間は12週間毎、その後5年目までは6ヵ月毎、その後は1年毎に実施した。
パート2:プラセボ群は疾患再発後にクロスオーバーを許容し、再発又は許容できない毒性が認められるまで、最長2年間のキイトルーダ®(200mgをQ3Wで点滴静注)投与を可能とした。キイトルーダ®群は、1年間の術後補助療法完了後6ヵ月以降に疾患が再発した場合、再投与として最長1年間(局所再発)又は2年間のキイトルーダ®(200mgをQ3Wで点滴静注)投与を可能とした。投与中は画像診断を12週間毎に実施した。
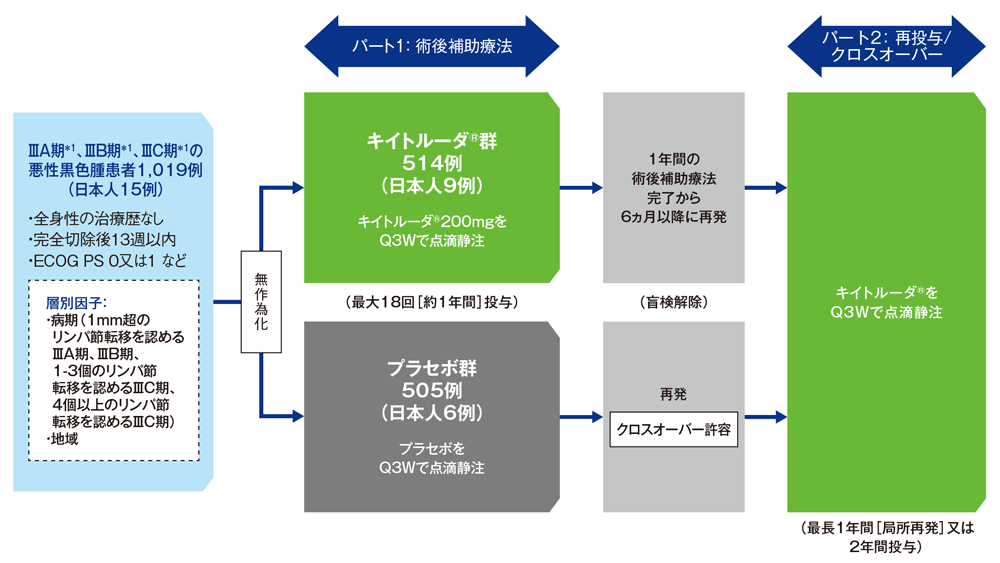
【評価項目】
主要評価項目: 全集団及びPD-L1発現陽性患者*2における無再発生存期間(recurrence-free survival; RFS)※
副次評価項目: 全集団及びPD-L1発現陽性患者*2における無遠隔転移生存期間(distant metastasis-free survival; DMFS)※ 及び全生存期間(overall survival; OS)※、安全性
※検証的解析項目
【判定基準】
再発はCT又はMRIによる画像検査により評価した。
【解析計画】
解析対象集団: 有効性の主要解析対象はITT集団*3とし、安全性の解析対象はASaT集団*4とした。
有効性評価の統計手法: RFS、DMFS及びOSは、Kaplan-Meier法を用いて生存時間の分布を推定した。RFS、DMFS及びOSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いてハザード比とその100(1-α)%の信頼区間(CI)を算出した。層別ログランク検定及び層別Cox比例ハザードモデルでは、病期(1mm超のリンパ節転移を認めるⅢA期、ⅢB期、1-3個のリンパ節転移を認めるⅢC期、4個以上のリンパ節転移を認めるⅢC期)を層別因子として用いた。また、Cox比例ハザードモデルを用いて、性別(男性、女性)、PD-L1発現(陽性、陰性、不明)、BRAF遺伝子変異(あり、なし、不明)、 AJCC病期分類〔リンパ節転移数(1個、2-3個、≧4個)、リンパ節転移の状態(顕微鏡的転移、肉眼的転移)、潰瘍形成(なし、あり)〕別のサブグループ解析を実施した。日本人集団については、ITT集団と同じ統計手法を用いて解析したが、層での調整は行わなかった。
多重性の調整: 本試験では1回の有効性の中間解析と最終解析を事前に計画し、中間解析は約330件の RFS のイベントが報告された後に実施することとした。また、DMFSの最終解析は423件のDMFSイベント、OSの最終解析には380件のOSイベントを観察後に実施することとした。
RFSについてITT集団及びPD-L1陽性集団の両方で優越性が示された場合、本治験を継続し、DMFS及びOSの検定を行う。ITT集団とPD-L1陽性集団の検定間の多重性はBonferroni-Holm法、RFS、DMFS及びOSの間の多重性はゲートキーピング法を適用して調整することとした。これにより、graphical approachで示すように、試験全体の有意水準を片側2.5%となるように厳密に制御した。
本試験では6つの仮説(H1:全集団のRFS、H2:PD-L1発現陽性患者のRFS、H3:全集団のDMFS、H4:PD-L1発現陽性患者のDMFS、H5:全集団のOS、H6:PD-L1発現陽性患者のOS)を設定した。RFSの解析では、H1に有意水準片側0.014を配分し、H2にはSpiessens及びDebois法に基づいたイベント比から算出される有意水準を配分する。H1及びH2が統計学的に有意であった場合、DMFSの検定は有意水準片側0.025で行われる。このとき、H3に有意水準片側0.014を再配分し、H4にはSpiessens及びDebois法に基づいたイベント比から算出される有意水準を配分する。同様に、H3及びH4が統計学的に有意であった場合、OSの検定は有意水準片側0.025で行われ、H5に有意水準片側0.014、H6にはSpiessens及びDebois法に基づいたイベント比から算出される有意水準を配分する。RFSの中間解析の棄却限界値は、O’Brien-Flemingの消費関数に基づくものとする。
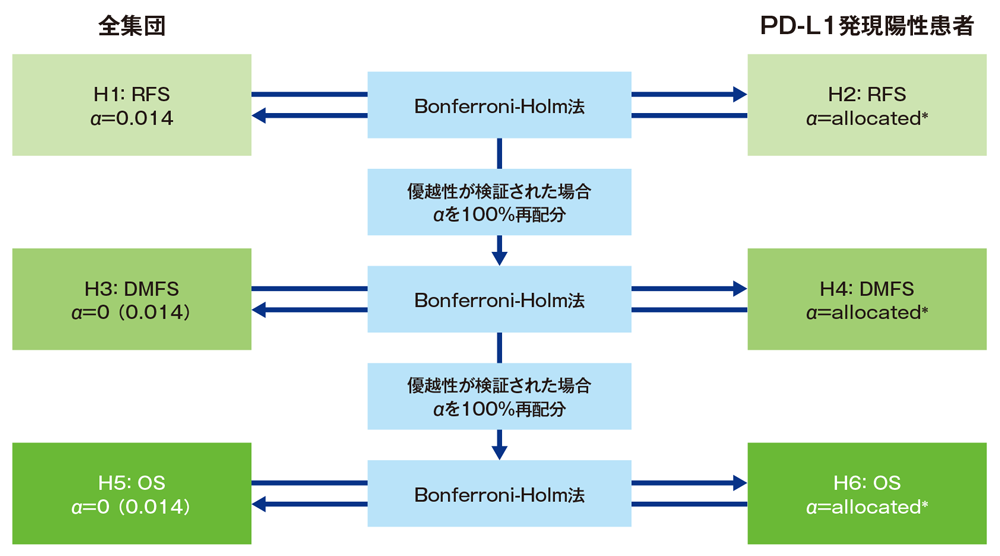
*Spiessens及びDebois法に基づいたイベント比から算出される有意水準
*1 AJCCガイドライン第7版に基づく
*2 PD-L1発現状況は、腫瘍細胞及び腫瘍関連免疫細胞の膜上でのPD-L1の発現割合から判定するMEL scoreを用いて評価した。1%以上の染色を示すMEL score 2以上の場合をPD-L1発現陽性とした
*3 ITT(intention-to-treat)集団: 無作為割り付けされたすべての患者
*4 ASaT(all subjects as treated)集団: 治験薬を1回以上投与されたすべての患者
4.効能又は効果(抜粋)
悪性黒色腫
6.用法及び用量(抜粋)
〈悪性黒色腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
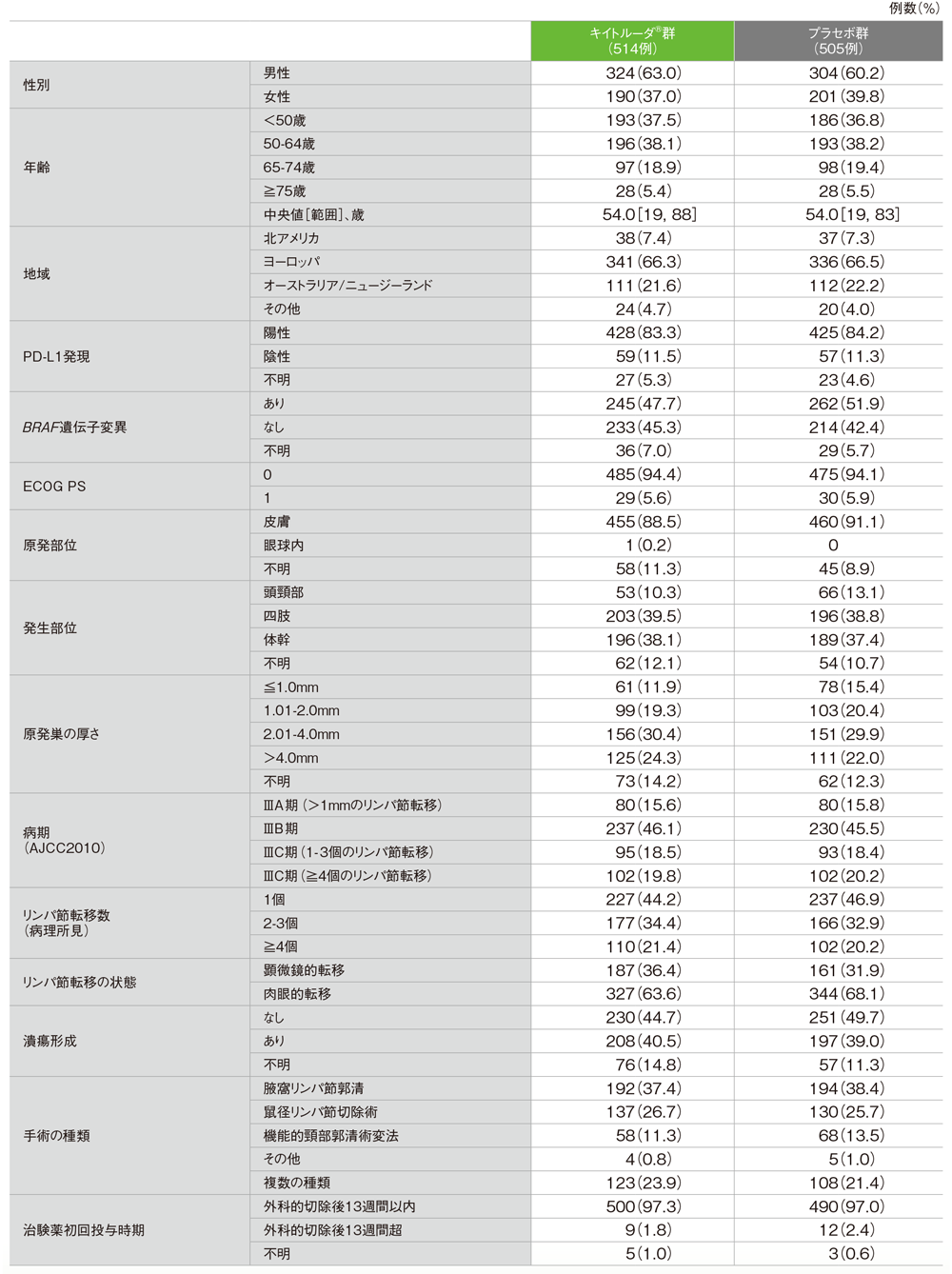
患者背景(ITT集団)
※患者背景、有効性及び安全性についてはパート1のデータをご紹介します。
主要評価項目 無再発生存期間:RFS
- プラセボ群に対するキイトルーダ®群のハザード比は0.57(98.4%CI: 0.43, 0.74)であり、RFSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.008、検証的解析結果)。
- RFS中央値は、キイトルーダ®群で未到達(95%CI: -, -)、プラセボ群で20.4ヵ月(95%CI: 16.2, -)でした。
無再発生存期間(RFS)のKaplan-Meier曲線(ITT集団)
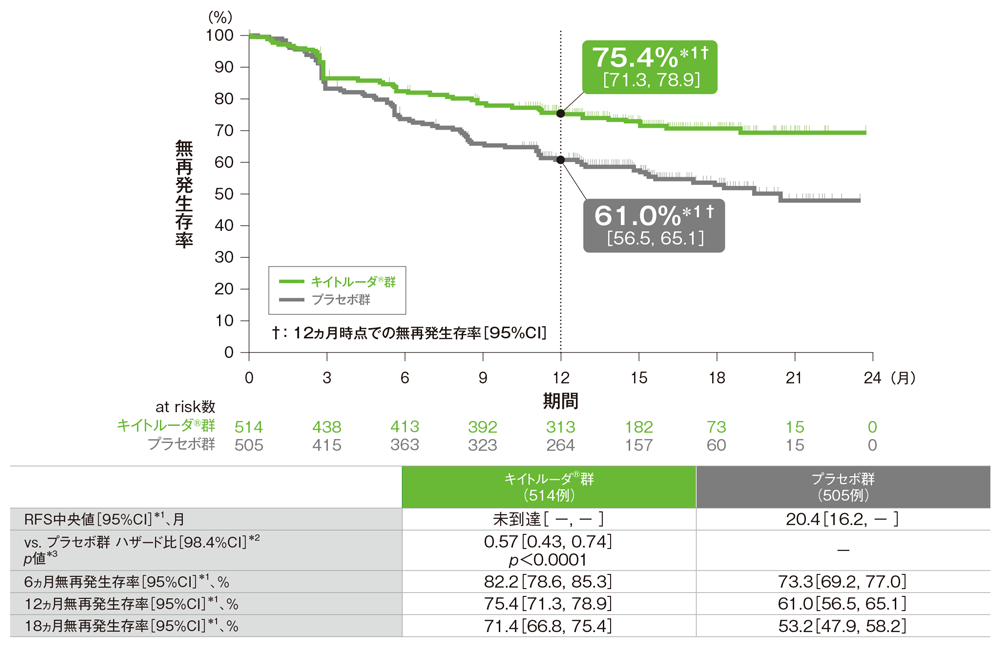
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付け時の病期(1mm超のリンパ節転移を認めるⅢA期、ⅢB期、1-3個のリンパ節転移を認めるⅢC期、4個以上のリンパ節転移を認めるⅢC期)によって層別化されたCox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為割り付け時の病期)、有意水準α=0.008(検証的解析結果)
(追跡期間中央値: 16.0ヵ月、範囲: 2.5, 25.3、データカットオフ日: 2017年10月2日)
主要評価項目 PD-L1発現陽性患者における無再発生存期間:RFS
- プラセボ群に対するキイトルーダ®群のハザード比は0.54(95%CI: 0.42, 0.69)であり、RFSを有意に延長しました(p<0.0001、層別ログランク検定[片側]、有意水準α=0.0155、検証的解析結果)。
- PD-L1発現陽性患者におけるRFS中央値は、キイトルーダ®群で未到達(95%CI: -, -)、プラセボ群で未到達(95%CI: 17.1, -)でした。
PD-L1発現陽性患者における無再発生存期間(RFS)の要約(ITT集団)
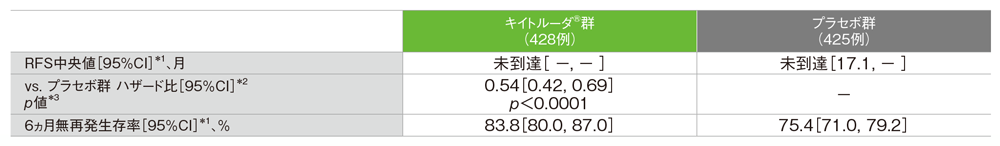
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付け時の病期(1mm超のリンパ節転移を認めるⅢA期、ⅢB期、1-3個のリンパ節転移を認めるⅢC期、4個以上のリンパ節転移を認めるⅢC期)によって層別化されたCox比例ハザードモデルに基づく
*3 層別ログランク検定[片側](層別因子は無作為割り付け時の病期)、有意水準α=0.0155(検証的解析結果)
(追跡期間中央値: 16.0ヵ月、範囲: 2.5, 25.3、データカットオフ日: 2017年10月2日)
サブグループ解析 部分集団因子別の無再発生存期間:RFS
無再発生存期間(RFS)のハザード比のフォレストプロット(ITT集団)
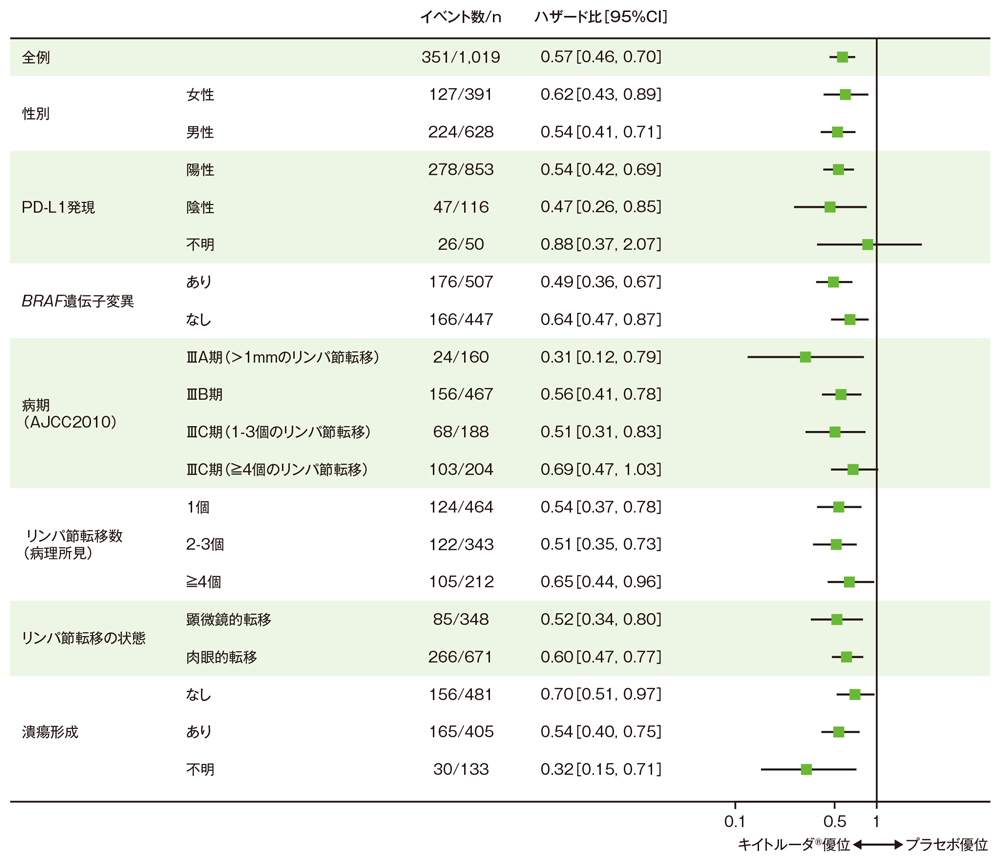
(追跡期間中央値: 16.0ヵ月、範囲: 2.5, 25.3、データカットオフ日: 2017年10月2日)
主要評価項目 無再発生存期間:RFS

- プラセボ群に対するペムブロリズマブ群のハザード比は0.56(95%CI: 0.47, 0.68)でした。
無再発生存期間(RFS)のKaplan-Meier曲線(ITT集団)
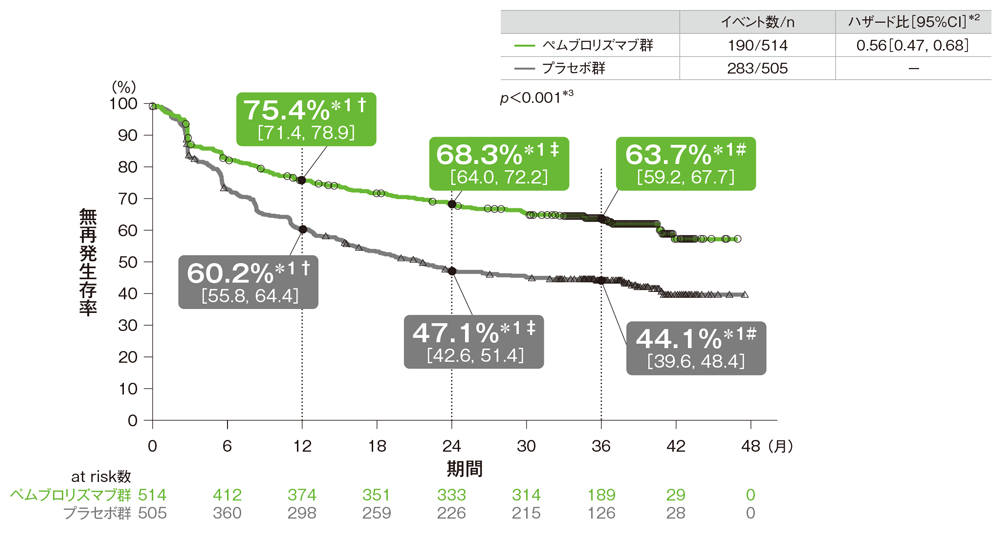
† 1年無再発生存率[95%CI] ‡ 2年無再発生存率[95%CI] # 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付け時の病期(1mm超のリンパ節転移を認めるⅢA期、ⅢB期、1-3個のリンパ節転移を認めるⅢC期、4個以上のリンパ節転移を認めるⅢC期)によって層別化されたCox比例ハザードモデルに基づく
*3 名目上のp値。層別ログランク検定[片側](層別因子は無作為割り付け時の病期)
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
主要評価項目 PD-L1発現陽性患者における無再発生存期間:RFS

- プラセボ群に対するペムブロリズマブ群のハザード比は0.57(99%CI: 0.43, 0.74)でした。
PD-L1発現陽性患者における無再発生存期間(RFS)のKaplan-Meier曲線(ITT集団)
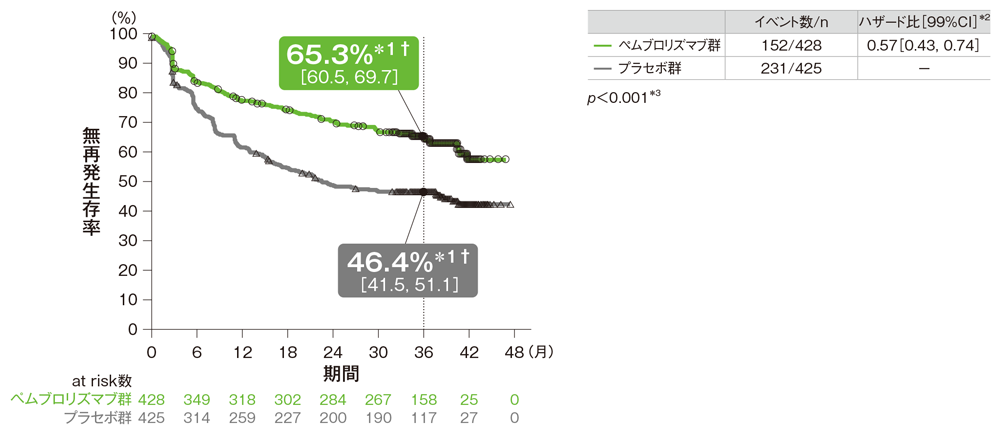
† 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付け時の病期(1mm超のリンパ節転移を認めるⅢA期、ⅢB期、1-3個のリンパ節転移を認めるⅢC期、4個以上のリンパ節転移を認めるⅢC期)によって層別化されたCox比例ハザードモデルに基づく
*3 名目上のp値。層別ログランク検定[片側](層別因子は無作為割り付け時の病期)
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
サブグループ解析 PD-L1発現陰性患者における無再発生存期間:RFS

PD-L1発現陰性患者における無再発生存期間(RFS)のKaplan-Meier曲線(ITT集団)
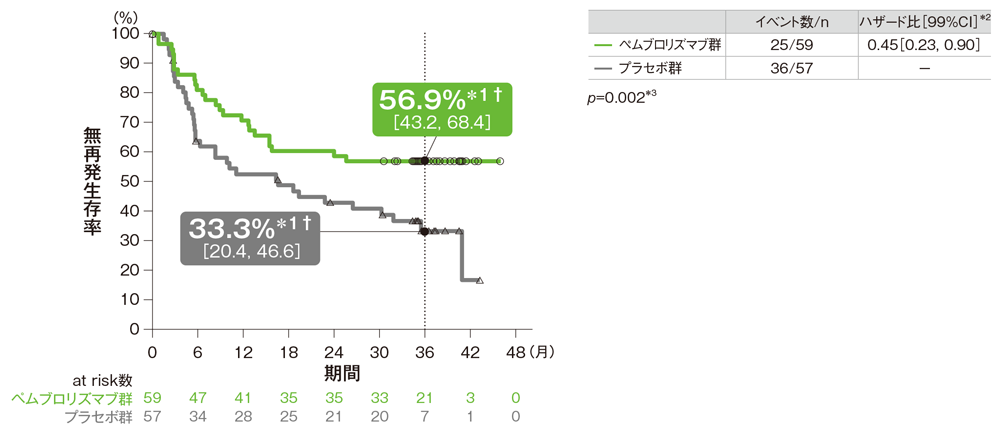
† 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、無作為割り付け時の病期(1mm超のリンパ節転移を認めるⅢA期、ⅢB期、1-3個のリンパ節転移を認めるⅢC期、4個以上のリンパ節転移を認めるⅢC期)によって層別化されたCox比例ハザードモデルに基づく
*3 名目上のp値。層別ログランク検定[片側](層別因子は無作為割り付け時の病期)
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
サブグループ解析 病期(AJCC第7版)別の無再発生存期間:RFS

ⅢA期の患者における無再発生存期間(RFS)のKaplan-Meier曲線
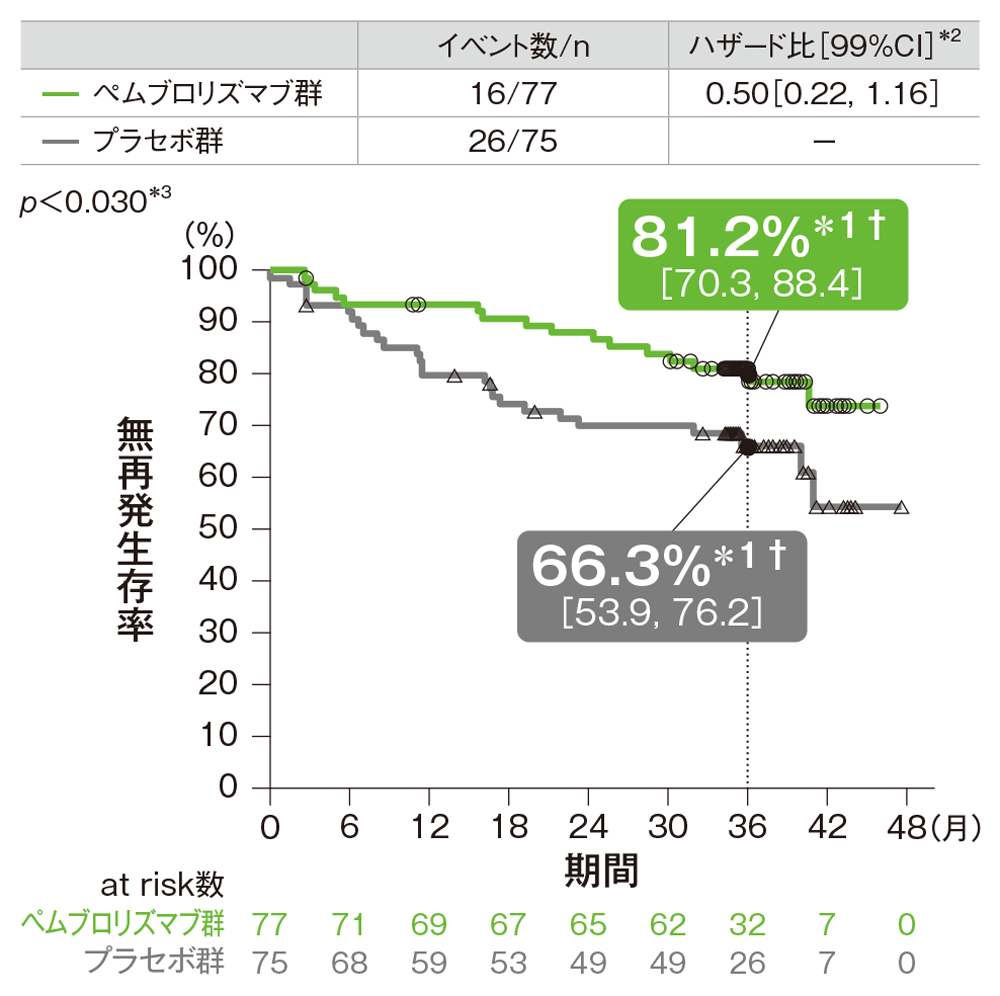
† 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
*3 名目上のp値。ログランク検定[片側]
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936
(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
ⅢB期の患者における無再発生存期間(RFS)のKaplan-Meier曲線
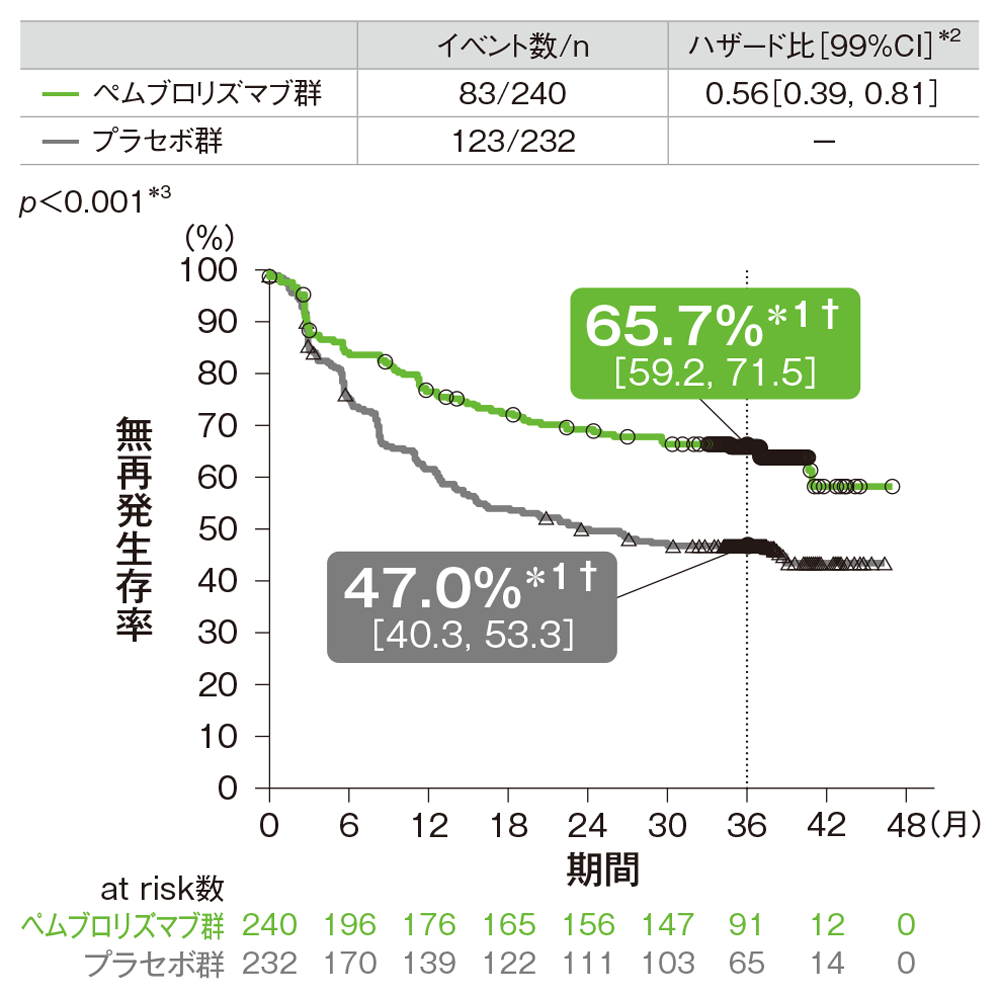
† 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
*3 名目上のp値。ログランク検定[片側]
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936
(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
ⅢC期の患者における無再発生存期間(RFS)のKaplan-Meier曲線
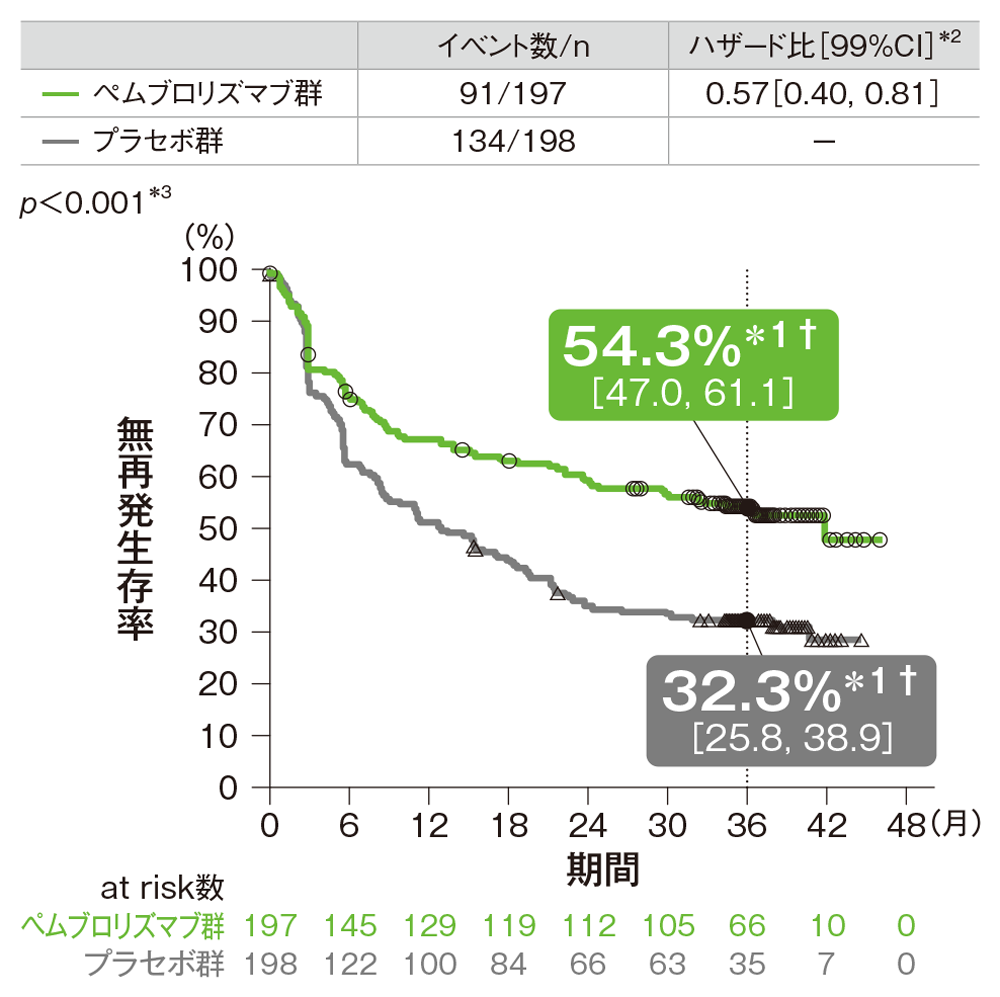
† 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
*3 名目上のp値。ログランク検定[片側]
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936
(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
サブグループ解析 BRAF -V600E/K遺伝子変異有無別の無再発生存期間:RFS

BRAF -V600E/K遺伝子変異ありの患者における無再発生存期間(RFS)のKaplan-Meier曲線
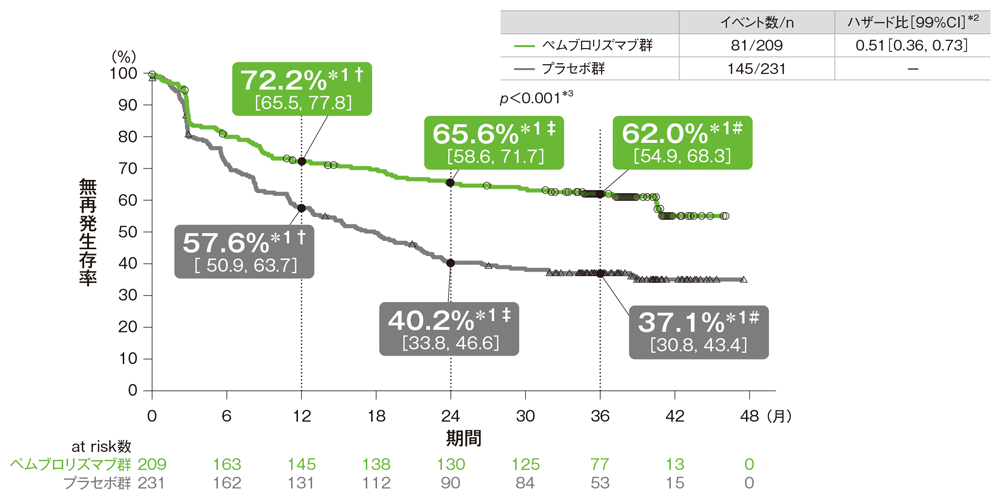
† 1年無再発生存率[95%CI] ‡ 2年無再発生存率[95%CI] # 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
*3 名目上のp値。ログランク検定[片側]
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
BRAF -V600E/K遺伝子変異なしの患者における無再発生存期間(RFS)のKaplan-Meier曲線
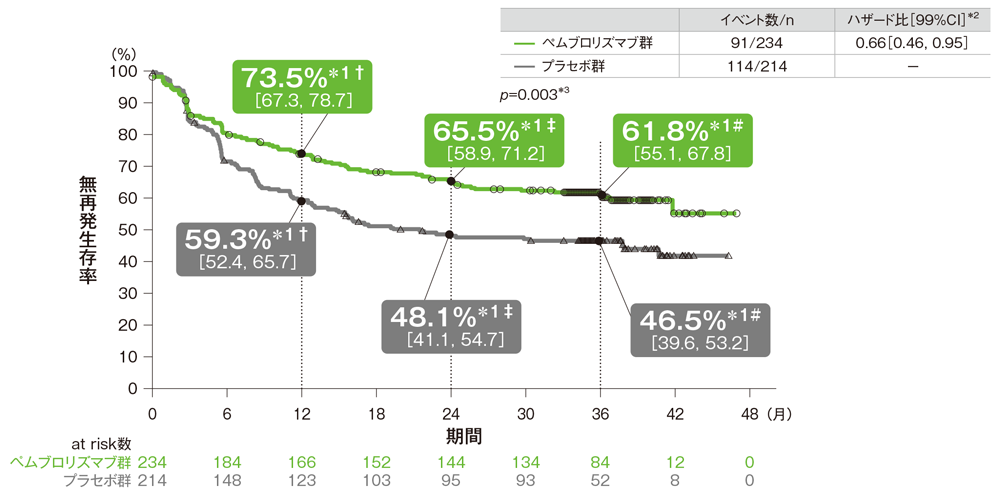
† 1年無再発生存率[95%CI] ‡ 2年無再発生存率[95%CI] # 3年無再発生存率[95%CI]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデルに基づく
*3 名目上のp値。ログランク検定[片側]
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカ ットオフ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/
安全性
副作用(ASaT集団)
キイトルーダ®群
- 副作用は396/509例(77.8%)に認められ、主な副作用(発現率10%以上)は疲労143例(28.1%)、下痢94例(18.5%)、そう痒症85例(16.7%)、甲状腺機能低下症73例(14.3%)、悪心58例(11.4%)、関節痛51例(10.0%)でした。
- 重篤な副作用は66例(13.0%)に認められ、2例以上にみられた重篤な副作用は大腸炎8例(1.6%)、肺臓炎7例(1.4%)、下痢4例(0.8%)、アスパラギン酸アミノトランスフェラーゼ増加、自己免疫性大腸炎、下垂体炎、1型糖尿病各3例(0.6%)、アラニンアミノトランスフェラーゼ増加、自己免疫性肝炎、食欲減退、糖尿病性ケトアシドーシス、疲労、肺塞栓症、サルコイドーシス、甲状腺炎各2例(0.4%)でした。
- 副作用による中止は62例(12.2%)に認められ、その内訳は肺臓炎7例(1.4%)、大腸炎6例(1.2%)、下痢5例(1.0%)、アラニンアミノトランスフェラーゼ増加4例(0.8%)、サルコイドーシス、関節痛、肝炎各3例(0.6%)、肺塞栓症、自己免疫性肝炎、疲労、アスパラギン酸アミノトランスフェラーゼ増加、1型糖尿病各2例(0.4%)、虹彩毛様体炎、糖尿病性ケトアシドーシス、心筋炎、重症筋無力症、甲状腺機能亢進症、甲状腺機能低下症、顕微鏡的大腸炎、血中クレアチンホスホキナーゼ増加、下垂体機能低下症、下垂体炎、発疹、小腸炎、そう痒症、食欲減退、血小板減少症、筋炎、γ-グルタミルトランスフェラーゼ増加、唾液欠乏、自己免疫性心膜炎、気管支炎、心障害、胃炎、浮腫、口腔扁平苔癬、乳頭炎、末梢性感覚ニューロパチー、リウマチ性多発筋痛、関節リウマチ、小腸穿孔、全身性炎症反応症候群各1例(0.2%)でした。
- 副作用による死亡は、好酸球増加と全身症状を伴う薬物反応が1例(0.2%)に認められました。
プラセボ群
- 副作用は332/502例(66.1%)に認められ、主な副作用(発現率10%以上)は疲労135例(26.9%)、下痢82例(16.3%)でした。
- 重篤な副作用は6例(1.2%)に認められ、その内訳は下痢、低ナトリウム血症、蜂巣炎、膵炎、ウイルス性上気道感染、続発性副腎皮質機能不全各1例(0.2%)でした。
- 副作用による中止は8例(1.6%)に認められ、その内訳はアラニンアミノトランスフェラーゼ増加、アスパラギン酸アミノトランスフェラーゼ増加、γ-グルタミルトランスフェラーゼ増加、肝炎、肺臓炎、続発性副腎皮質機能不全、自己免疫性大腸炎、うつ病、味覚異常、膵炎各1例(0.2%)でした。
- 副作用による死亡は認められませんでした。
主な副作用(いずれかの投与群で発現率5%以上)
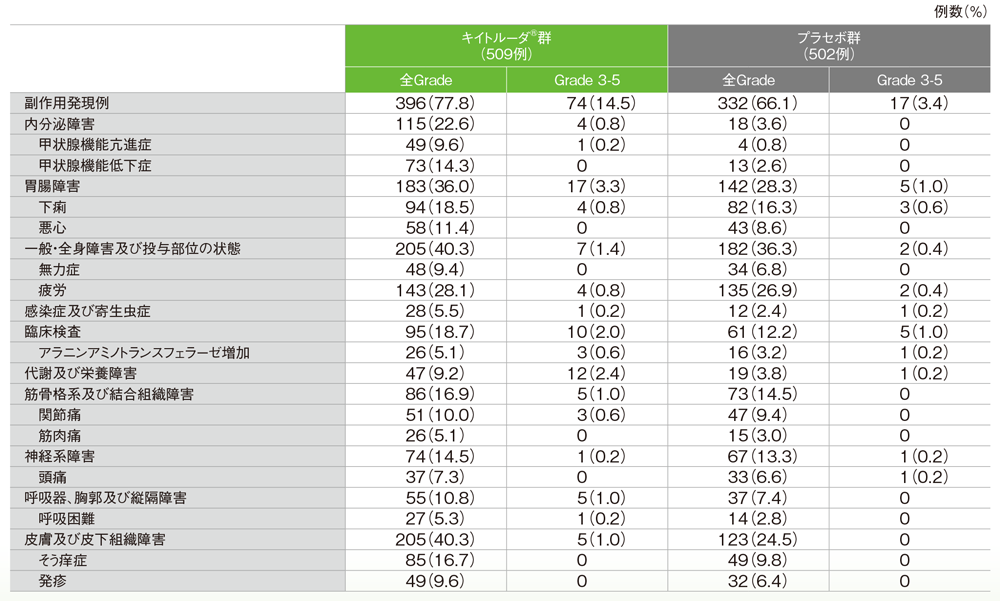
MedDRA/J v20.1、GradeはCTC AE v4.03
免疫関連など特に注目すべき有害事象(ASaT集団)
キイトルーダ®群
- 免疫関連など特に注目すべき有害事象は173/509例(34.0%)に認められ、主な免疫関連など特に注目すべき有害事象(発現率10%以上)は、甲状腺機能低下症75例(14.7%)、甲状腺機能亢進症53例(10.4%)でした。
免疫関連など特に注目すべき有害事象
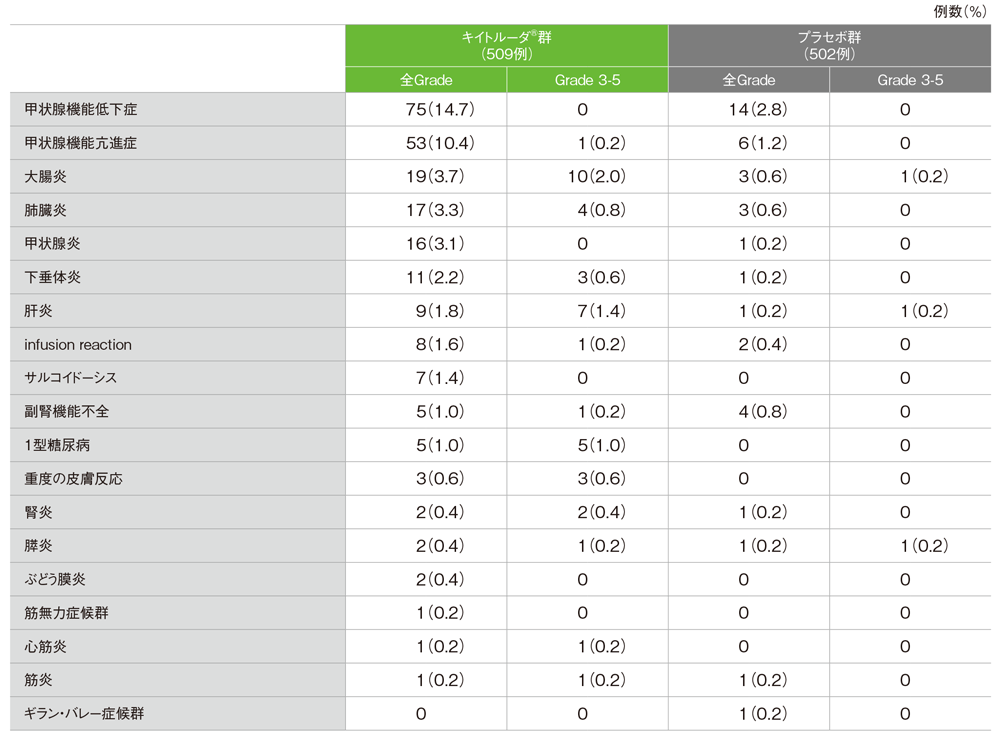
MedDRA/J v20.1、GradeはCTCAE v4.03
主な副作用(ASaT集団)

ペムブロリズマブ群
- 副作用は398/509例(78.8%)、Grade 3-5の副作用は74例(14.5%)に認められました。
- 副作用による死亡は、筋炎が1例(0.2%)に認められました。
プラセボ群
- 副作用は333/502 例(66.3%)、Grade 3-5の副作用は17例(3.4%)に認められました。
- 副作用による死亡は認められませんでした。
*文献に主な副作用の内訳、重篤な副作用、副作用による投与中止の発現割合及び内訳についての記載なし
免疫関連など特に注目すべき有害事象(ASaT集団)

ペムブロリズマブ群
- 免疫関連など特に注目すべき有害事象は192/509例(37.7%)に認められ、主な免疫関連など特に注目すべき有害事象(発現率10%以上)は、甲状腺機能低下症74例(14.5%)、甲状腺機能亢進症51例(10.0%)でした。
免疫関連など特に注目すべき有害事象
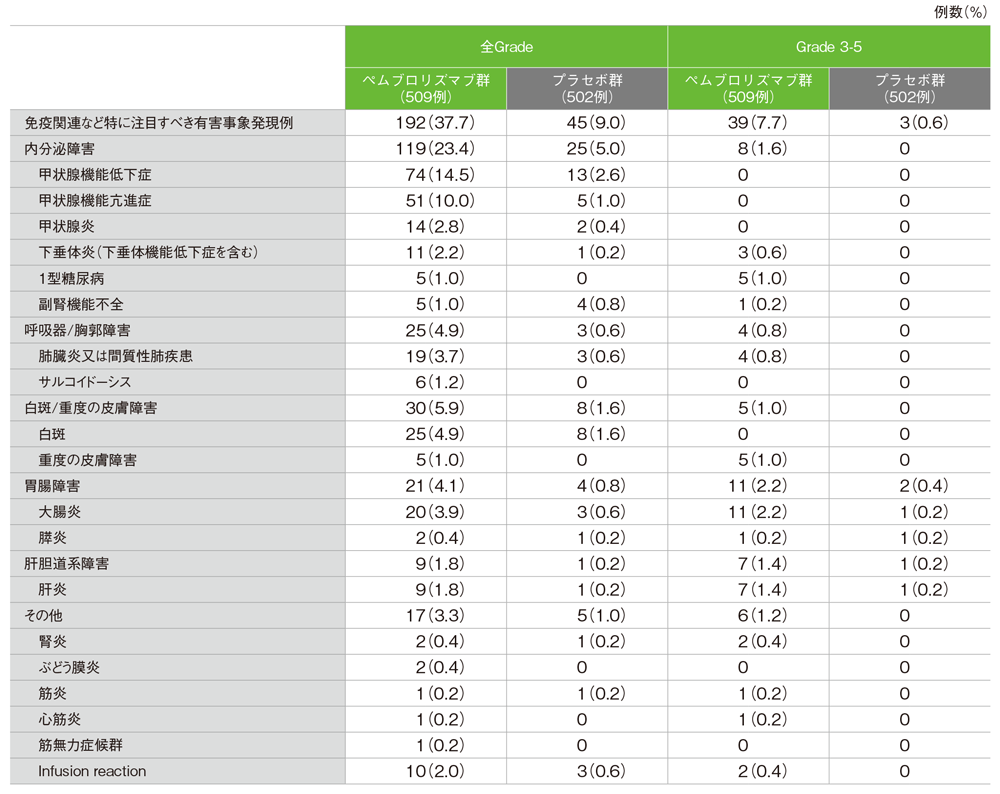
GradeはCTCAE v4.0
(追跡期間中央値: 36.6ヵ月、四分位範囲: 35.0, 40.2、データカットオ フ日: 2019年9月30日)
※出版社の意向により一般名を使用しています。
Eggermont AMM et al. J Clin Oncol 2020; 38: 3925-3936(本試験はMSD社の資金提供により行われた)
Reprinted with permission. © 2022 American Society of Clinical Oncology.
All rights reserved. Eggermont AMM et al: J Clin Oncol 38(33), 2020: 3925-3936.
https://ascopubs.org/journal/jco/

