KEYNOTE-689試験
国際共同第Ⅲ相試験(KEYNOTE-689試験)
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-689試験)
Uppaluri R, et al. N Engl J Med. 2025; 393: 37-50
Uppaluri R, et al. N Engl J Med. 2025; 393: 37-50 Supplementary appendix
(本試験はMSD社の資金提供により行われた。著者のうち、Burak Gumuscu、Cole Manschot、Kimberly Thomasは同社の社員である。
その他の著者にMSD社のコンサルタントや、講演料等を受領した者が含まれる。)
試験概要
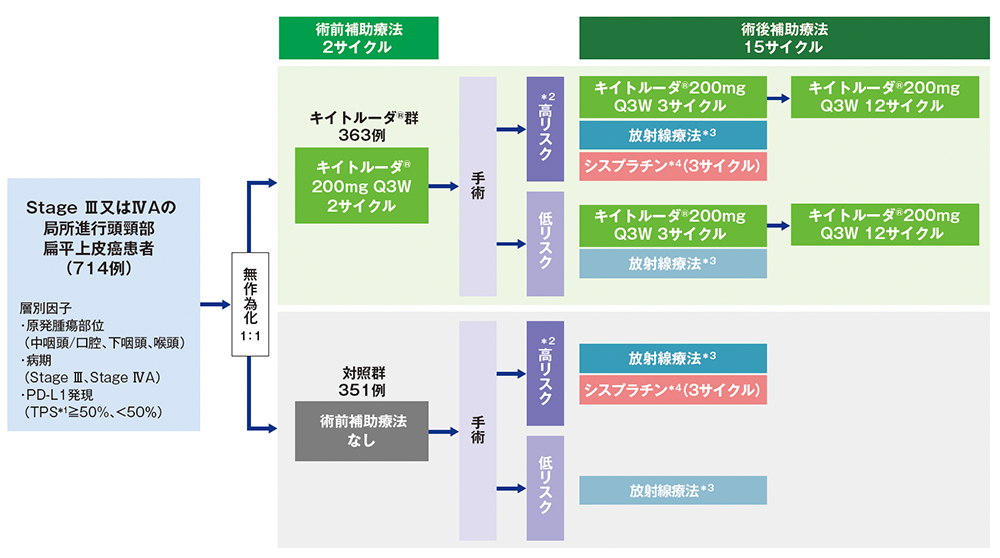
【目的】切除可能なStage Ⅲ又はⅣAの局所進行頭頸部扁平上皮癌の未治療患者に対する、キイトルーダ®群[キイトルーダ®による術前補助療法及びキイトルーダ® +標準療法(放射線療法±シスプラチン)による術後補助療法]と対照群(術前補助療法は実施なし、標準療法による術後補助療法)の有効性と安全性を比較検討する。
【デザイン】国際共同無作為化非盲検実薬対照第Ⅲ相試験[優越性検証試験][第1回中間解析結果(データカットオフ日:2024年7月25日)]
【対象】新たに診断された切除可能なStage Ⅲ又はⅣAの局所進行頭頸部扁平上皮癌の未治療患者714例(日本人46例を含む)
【方法】キイトルーダ®群と対照群に1:1の割合で無作為に割り付け、以下の用法及び用量で投与した。
キイトルーダ®群:キイトルーダ®200mg 3週間間隔投与(2サイクル)による術前補助療法を実施後に手術を行い、その後キイトルーダ®200mg 3週間間隔投与及び放射線療法±シスプラチン100mg/m2 3週間間隔投与の併用療法(3サイクル)、続いてキイトルーダ®200mg 3週間間隔投与(12サイクル)による術後補助療法を実施。
対照群:術前補助療法を実施せずに手術を行い、その後放射線療法±シスプラチン100mg/m2 3週間間隔投与の併用療法(3サイクル)による術後補助療法を実施。
術後補助療法において、再発のリスクが高いと判断された患者は、キイトルーダ®群、対照群いずれにおいてもシスプラチンを併用した。
Q3W:3週間間隔
*1 TPS(tumor proportion score):腫瘍細胞のうちPD-L1発現陽性細胞の割合
*2 手術検体の断端陽性(1mm未満)又はリンパ節外浸潤陽性(扁平上皮癌細胞がリンパ節内から線維膜を通過して周囲結合組織に浸潤することと定義)
*3 高リスク患者の場合は66Gy/33回、低リスク患者の場合は60Gy/30回、肉眼的残存病変を有する患者の場合は70Gy/35回照射した。
*4 シスプラチンは、治験実施医療機関の病理医により高リスクと判断された患者、手術を受けなかった患者、又は不完全切除(肉眼的残存病変あり)患者にのみ投与し、100mg/m2 Q3Wで3サイクル投与した。
【評価項目】主要評価項目:全患者、CPS*5≧1患者、CPS≧10患者における無イベント生存期間(EFS)#,*6
副次評価項目:全患者、CPS≧1患者、CPS≧10患者における全生存期間(OS)#、病理学的奏効(mPR)率#,*7、病理学的完全奏効(pCR)率*8、健康関連QOLに関する患者報告アウトカム(patient-reported outcomes;PRO)、安全性
# 検証的解析項目
【判定基準】EFSは盲検下独立中央画像判定機関(BICR)がRECISTガイドライン1.1版に基づき評価した。mPR率、pCR率は中央判定病理医(BIPR)により盲検下で評価された。健康関連QOLに関するPROは欧州がん研究・治療機構(European Organisation for Research and Treatment of Cancer;EORTC)QLQ-C30、EORTC QLQ-H&N35を用いて評価した。
【解析計画】解析対象集団:有効性はITT集団*9、安全性はAPaT集団*10を解析対象とした。PROの解析はFAS集団*11を対象とした。
有効性の統計手法:EFS及びOSはKaplan-Meier法を用いて推定した。EFS及びOSは層別ログランク検定を用いて群間を比較し、投与群のみを共変量とした層別Cox比例ハザードモデルを用いてハザード比及びその95%信頼区間(95%CI)を算出した。mPR率及びpCR率の群間比較には、例数で重み付けした層別Miettinen and Nurminen法を用いた。層別ログランク検定、層別Cox比例ハザードモデル及び層別Miettinen and Nurminen法の層別因子には、無作為割付けに用いる2つの層別因子(原発腫瘍部位*12及び病期*13)を用いた。
主要評価項目(EFS)のサブグループ解析を年齢(<65歳、≧65歳)、性別(女性、男性)、人種(白人、その他)、地域(北米、EU、その他の地域)、原発腫瘍部位(中咽頭/口腔、下咽頭、喉頭)、病期(Stage Ⅲ、Stage ⅣA)、PD-L1発現状況(TPS≧50%、<50%)、喫煙歴(喫煙歴なし、喫煙歴あり、現喫煙者)について、投与群を共変量とした非層別Cox比例ハザードモデルによりハザード比及び95%CIを算出した。ただし、CPS≧10の解析対象集団に対しては、サブグループの各項目での10%未満の集団の場合、当該項目のサブグループ解析は実施しなかった。
日本人集団については、ITT集団と同じ統計手法を用いて解析したが、層での調整は行わなかった。また、治験実施計画書に規定されていないが、mPR又はpCR達成の有無別並びにPD-L1発現別(1≦CPS<10及びCPS<1)のEFSに対するサブグループ解析を実施し、評価資料として承認時に評価された。
PRO評価の統計手法:EORTC QLQ-C30の全般的な健康状態/QOLスコア及びEORTC QLQ-H&N35スコアのベースラインからの変化量は、これらPROスコアを応答変数とし、投与群、時点、投与群と時点の交互作用及び3つの層別因子(原発腫瘍部位、病期及びPD-L1発現状況*14 )を共変量に含めたcLDA(constrained longitudinal data analysis)モデルを用いて解析した。
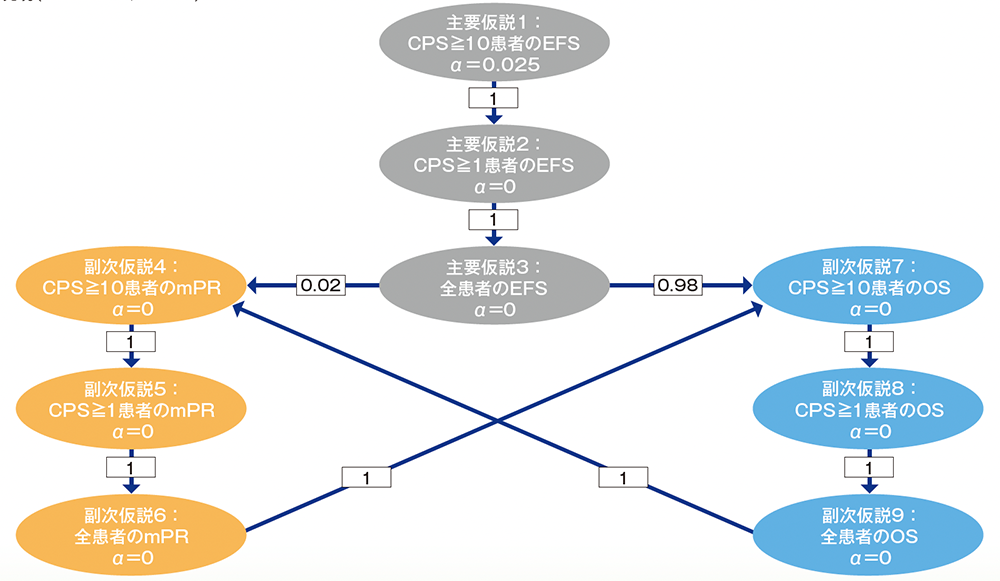
多重性の調整:本試験は2回の中間解析及び最終解析を事前に計画し、第1回中間解析ではEFS、mPR及びOS、第2回中間解析ではEFS及びOS、最終解析ではOSの検定を実施することとした。mPRは1回目の中間解析を最終解析とし、EFSは2回目の中間解析を最終解析とした。Maurer and Bretzの多重性の調整方法を用いて、EFS、mPR率及びOSに関する全体の有意水準を片側2.5%となるように厳密に制御した。まず、有意水準をPD-L1 CPS≧10の患者のEFSに2.5%を配分し、Maurer and Bretzのグラフィカルアプローチを用い、下図のように再配分する計画とした。Lan-DeMets によるO’Brien-Fleming型のα消費関数によりEFS及びOSの中間解析と最終解析における有意水準を設定した。
※ CPSによるPD-L1発現別の評価は、KEYNOTE-012試験等のバイオマーカーデータによって頭頸部癌におけるCPSでの評価方法の有用性が確認されたことから、解析計画に追加された。
*5 CPS(combined positive score): PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
*6 EFS(event-free survival):無作為化から画像評価に基づく疾患進行、術前補助療法期の画像評価に基づく疾患進行のうち手術が不可能となるもの、画像又は生検に基づく局所又は遠隔の疾患進行又は再発、あらゆる原因による死亡のいずれかが最初に記録されるまでの期間
*7 mPR(major pathological response):原発腫瘍の切除検体及び切除されたすべての所属リンパ節において、浸潤性扁平上皮癌細胞が10%以下である
*8 pCR(pathological complete response):原発腫瘍の切除検体及び切除されたすべての所属リンパ節において、浸潤性扁平上皮癌細胞の残存が認められない
*9 ITT(intention-to-treat)集団:無作為化されたすべての患者
*10 APaT(all participants as treated)集団: 試験での治療を1回以上受けたすべての患者
*11 FAS(full analysis set)集団:試験での治療が行われ、1つ以上の PRO評価が利用可能な患者
*12 原発腫瘍部位(中咽頭/口腔、下咽頭、喉頭)
*13 病期(Stage Ⅲ、Stage ⅣA)
*14 PD-L1発現(TPS≧50%、<50%)
シスプラチンの頭頸部癌における用法及び用量
6. 用法及び用量(抜粋)
〈シスプラチン通常療法〉
(1)頭頸部癌には、D法を標準的用法・用量とし、患者の状態によりB法を選択する。
D法:シスプラチンとして10〜20mg/m2(体表面積)を1日1回、5日間連続投与し、少なくとも2週間休薬する。これを1クールとし、投与を繰り返す。
B法:シスプラチンとして50〜70mg/m2(体表面積)を1日1回投与し、少なくとも3週間休薬する。これを1クールとし、投与を繰り返す。
なお、投与量は疾患、症状により適宜増減する。
KEYNOTE-689試験の対象患者
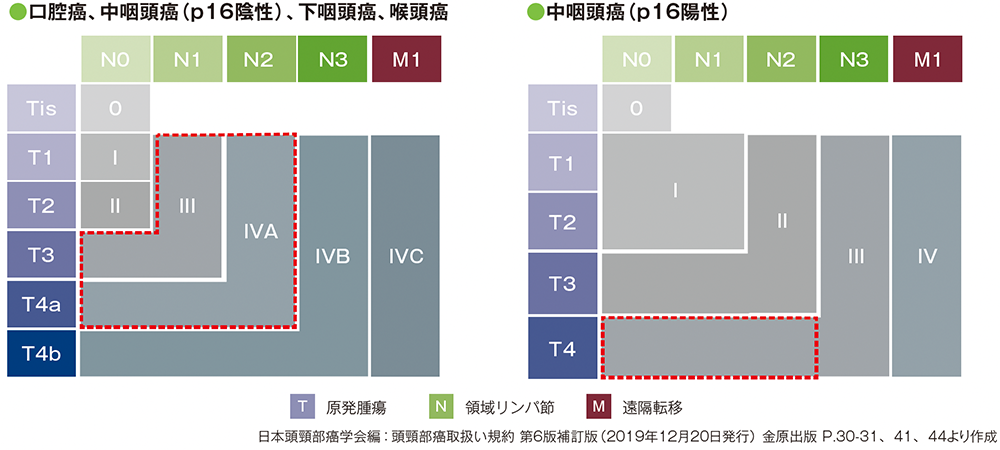
国際共同第Ⅲ相試験(KEYNOTE-689試験)は、ベースラインの画像及び臨床的評価に基づき、組織学的に以下のいずれかの切除可能な非転移性の扁平上皮癌と治験担当医師により新たに診断された患者を対象としました[TNM分類 AJCC/UICC(第8版)]。
•Stage Ⅲ又はⅣA の喉頭/下咽頭/口腔(p16発現状況を問わない)
•Stage Ⅲ又はⅣA の中咽頭、p16陰性
•Stage Ⅲの中咽頭、p16陽性、T4(N0~N2)、M0
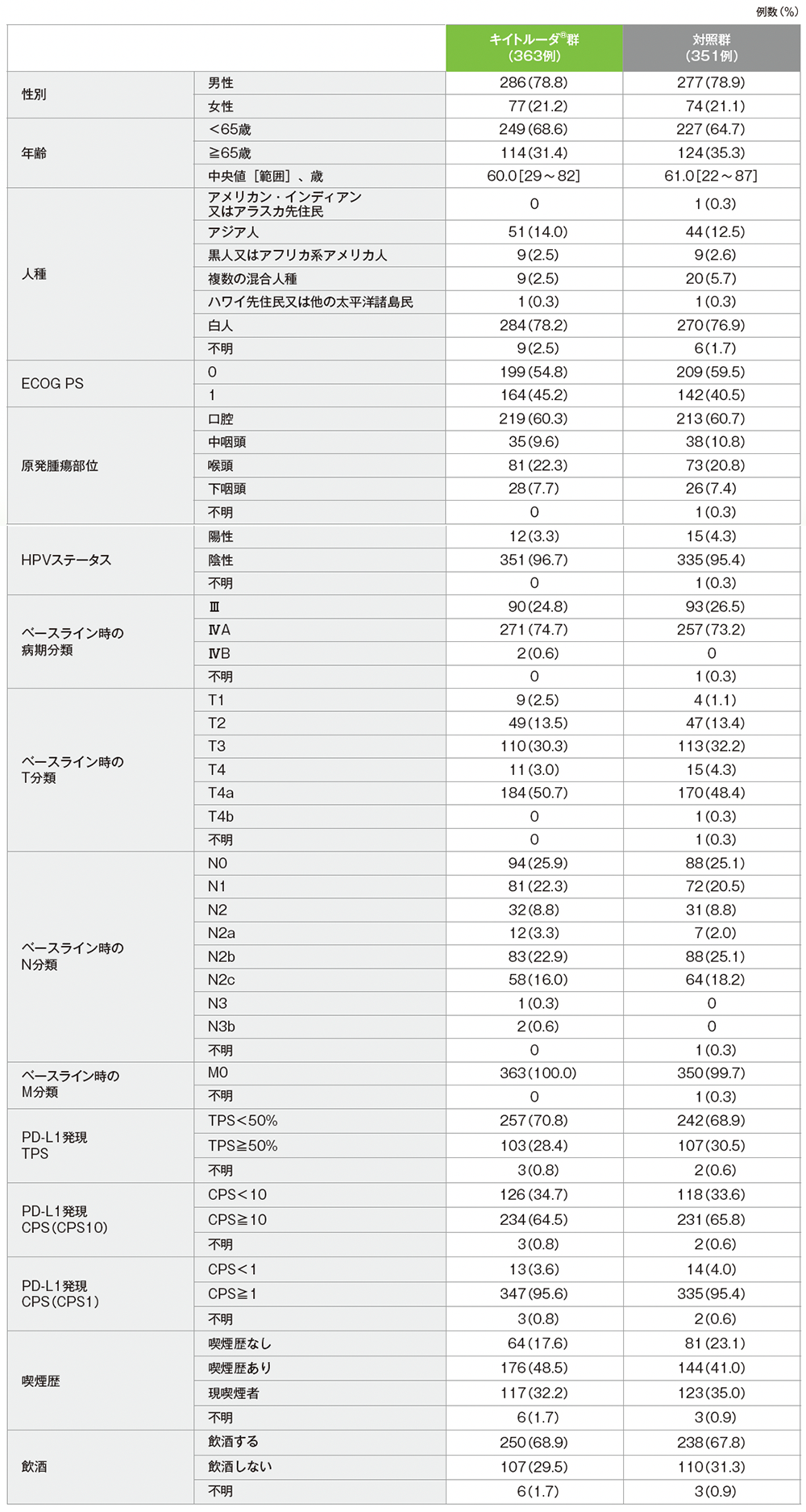
患者背景(ITT集団)
手術実施状況
手術実施状況(ITT集団)
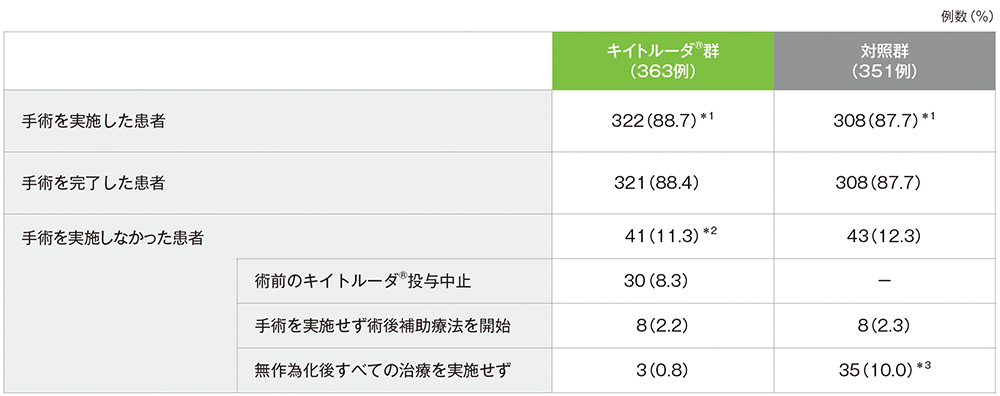
*1 対照群に割り付けられた1例は、キイトルーダ®による術前補助療法を2サイクル実施後、手術を施行し、術後補助療法は開始せずに治療中止とした。本症例はAPaT集団ではキイトルーダ®群に、ITT集団では対照群に含まれる。
*2 キイトルーダ®群で手術を実施しなかった患者は41例であり、うち15例は疾患進行によるキイトルーダ®投与の中止、5例は有害事象が理由で手術を実施しなかった。
*3 2024年7月25日のデータカットオフ時点において、無作為化後すべての治療を実施しなかった対照群35例のうち、18例(51%)は治験薬以外の治療を受けていたことが判明しており、19例(54%)は疾患進行又は死亡していた(Uppaluri R, et al. N Engl J Med. 2025; 393: 1138-1139.)。
(データカットオフ日:2024年7月25日)
手術遅延状況*1(APaT集団)
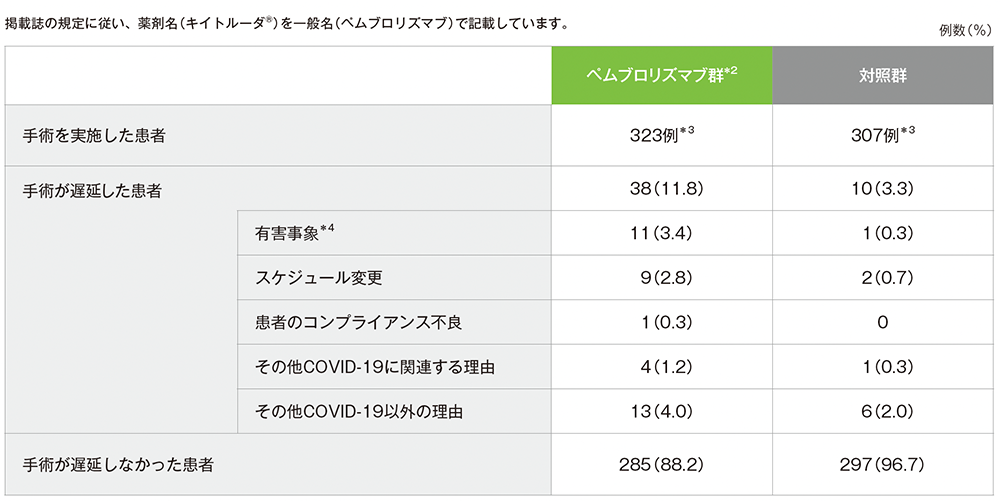
*1 手術の実施日は、ペムブロリズマブ群は無作為化から6週間後(±10日)、対照群は無作為化から4週間後(±10日)とされていた。この期間外の手術を遅延とした。
*2 術前及び術後補助療法のペムブロリズマブは、標準療法に追加で投与された。術後補助療法のペムブロリズマブは、術後放射線療法又は化学放射線療法と同時に開始されることとされていた。
*3 対照群に割り付けられた1例は、ペムブロリズマブによる術前補助療法を2サイクル実施後、手術を施行し、術後補助療法は開始せずに治療中止とした。本症例はAPaT集団ではペムブロリズマブ群に、ITT集団では対照群に含まれる。
*4 手術遅延に関連すると報告された有害事象。
(データカットオフ日:2024年7月25日)
Uppaluri R, et al. N Engl J Med. 2025; 393(1): 37-50 Supplementary appendix.
Copyright © 2025 Massachusetts Medical Society. All rights reserved. Translated with permission.
各治療の実施状況
全体の治療期間(APaT集団)
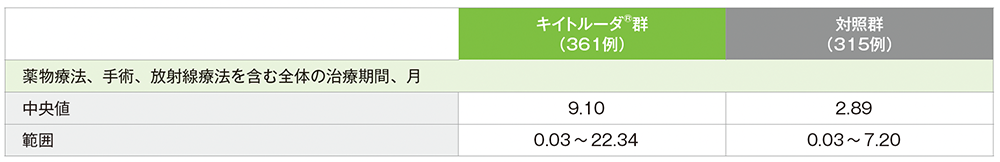
(データカットオフ日:2024年7月25日)
術前補助療法期の治療期間(APaT集団*1)
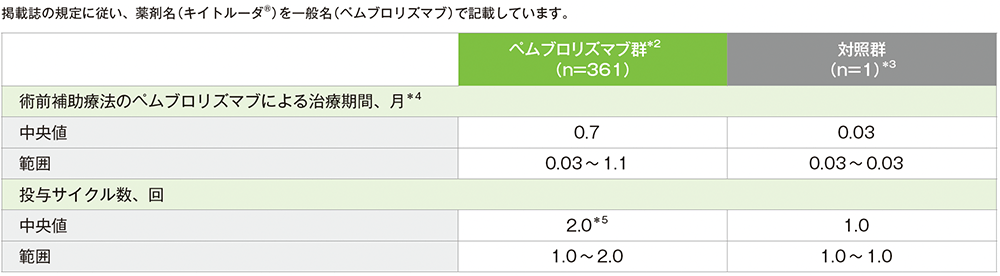
*1 試験での治療を1回以上受けたすべての患者
*2 術前及び術後補助療法のペムブロリズマブは、標準療法に追加で投与された。術後補助療法のペムブロリズマブは、術後放射線療法又は化学放射線療法と同時に開始されることとされていた。
*3 術前補助療法としてペムブロリズマブを1サイクル投与された1例は、その後対照群(標準療法)へ戻された。本症例は安全性解析において対照群に含まれた。
*4 ペムブロリズマブ群における術前補助療法は、無作為化から3日以内又は可能な限りその日に近い時点から開始する必要があった。治療期間は、初回投与日から最終投与日までとした。
*5 19例(5.3%)は1サイクル、342例(94.7%)は2サイクル投与された。
(データカットオフ日:2024年7月25日)
Adapted with permission from
N Engl J Med., Uppaluri R, et al., Neoadjuvant and Adjuvant Pembrolizumab
in Locally Advanced Head and Neck Cancer, 393(1), 37-50 Supplementary appendix.
Copyright © 2025 Massachusetts Medical Society.
術後補助療法期の治療期間(APaT集団)
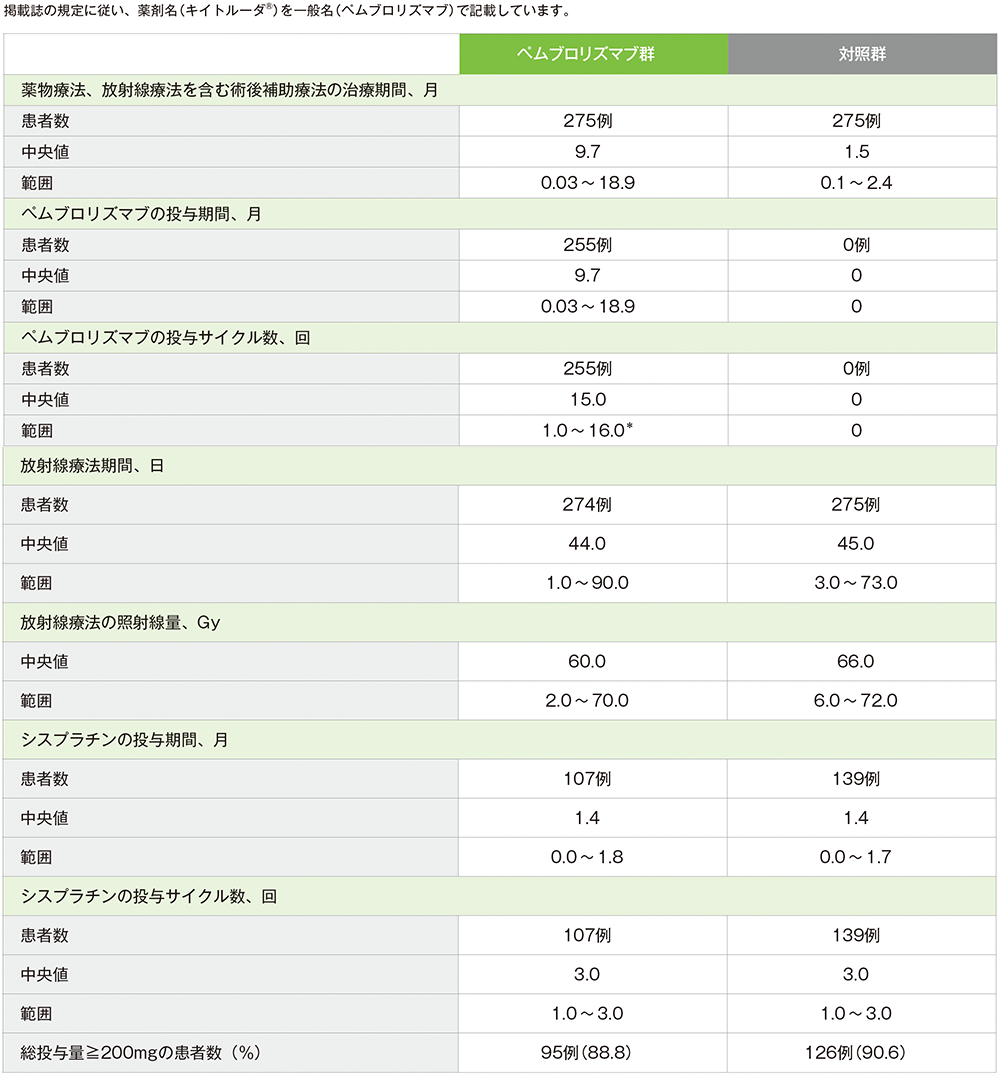
(データカットオフ日:2024年7月25日)
Adapted with permission from
N Engl J Med., Uppaluri R, et al., Neoadjuvant and Adjuvant Pembrolizumab
in Locally Advanced Head and Neck Cancer, 393(1), 37-50 Supplementary appendix.
Copyright © 2025 Massachusetts Medical Society.
*局所進行頭頸部癌における術後補助療法では、放射線療法又はシスプラチンを用いた化学放射線療法との併用において、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与回数は、3週間間隔投与の場合は15回まで、6週間間隔投与の場合は8回までとする。
各治療までの期間
各治療までの期間(APaT集団)
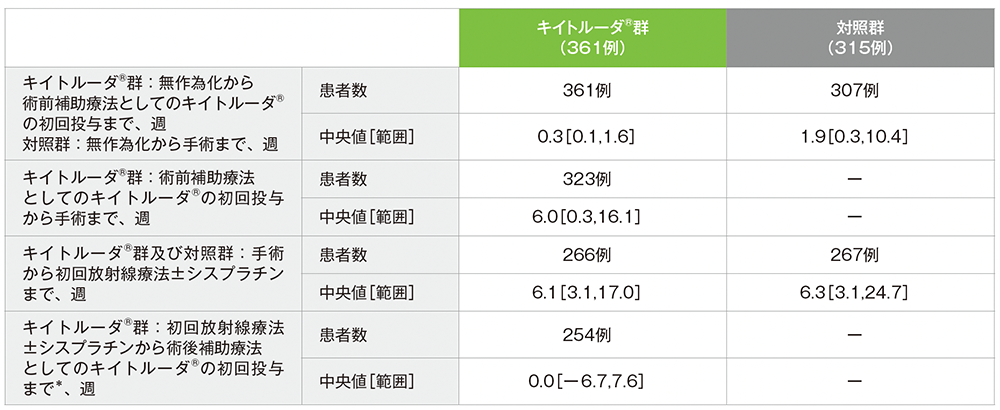
* 放射線療法±シスプラチンの前にキイトルーダ®の術後補助療法を受けた患者は、放射線療法±シスプラチンからキイトルーダ®の術後補助療法までの週数はマイナスとなる。
(データカットオフ日:2024年7月25日)
主要評価項目 無イベント生存期間:EFS*1 (優越性試験)[検証的解析項目]
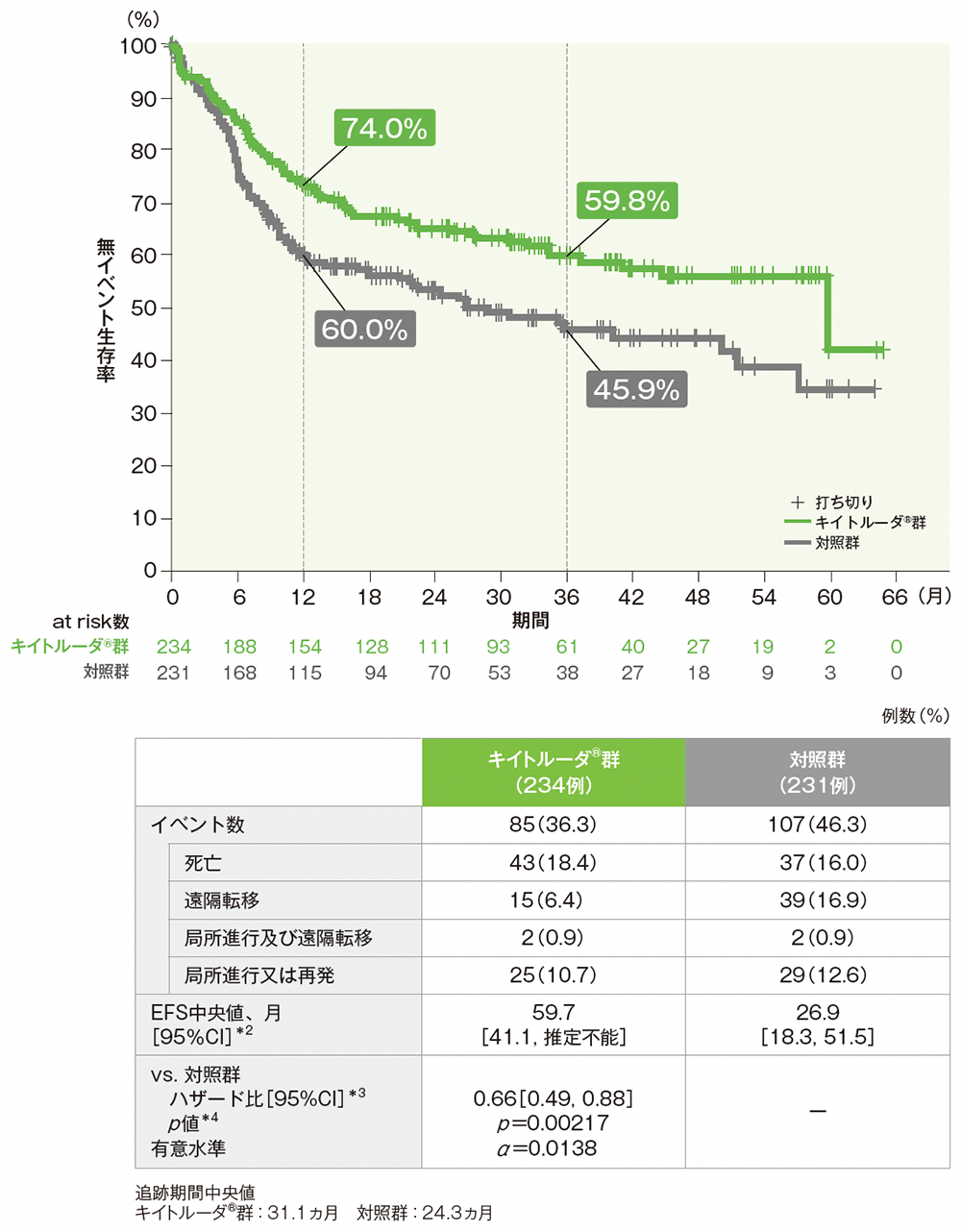
CPS≧10患者におけるEFS

EFSのKaplan-Meier曲線(CPS≧10患者)
*1 無作為化から、画像評価に基づく疾患進行、術前補助療法期の画像評価に基づく疾患進行のうち手術が不可能となるもの、画像又は生検に基づく局所又は遠隔の疾患進行又は再発、あらゆる原因による死亡のいずれかが最初に記録されるまでの期間(なお、二次性悪性腫瘍はイベントとしない)と定義。イベントはBICRがRECISTガイドライン1.1版に基づき評価した。
*2 打ち切りデータはKaplan-Meier法に基づく。
*3 投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデルに基づき算出した。
*4 無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別ログランク検定(片側)。
(データカットオフ日:2024年7月25日)
- CPS≧10患者におけるキイトルーダ®群の対照群に対するハザード比は0.66(95%CI:0.49, 0.88)であり、EFSを有意に延長しました[p=0.00217、層別ログランク検定(片側)、有意水準 α=0.0138;検証的解析結果]。
サブグループ解析 部分集団因子別のEFS
EFSのフォレストプロット(CPS≧10の患者)
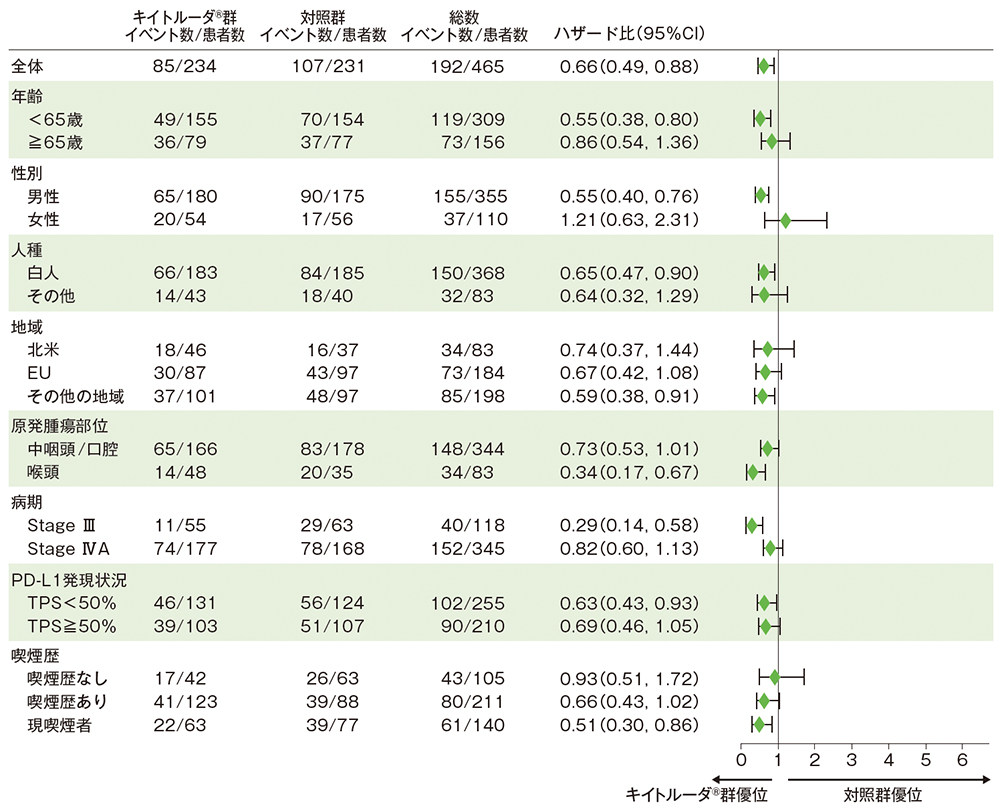
全集団は、投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデル、部分集団は、投与群を共変量とした非層別Cox比例ハザードモデルに基づき算出した。
CPS≧10の解析対象集団に対しては、サブグループの各項目での10%未満の集団の場合、当該項目のサブグループ解析は実施しなかった。
(データカットオフ日:2024年7月25日)
CPS≧1患者におけるEFS

EFSのKaplan-Meier曲線(CPS≧1患者)
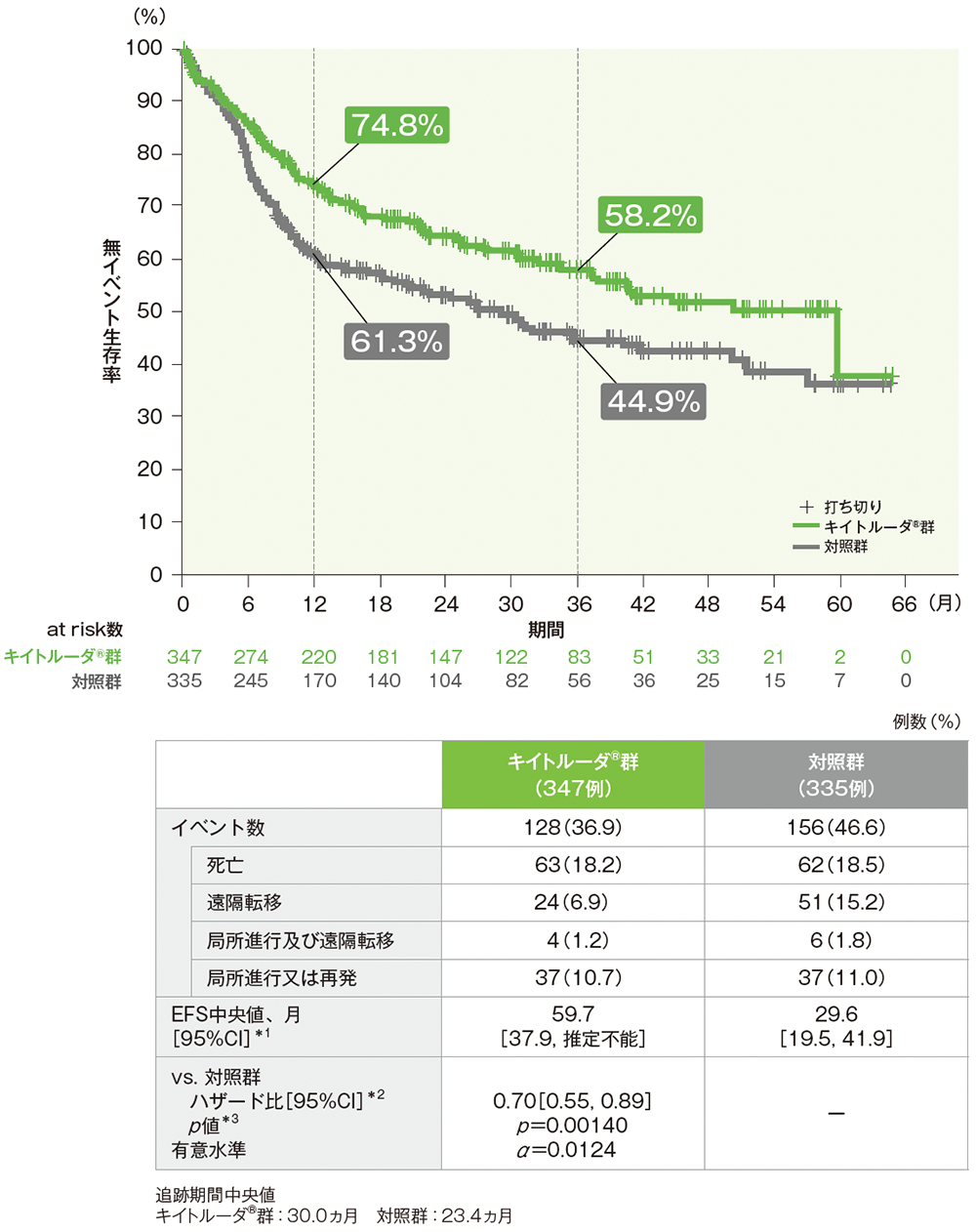
*1 打ち切りデータはKaplan-Meier法に基づく。
*2 投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデルに基づき算出した。
*3 無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別ログランク検定(片側)。
(データカットオフ日:2024年7月25日)
- CPS≧1患者におけるキイトルーダ®群の対照群に対するハザード比は0.70(95%CI:0.55, 0.89)であり、EFSを有意に延長しました[p=0.00140、層別ログランク検定(片側)、有意水準 α=0.0124;検証的解析結果]。
サブグループ解析 部分集団因子別のEFS
EFSのフォレストプロット(CPS≧1の患者)
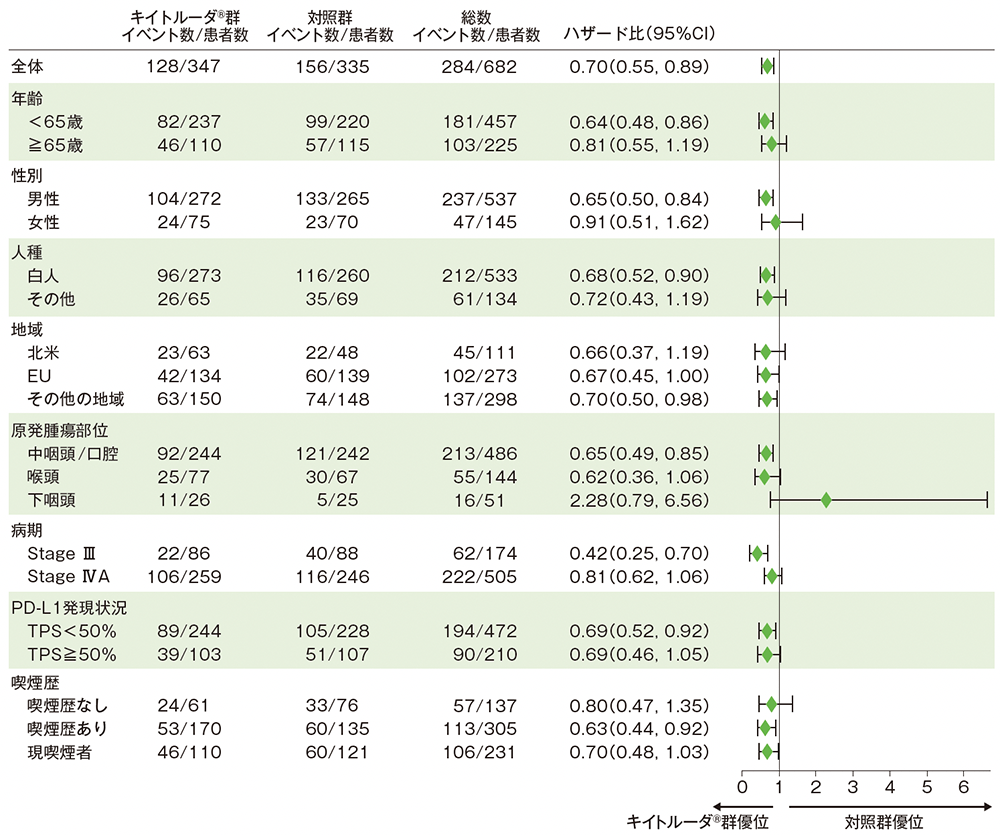
全集団は、投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデル、部分集団は、投与群を共変量とした非層別Cox比例ハザードモデルに基づき算出した。
(データカットオフ日:2024年7月25日)
全患者におけるEFS

EFSのKaplan-Meier曲線(全患者)
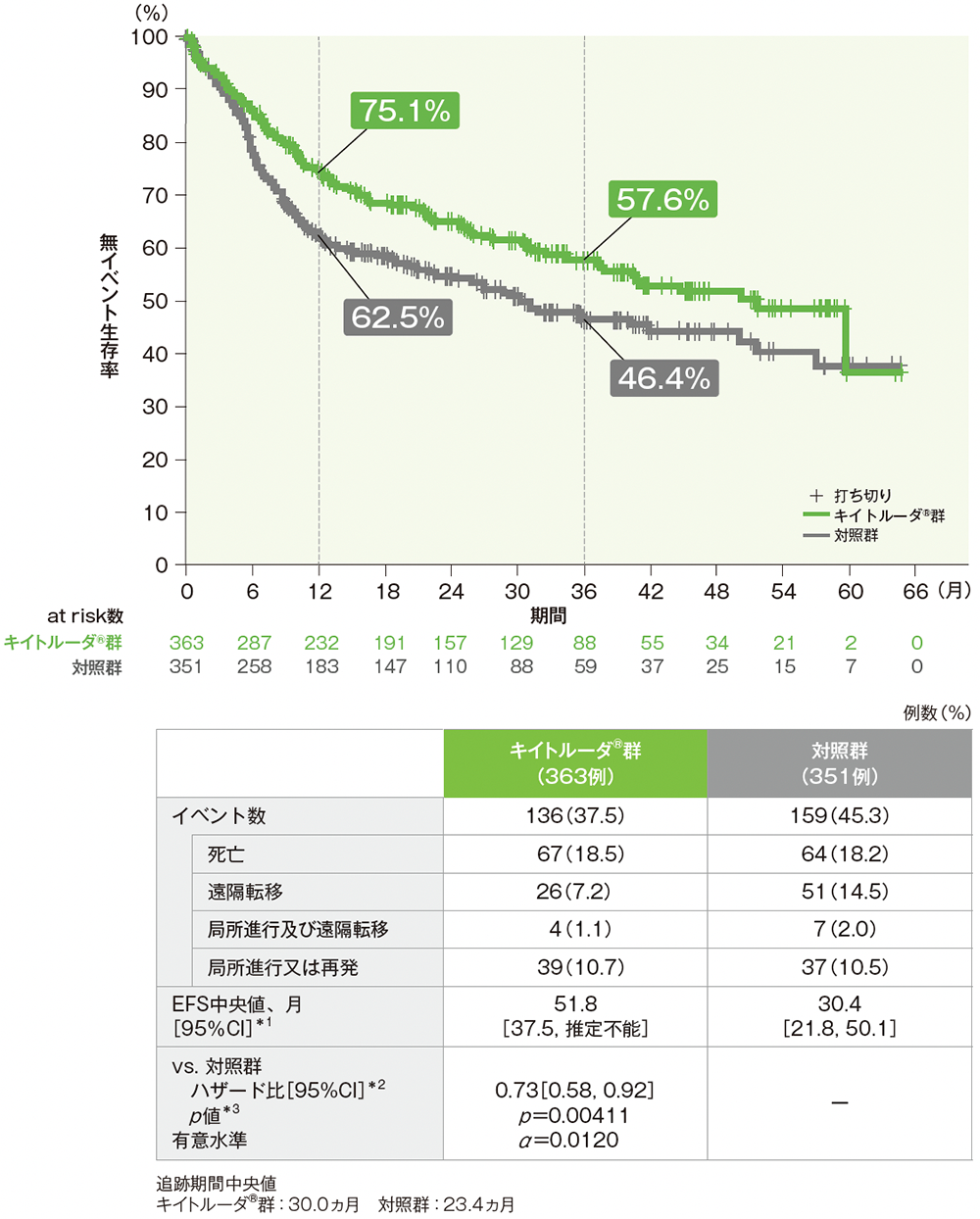
*1 打ち切りデータはKaplan-Meier法に基づく。
*2 投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデルに基づき算出した。
*3 無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別ログランク検定(片側)。
(データカットオフ日:2024年7月25日)
- 全患者におけるキイトルーダ®群の対照群に対するハザード比は0.73(95%CI:0.58, 0.92)であり、EFSを有意に延長しました[p=0.00411、層別ログランク検定(片側)、有意水準 α=0.0120;検証的解析結果]。
- 全患者におけるEFS中央値は、キイトルーダ®群で51.8ヵ月(95%CI:37.5, 推定不能)、対照群で30.4ヵ月(95%CI:21.8, 50.1)でした。
サブグループ解析 部分集団因子別のEFS
EFSのフォレストプロット(全患者)
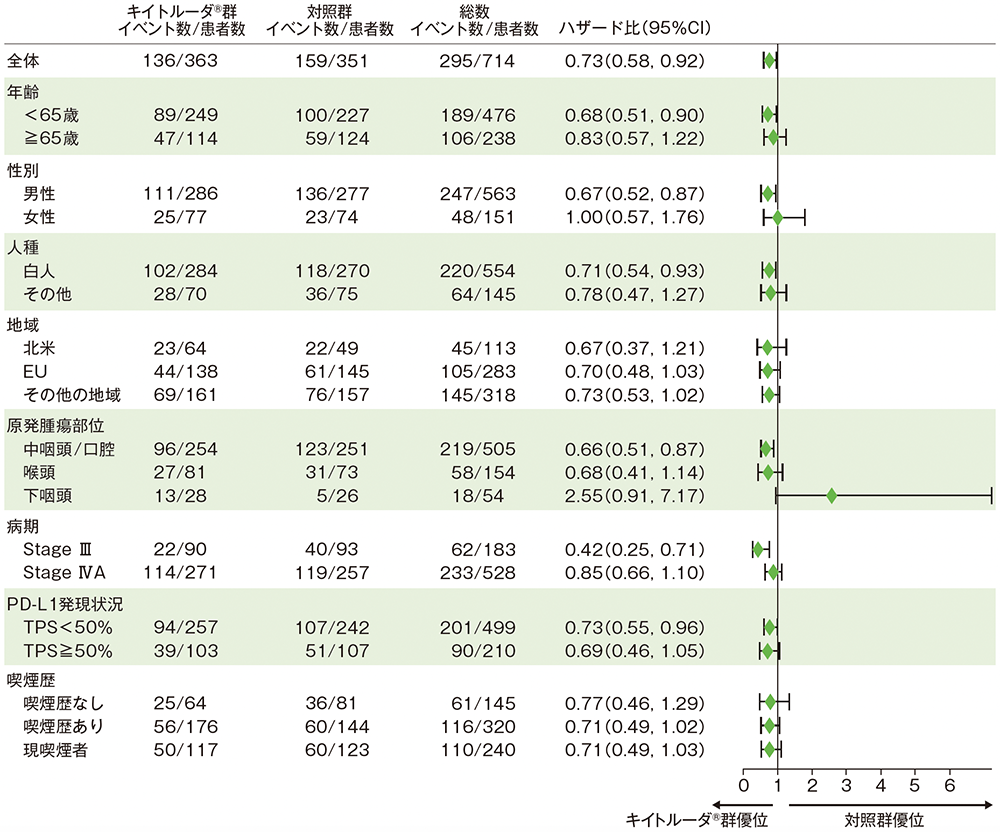
全集団は、投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデル、部分集団は、投与群を共変量とした非層別Cox比例ハザードモデルに基づき算出した。
(データカットオフ日:2024年7月25日)
副次評価項目 全生存期間:OS(優越性試験)[検証的解析項目]
全患者及びPD-L1発現別のOS

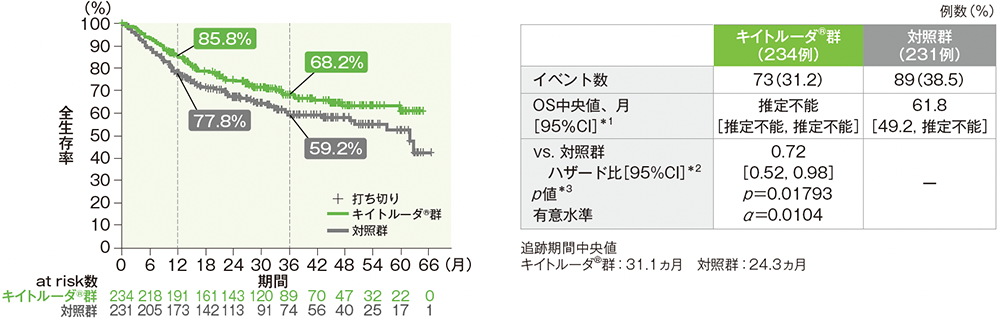
OSのKaplan-Meier曲線(CPS≧10患者)
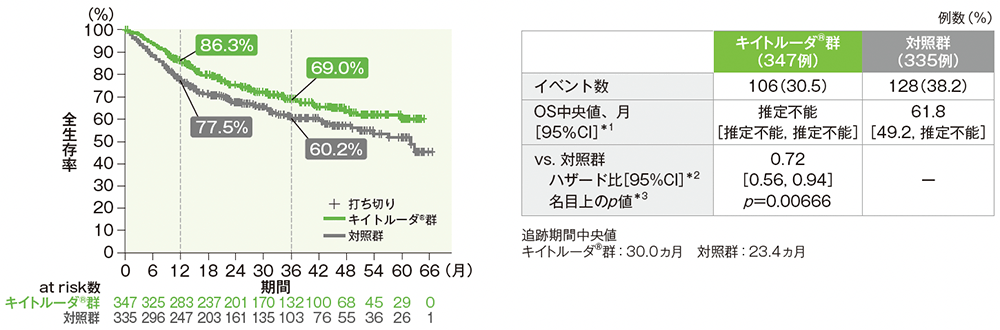
OSのKaplan-Meier曲線(CPS≧1患者)
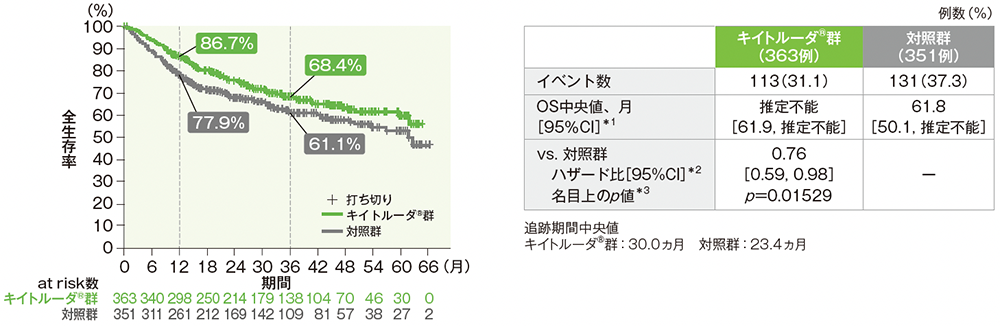
OSのKaplan-Meier曲線(全患者)
*1 打ち切りデータはKaplan-Meier法に基づく。
*2 投与群を共変量とし、無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Cox比例ハザードモデルに基づき算出した。
*3 無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別ログランク検定(片側)。
(データカットオフ日:2024年7月25日)
- CPS≧10患者におけるキイトルーダ®群の対照群に対するハザード比は0.72でした[95%CI:0.52, 0.98、p=0.01793、層別ログランク検定(片側)、有意水準 α=0.0104;検証的解析結果]。
- CPS≧10患者におけるOS中央値は、キイトルーダ®群で推定不能(95%CI:推定不能, 推定不能)、対照群で61.8ヵ月(95%CI:49.2, 推定不能)でした。
- CPS≧10患者におけるOSの解析に統計学的有意差を認めなかったため、事前に規定した多重性の調整の方針に従い、CPS≧1患者、全患者におけるOSの優越性の検定は行いませんでした。
副次評価項目 病理学的奏効(mPR)率(優越性試験)[検証的解析項目]
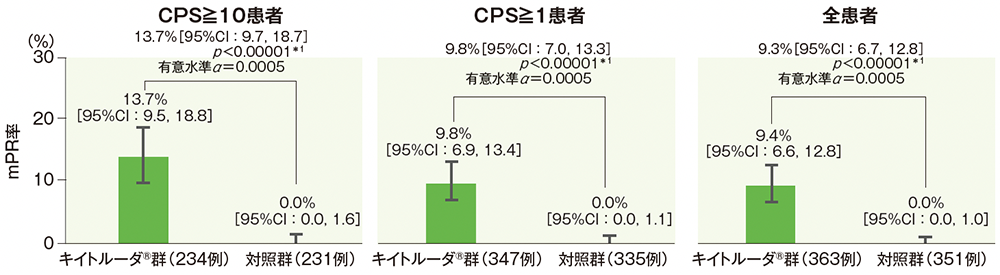
病理学的奏効(mPR)率

*1 無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Miettinen and Nurminen法(片側)。
(データカットオフ日:2024年7月25日)
- CPS≧10、CPS≧1、全患者におけるキイトルーダ®群のmPR率は、対照群と比較し有意に改善しました[層別Miettinen and Nurminen法(片側);検証的解析結果]。
- CPS≧10患者におけるキイトルーダ®群のmPR率は13.7%であり、対照群との差は13.7%(95%CI:9.7, 18.7、p<0.00001、有意水準 α=0.0005;検証的解析結果)でした。
- CPS≧1患者におけるキイトルーダ®群のmPR率は9.8%であり、対照群との差は9.8%(95%CI:7.0, 13.3、p<0.00001、有意水準 α=0.0005;検証的解析結果)でした。
- 全患者におけるキイトルーダ®群のmPR率は9.4%であり、対照群との差は9.3%(95%CI:6.7, 12.8、p<0.00001、有意水準 α=0.0005;検証的解析結果)でした。
副次評価項目 病理学的完全奏効(pCR)率
病理学的完全奏効(pCR)率

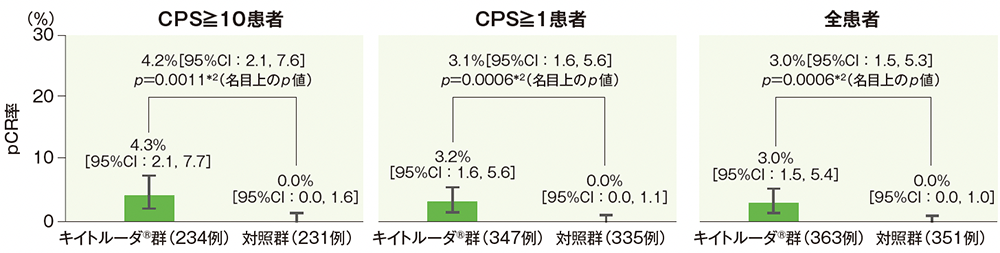
*2 無作為化に用いた層別因子(原発腫瘍部位及び病期)を層別因子とした層別Miettinen and Nurminen法(片側)。
(データカットオフ日:2024年7月25日)
- CPS≧10、CPS≧1、全患者におけるpCR率は上記のとおりでした。
mPR及びpCRの定義
-
mPR(major pathological response:病理学的奏効)とは:
中央判定病理医により盲検下で評価され、原発腫瘍の切除検体及び切除されたすべての所属リンパ節において、浸潤性扁平上皮癌細胞が10%以下であることとする。 -
pCR(pathological complete response:病理学的完全奏効)とは:
中央判定病理医により盲検下で評価され、原発腫瘍の切除検体及び切除されたすべての所属リンパ節において、浸潤性扁平上皮癌細胞の残存が認められないこととする。
サブグループ解析 mPR又はpCR達成有無別の無イベント生存期間:EFS
mPR又はpCR達成有無別のEFSは事前規定されていませんが、評価資料として承認時に評価されたため記載しました。

mPR達成有無別のEFSのKaplan-Meier曲線(全患者)(サブグループ解析)
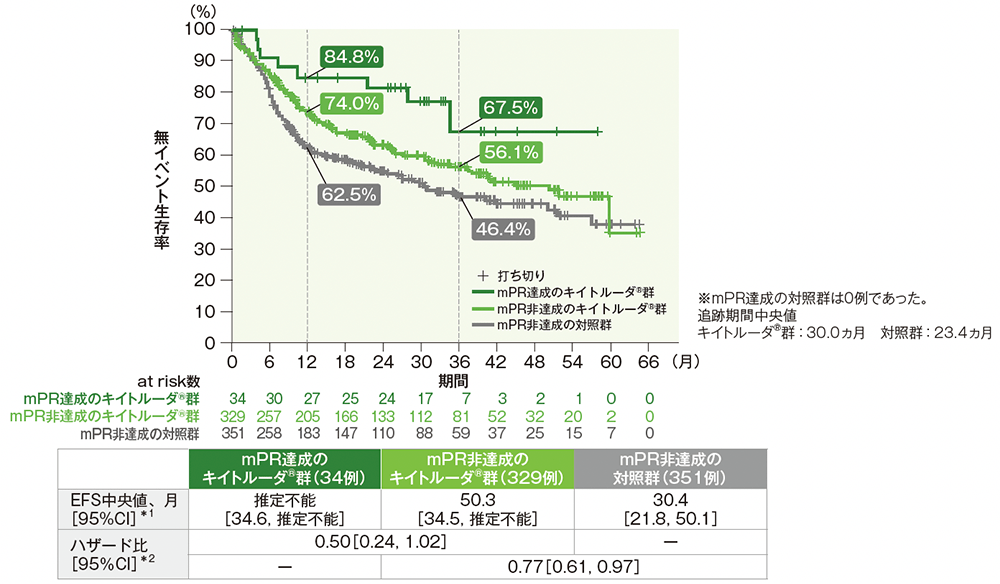
*1 打ち切りデータはKaplan-Meier法に基づく。
*2 投与群を共変量とした非層別Cox比例ハザードモデルにより算出した。
(データカットオフ日:2024年7月25日)

pCR達成有無別のEFSのKaplan-Meier曲線(全患者)(サブグループ解析)
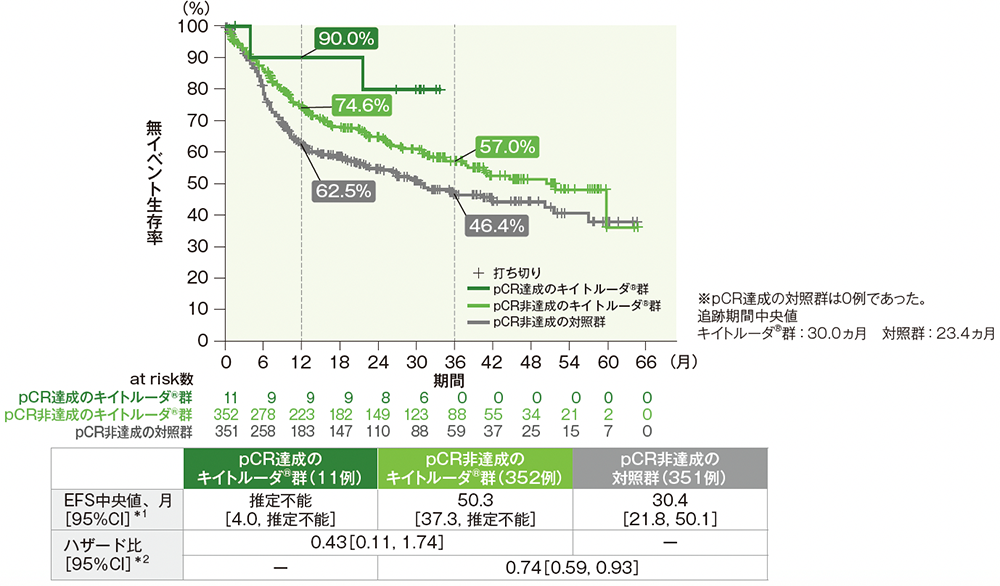
*1 打ち切りデータはKaplan-Meier法に基づく。
*2 投与群を共変量とした非層別Cox比例ハザードモデルにより算出した。
(データカットオフ日:2024年7月25日)
手術後のリスク評価及び手術検体の断端状況
手術後のリスク評価(ITT集団)
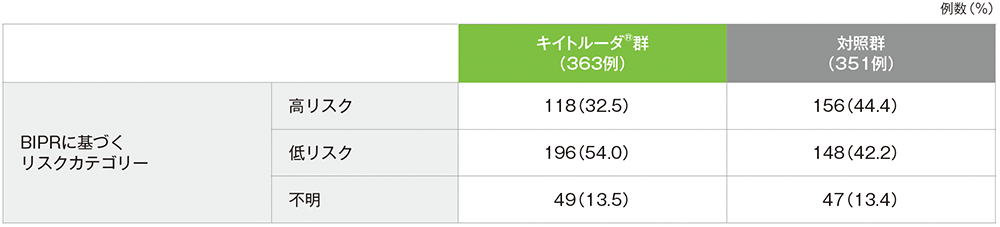
手術後の病理学的リスク分類(高リスク/低リスク)は、原発腫瘍及び頸部リンパ節からの切除検体をBIPRが判定した。
高リスク:節外浸潤又は切除断端陽性と判定された場合
低リスク:上記の病理学的特徴がないと判定された場合
不明:手術未施術又は術後のリスク評価を受けなかった
- 盲検下独立病理判定(BIPR)により高リスクと判定されたのは、キイトルーダ®群で32.5%(118/363例)、対照群で44.4%(156/351例)であり、低リスクと判定されたのは、キイトルーダ®群で54.0%(196/363例)、対照群で42.2%(148/351例)でした。
手術検体の断端状況(APaT集団)
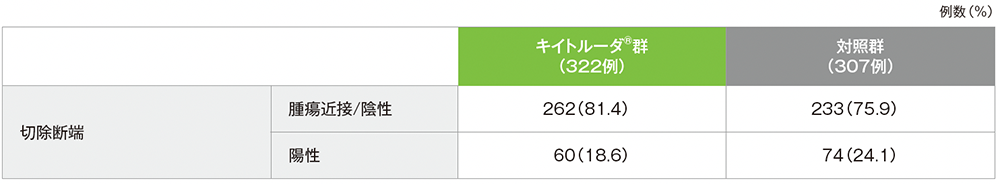
手術検体の断端状況は、治験実施医療機関の病理検査で判定した。
切除断端陰性:腫瘍浸潤先端から5mm以上
腫瘍近接断端:腫瘍浸潤先端から1~5mm
切除断端陽性:腫瘍浸潤先端から1mm未満
- 手術検体において、切除断端の腫瘍近接/陰性はキイトルーダ®群で81.4%(262/322例)、対照群で75.9%(233/307例)であり、切除断端陽性は、キイトルーダ®群で18.6%(60/322例)、対照群で24.1%(74/307例)でした。
安全性

副作用(いずれかの投与群で発現率5%以上)(APaT集団)
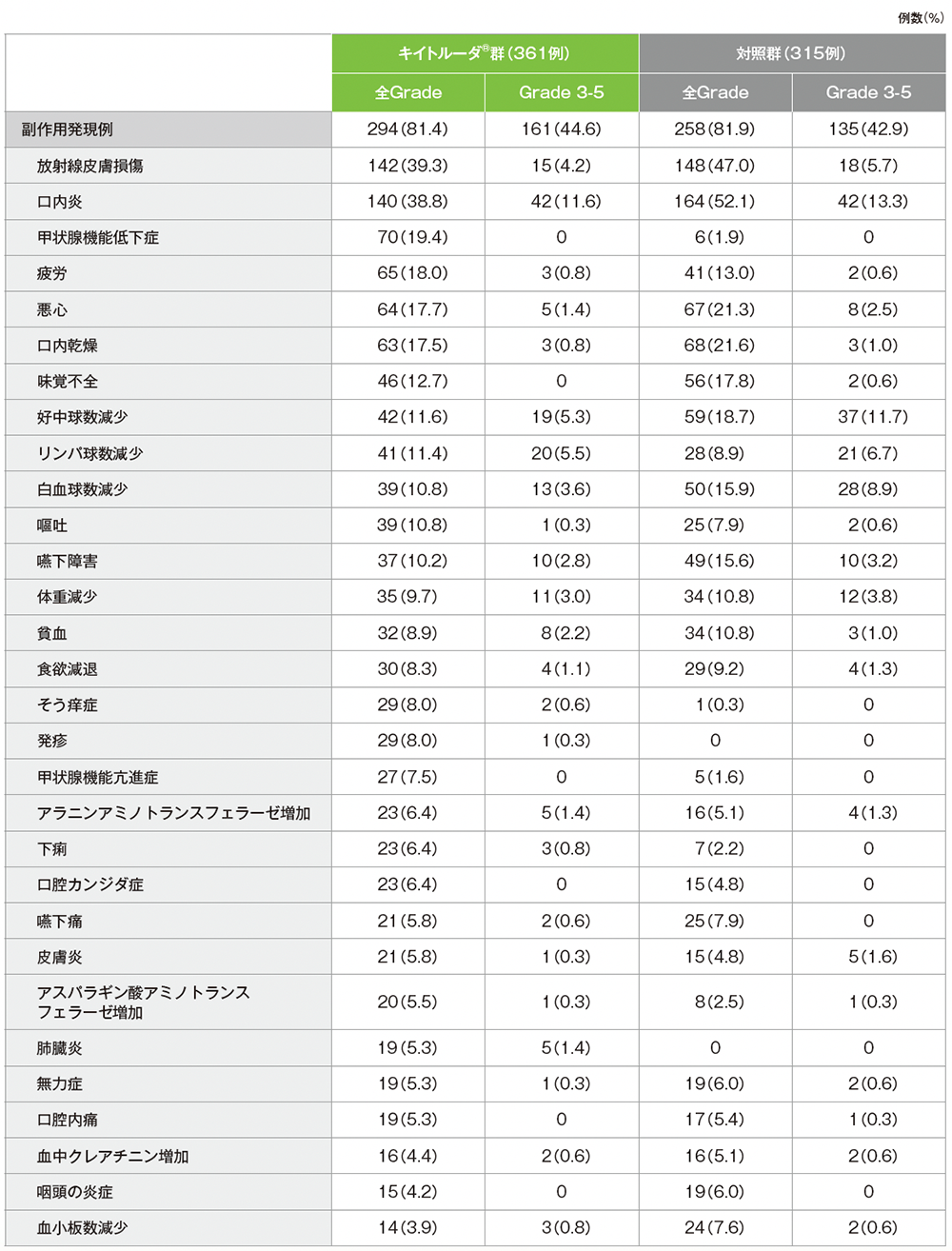
MedDRA v27.0、GradeはCTCAE v4.03
(データカットオフ日:2024年7月25日)

副作用の詳細(APaT集団)
キイトルーダ®群
キイトルーダ®群で副作用は294/361例(81.4%)に認められました。副作用(発現率10%以上)は放射線皮膚損傷142例(39.3%)、口内炎140例(38.8%)、甲状腺機能低下症70例(19.4%)、疲労65例(18.0%)、悪心64例(17.7%)、口内乾燥63例(17.5%)、味覚不全46例(12.7%)、好中球数減少42例(11.6%)、リンパ球数減少41例(11.4%)、白血球数減少、嘔吐各39例(10.8%)、嚥下障害37例(10.2%)でした。重篤な副作用は69例(19.1%)に認められました。重篤な副作用(発現率1%以上)は大腸炎、口内炎各6例(1.7%)、免疫性肝炎、肺臓炎各5例(1.4%)、副腎機能不全4例(1.1%)でした。いずれかの治療の中止に至った副作用は64例(17.7%)に認められました。いずれかの治療の中止に至った副作用(発現率1%以上)は肺臓炎7例(1.9%)、大腸炎、好中球数減少各6例(1.7%)、免疫性肝炎、口内炎、白血球数減少各4例(1.1%)でした。死亡に至った副作用は4例(1.1%)に認められました。内訳はCOVID-19肺炎、死亡、肺臓炎、腎不全各1例(0.3%)でした。
対照群
対照群で副作用は258/315例(81.9%)に認められました。副作用(発現率10%以上)は口内炎164例(52.1%)、放射線皮膚損傷148例(47.0%)、口内乾燥68例(21.6%)、悪心67例(21.3%)、好中球数減少59例(18.7%)、味覚不全56例(17.8%)、白血球数減少50例(15.9%)、嚥下障害49例(15.6%)、疲労41例(13.0%)、体重減少、貧血各34例(10.8%)でした。重篤な副作用は33例(10.5%)に認められました。重篤な副作用(発現率1%以上)は急性腎障害6例(1.9%)、発熱性好中球減少症4例(1.3%)、悪心3例(1.0%)でした。いずれかの治療の中止に至った副作用は39例(12.4%)に認められました。いずれかの治療の中止に至った副作用(発現率1%以上)は好中球数減少10例(3.2%)、急性腎障害7例(2.2%)、口内炎、血中クレアチニン増加各4例(1.3%)でした。死亡に至った副作用は1例(0.3%)に認められ、急性腎障害1例(0.3%)によるものでした。
MedDRA v27.0
(データカットオフ日:2024年7月25日)

免疫関連など特に注目すべき有害事象(APaT集団)
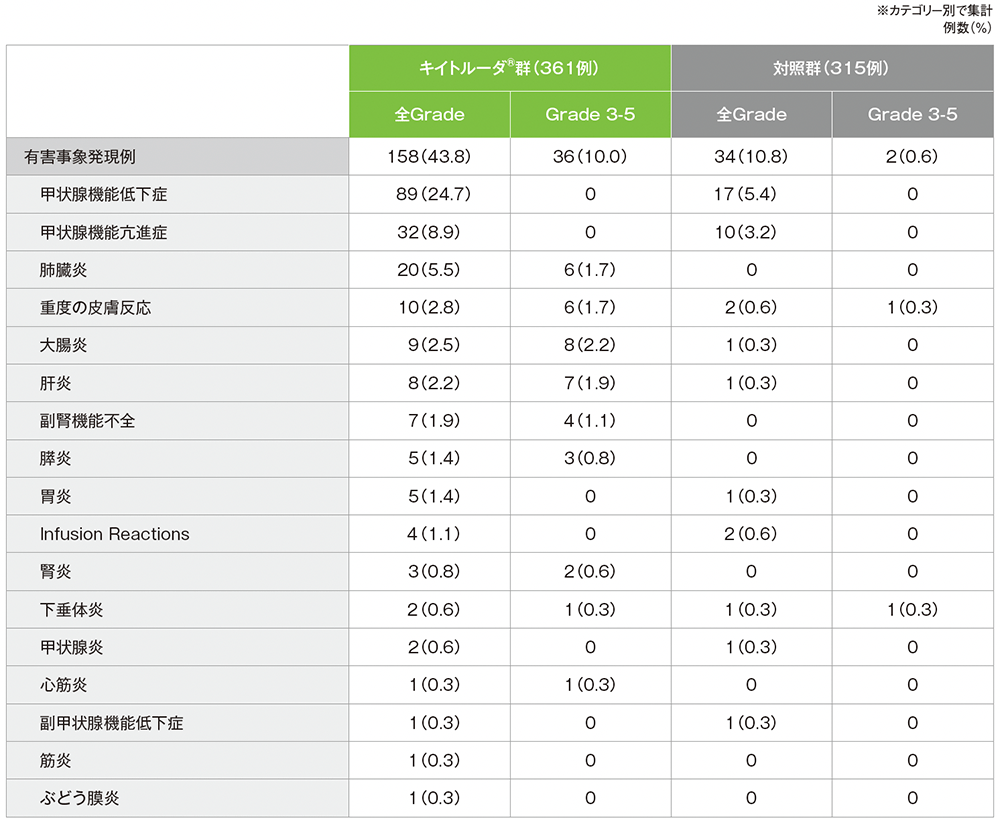
MedDRA v27.0、GradeはCTCAE v4.03
(データカットオフ日:2024年7月25日)