NRG-GY018/KEYNOTE-868試験
子宮体癌:国際共同臨床試験成績
国際共同第Ⅲ相試験<NRG-GY018/KEYNOTE-868試験>
承認時評価資料: 国際共同第Ⅲ相試験(NRG-GY018/KEYNOTE-868試験)
Eskander RN et al. N Engl J Med 2023; 388: 2159-2170(Supplementary Appendix)
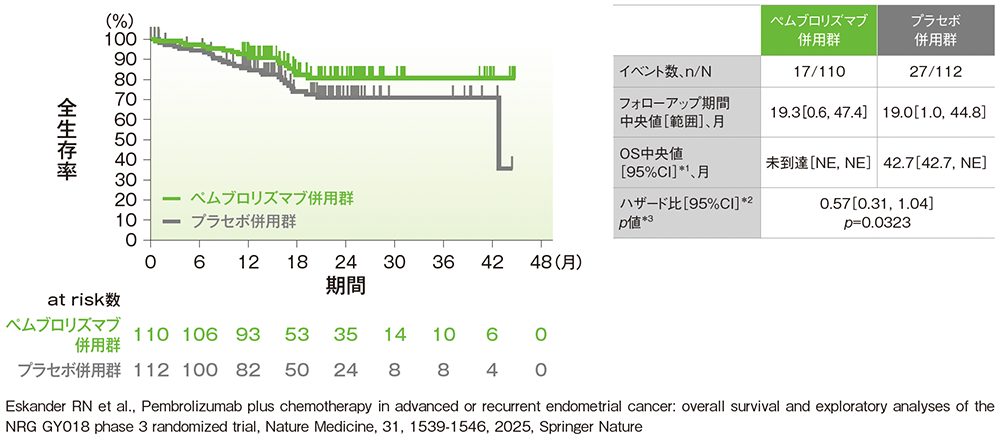
Eskander RN et al. Nat Med 2025; 31: 1539-1546
本研究の資金は、MSD社によって提供された。著者にMSD社より謝礼等を受領している者を含む。
試験概要
【目的】
化学療法歴のない(術後補助療法を除く)進行・再発の子宮体癌患者を対象に、キイトルーダ®と化学療法との併用療法及びその後のキイトルーダ®継続投与の有効性及び安全性を検討する。
【デザイン】
無作為化二重盲検プラセボ対照国際共同第Ⅲ相試験[優越性試験]
〔中間解析結果(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])〕
【対象】
化学療法歴のない(術後補助療法を除く)進行・再発の子宮体癌患者810例(日本人7例を含む)
なお、MMRステータス別の患者数はpMMR集団が588例、dMMR集団が222例であった。
【方法】
対象をキイトルーダ®併用群又はプラセボ併用群のいずれかに1:1の割合で無作為に割り付けた。本試験はキイトルーダ®又はプラセボと化学療法を併用する併用療法期と、その後にキイトルーダ®又はプラセボを継続投与する2つの投与期で構成される。キイトルーダ®併用群では、併用療法期としてキイトルーダ®200mg、パクリタキセル*4175mg/m2及びカルボプラチンAUC5に相当する量を、3週間間隔[Q3W]で点滴静注により6サイクル*5投与し、その後にキイトルーダ®400mgを6週間間隔[Q6W]で14サイクル継続投与した。プラセボ併用群では、キイトルーダ®の代わりにプラセボを投与した。画像診断を、最初の9ヵ月間は9週間間隔、その後は12週間間隔で実施し、疾患進行(PD)、許容できない有害事象の発現等による投与中止又は投与完了まで継続した。
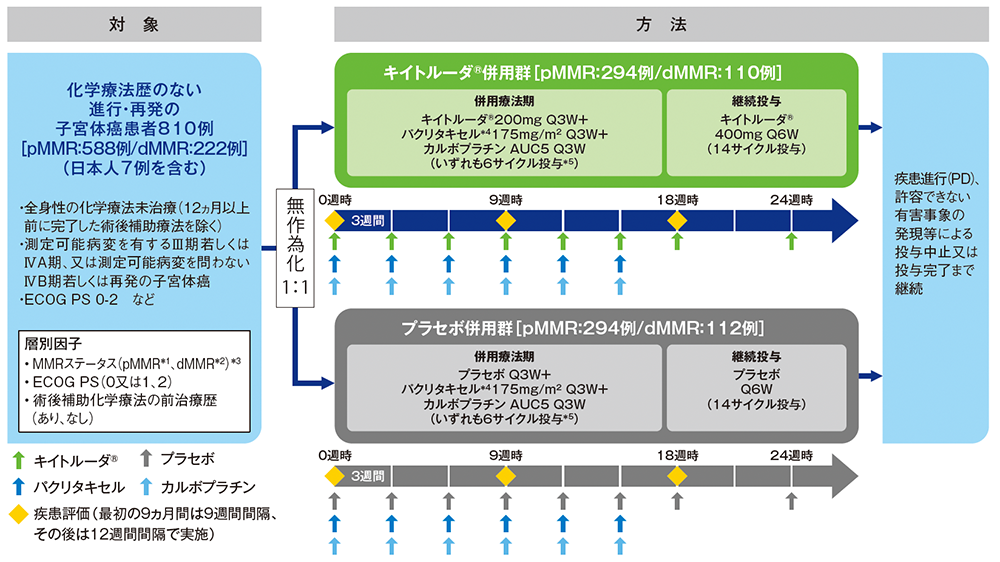
【評価項目】
主要評価項目:無増悪生存期間(progression free survival: PFS)※
副次評価項目:全生存期間(overall survival: OS)、奏効率(overall response rate: ORR)、奏効期間(duration of response: DOR)、安全性など
探索的評価項目:PD-L1発現状況(CPS≧1、CPS<1)別のPFS及びOSなど
※検証的解析項目
【判定基準】
PFSは治験担当医師がRECISTガイドライン1.1版に基づき評価した。ORR、DORは中央画像判定機関又は治験担当医師がRECISTガイドライン1.1版に基づき評価した。
【解析計画】
解析対象集団:有効性はITT集団*6、ORR、DORはITT集団のうち、組み入れ時に測定可能病変を有する集団、安全性はAPaT集団*7を解析対象とした。
有効性評価の統計手法:PFSはKaplan-Meier法を用いて生存曲線を推定した。PFSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比及びその95%信頼区間(CI)を算出した。層別ログランク検定及び層別Cox比例ハザードモデルの層別因子には術後補助化学療法の前治療歴(あり、なし)を用いた。OSは、中間解析時点では多重性を調整した正式な検定は計画していなかった。ORRの群間比較には層別Miettinen and Nurminen法を用いた。DORはKaplan-Meier法を用いて生存曲線を推定した。PFS及びOSについて、投与群を共変量としたCox比例ハザードモデルを用いて、PD-L1発現状況別(CPS≧1、CPS<1)の解析を実施した。PFS、OS、ORR、DOR、PD-L1発現状況(CPS≧1、CPS<1)別のPFS及びOSの解析はMMRステータスに基づき、pMMR又はdMMRの集団別に評価した。
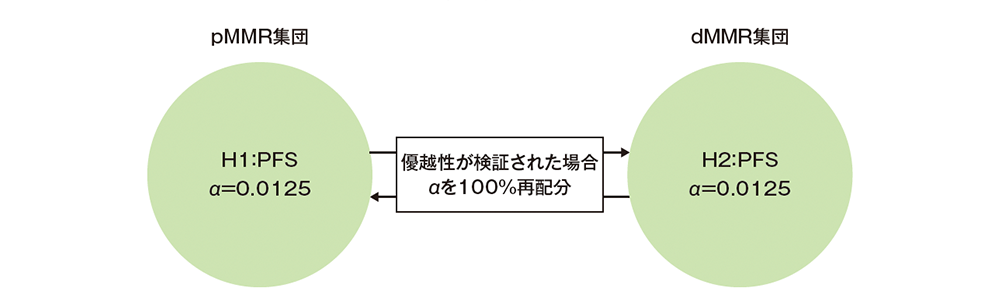
多重性の調整:本試験では有効性の1回の中間解析を事前に計画し、試験全体の第一種の過誤の確率を有意水準片側2.5%となるように厳密に制御した。PFSの解析では、各MMR集団に対してLan-DeMetsによるO’Brien-Fleming型の消費関数による境界値を用いた。中間解析は両MMR集団の登録が完了し、各MMR集団でPFSの目標イベント数の50%以上の情報量が観察された時点で実施することとした。本試験では2つの仮説(H1:pMMR集団のPFS、H2:dMMR集団のPFS)を設定し、多重性の調整は、Maurer and Bretzのgraphical approachを用いた。最初にH1、H2にそれぞれ有意水準片側1.25%を割り当て、一方のMMR集団の帰無仮説が棄却された場合もう一方のMMR集団に再配分できることとした。両方の仮説を同時に検定する場合、H2を最初に検定し、H2が統計学的に有意であった場合、有意水準片側1.25%をH1に再配分する。それ以外の場合では、PFSの目標イベント数の50%以上の情報量が先に観察されたMMR集団から先に検定を実施することとした。
多重性の調整
*1 pMMR(mismatch repair proficient):ミスマッチ修復機構を有する
*2 dMMR(mismatch repair deficient):ミスマッチ修復機構欠損を有する
*3 中央検査機関又は治験実施医療機関のMMRに対する免疫組織化学(IHC)検査結果に基づき患者を割り付けた。ただし、無作為割り付けされた患者のMMRステータスについて、中央検査機関の確認を必須とした
*4 過敏症反応のためパクリタキセルの継続ができない患者に対しては、ドセタキセル(日本では60-70mg/m2)の投与が可能とされた。プロトコールではアルブミン懸濁型パクリタキセルへの変更も可能であったが、アルブミン懸濁型パクリタキセルの子宮体癌への投与は国内未承認である
※アルブミン懸濁型パクリタキセルの効能又は効果は以下のとおりである
4.効能又は効果
○乳癌 ○胃癌 ○非小細胞肺癌 ○治癒切除不能な膵癌
*5 安定(SD)又は部分奏効(PR)が認められ、サイクル6終了時点で測定可能病変が残存していた患者は併用療法期の投与を最大サイクル10まで継続できるものとした(治験担当医師が必要と判断した場合)。サイクル7-10を継続した患者は、サイクル1-6と同様にすべての評価を継続した
*6 ITT(intention to treat)集団:無作為化されたすべての患者
*7 APaT(all participants as treated)集団:無作為化され治験薬を1回以上投与されたすべての患者
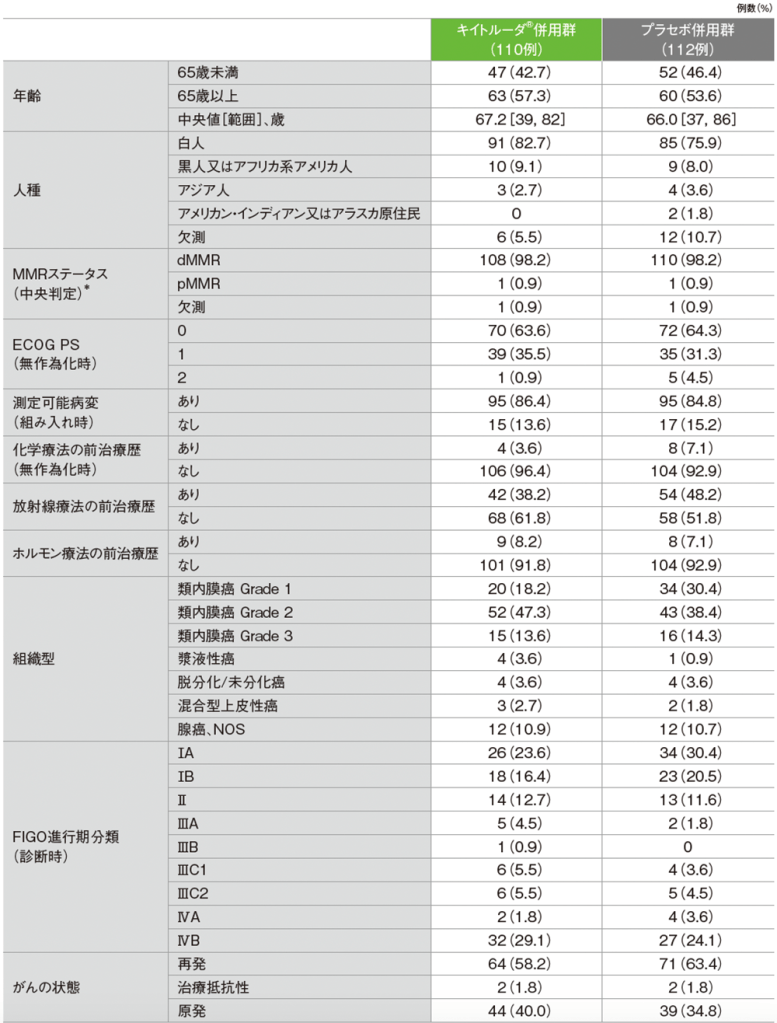
pMMR集団の患者背景(ITT集団)
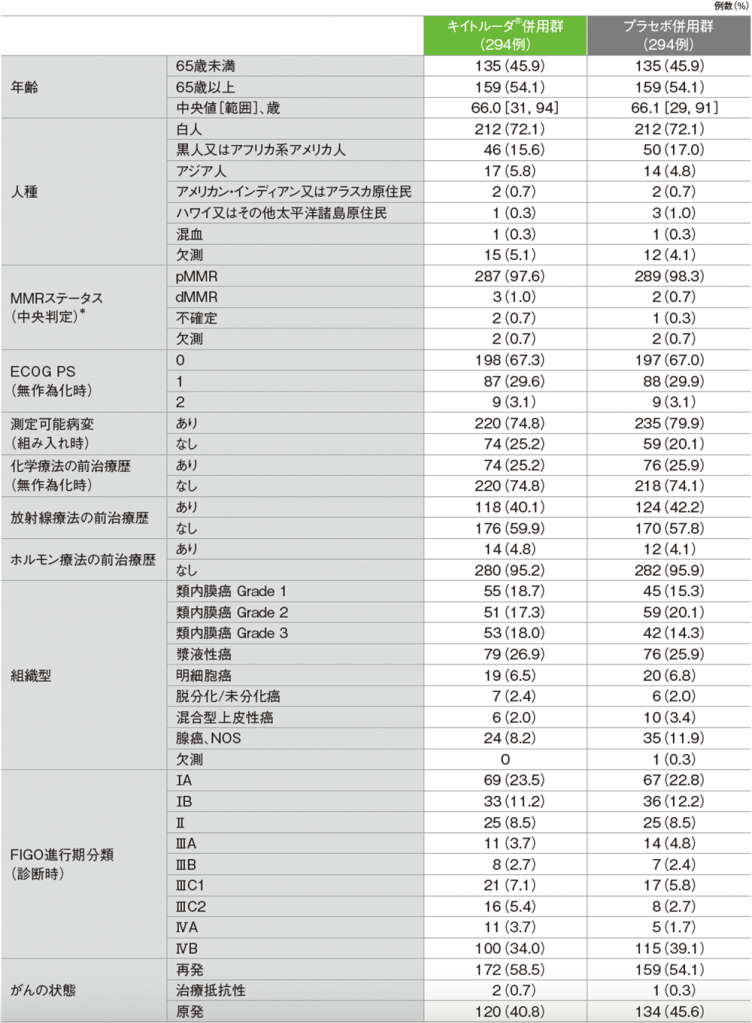
NOS:Not Otherwise Specified(他に分類されない)
*中央検査機関又は治験実施医療機関のMMRに対する免疫組織化学(IHC)検査結果に基づき患者を割り付けた。ただし、無作為割り付けされた患者のMMRステータスについて、中央検査機関の確認を必須とした
主要評価項目:pMMR集団における無増悪生存期間(PFS)[検証的解析結果]

キイトルーダ®併用群では、プラセボ併用群と比較して、PFSの有意な延長が認められ(p<0.0001、層別ログランク検定[片側]、有意水準α=0.001162、検証的解析結果)、ハザード比は0.57(95%CI: 0.44, 0.74)でした。PFS中央値は、キイトルーダ®併用群で13.1ヵ月(95%CI: 10.6, 19.5)、プラセボ併用群で8.7ヵ月(95%CI: 8.4, 11.0)でした。12ヵ月時点の無増悪生存率はキイトルーダ®併用群で52.0%(95%CI: 43.8, 59.5)、プラセボ併用群で29.5%(95%CI: 22.4, 37.0)でした。24ヵ月時点では、それぞれ38.3%(95%CI: 28.8, 47.7)、13.5%(95%CI: 6.9, 22.2)でした。
■pMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)


治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別ログランク検定[片側]、有意水準α=0.001162(検証的解析結果)
(データカットオフ日:2022年12月6日[pMMR集団])
探索的評価項目:pMMR集団におけるPD-L1発現状況別の無増悪生存期間(PFS)

■pMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS≧1]
![pMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS≧1]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2025/12/ken_keynote-868_17.png)
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデル
(データカットオフ日:2022年12月6日[pMMR集団])
■pMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS<1]
![pMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS<1]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2025/12/ken_keynote-868_18.png)
NE:Not Estimated
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデル
(データカットオフ日:2022年12月6日[pMMR集団])
副次評価項目:pMMR集団における全生存期間(OS)

■pMMR集団におけるOSのKaplan-Meier曲線(ITT集団)

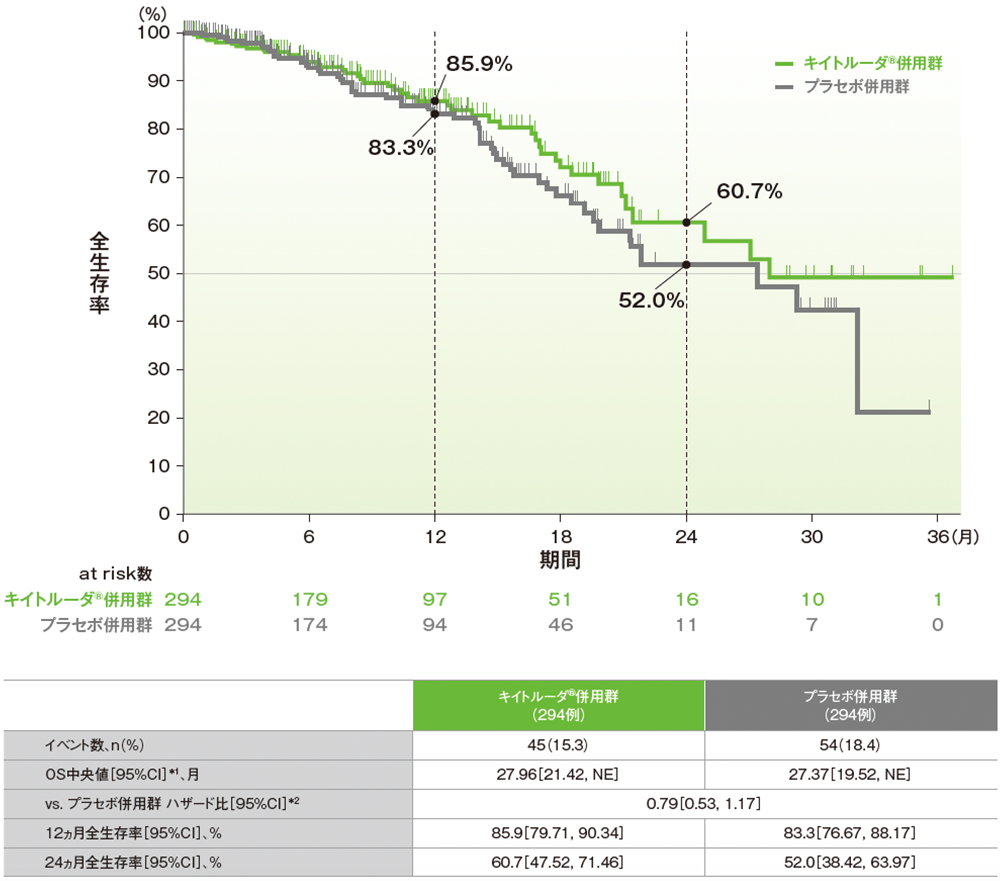
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
(データカットオフ日:2022年12月6日[pMMR集団])
副次評価項目:pMMR集団における奏効率(ORR)

■pMMR集団におけるORR(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

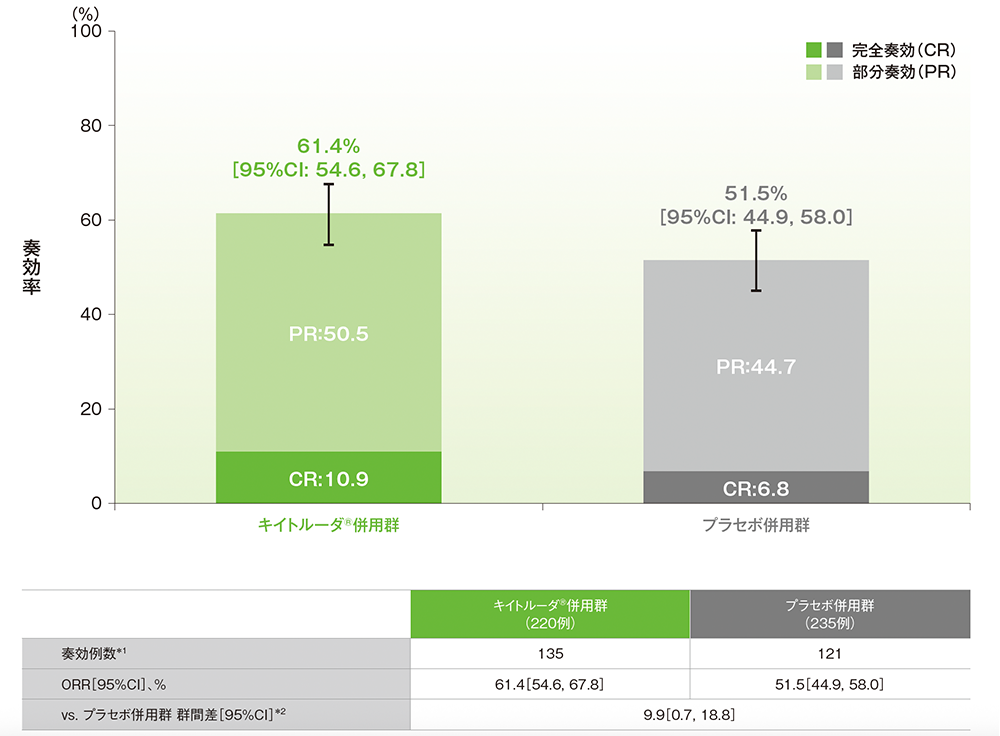
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 CR又はPRが認められた患者数
*2 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Miettinen and Nurminen法に基づく
(データカットオフ日:2022年12月6日[pMMR集団])
副次評価項目:pMMR集団における奏効期間(DOR)

■pMMR集団で奏効が認められた患者におけるDORのKaplan-Meier曲線(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

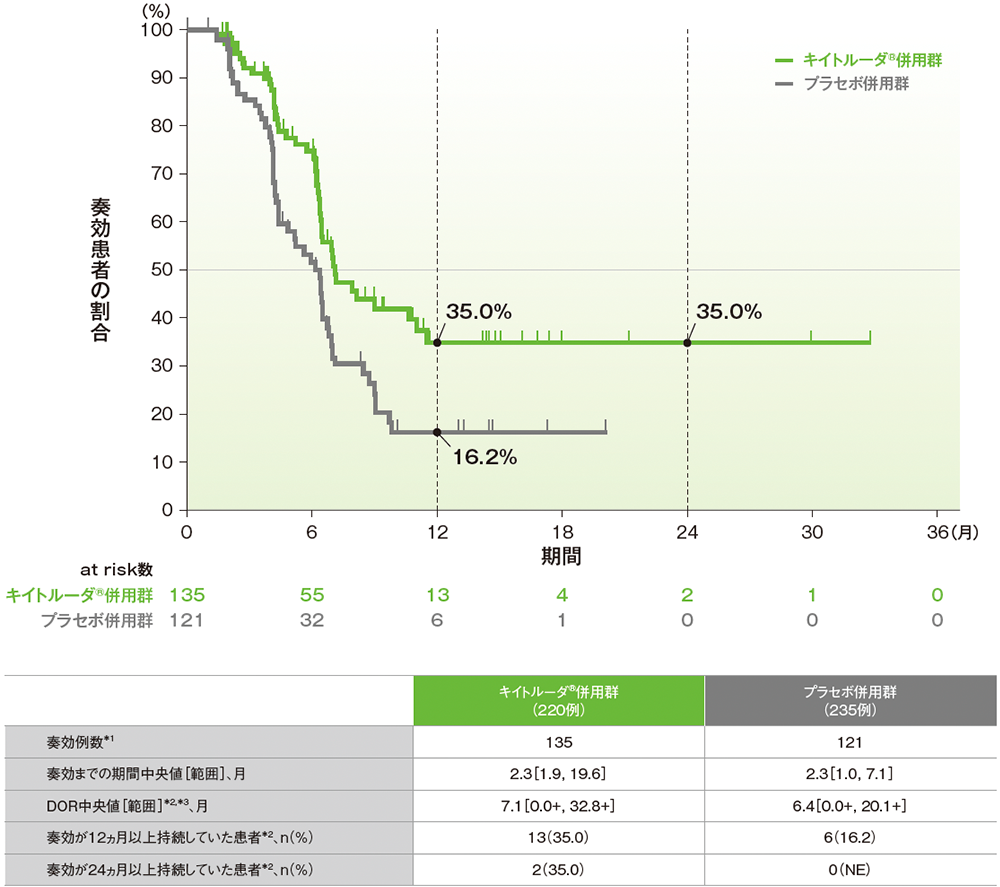
治験担当医師によるRECISTガイドライン1.1版に基づく評価
NE:Not Estimated
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3「+」は最後の疾患評価までPDがみられなかったことを示す
(データカットオフ日:2022年12月6日[pMMR集団])
本解析は事前に規定された解析時点ではないが、以下の理由により掲載する。
中間解析のデータカットオフ日は最後に患者が登録された日に近接しており、すべての患者がこの段階で無作為化されていなかったため、一部の患者では奏効評価のためのベースライン後の評価が得られていなかった。したがって、約9ヵ月の追加フォローアップを伴う事後解析が実施された。
また本試験の中間解析の結果は、特に追跡期間に関して未熟であることから、欧州医薬品委員会より更新された記述的分析の要請があった。
副次評価項目:pMMR集団における全生存期間(OS)

※ 中間解析にてPFSデータより有用性が認められたため、データモニタリング委員会により本試験の中止と盲検化解除が推奨され、以降は盲検が解除された状況下で試験が行われた。
■pMMR集団におけるOSのKaplan-Meier曲線(ITT集団)
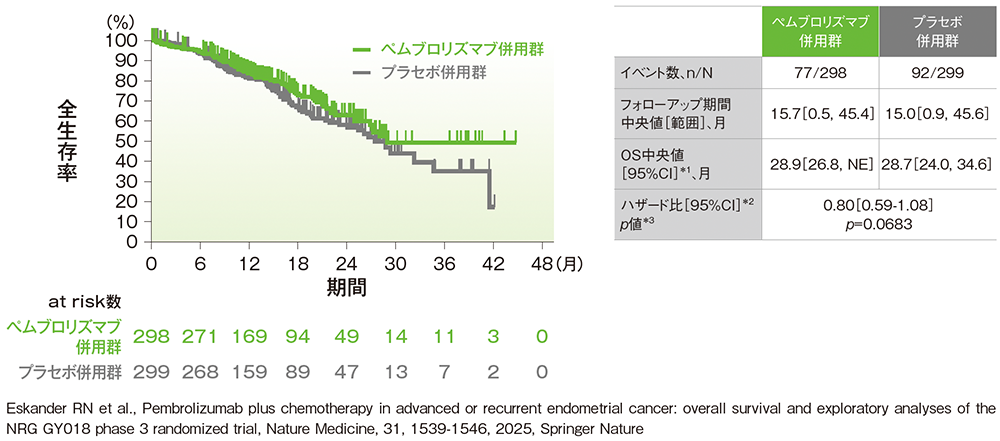
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別ログランク検定[片側]、p値は名目上のp値
(データカットオフ日:2023年8月18日[pMMR集団])
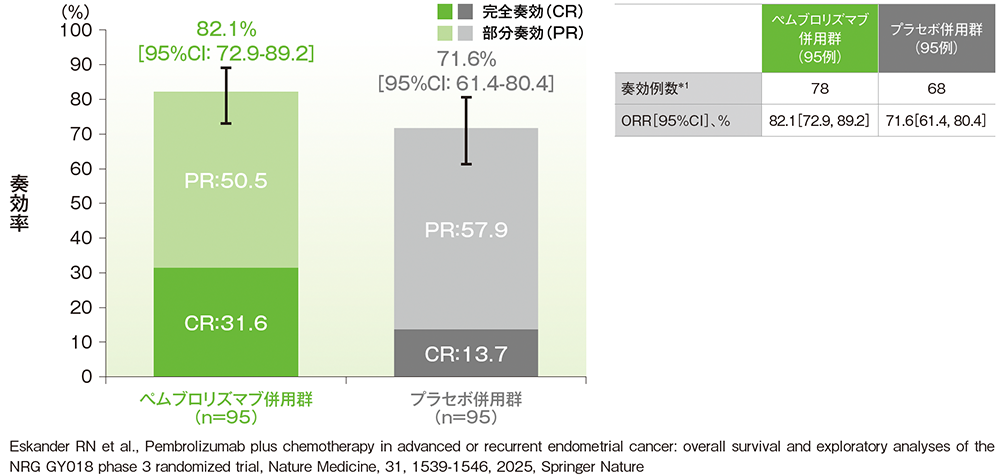
副次評価項目:pMMR集団における奏効率(ORR)

■pMMR集団におけるORR(ITT集団のうち、組み入れ時に測定可能病変を有する集団)
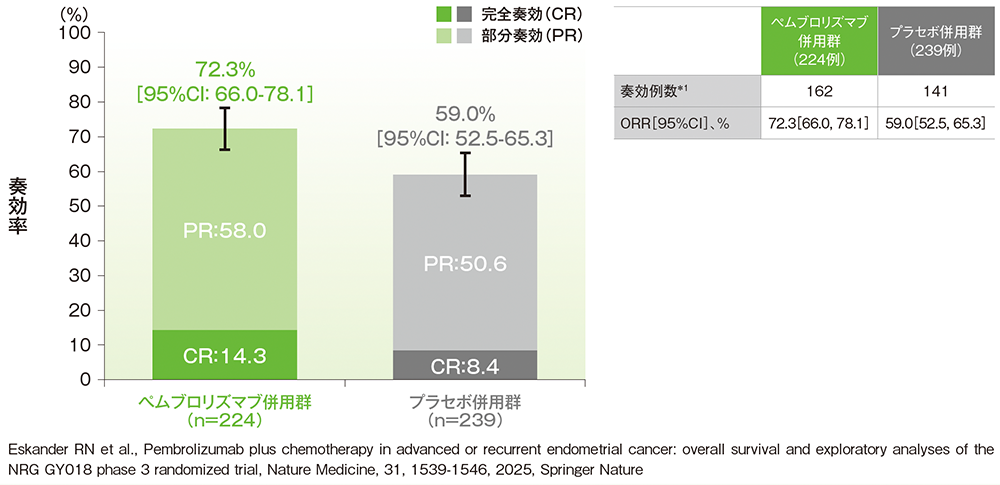
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 CR又はPRが認められた患者数
(データカットオフ日:2023年8月18日[pMMR集団])
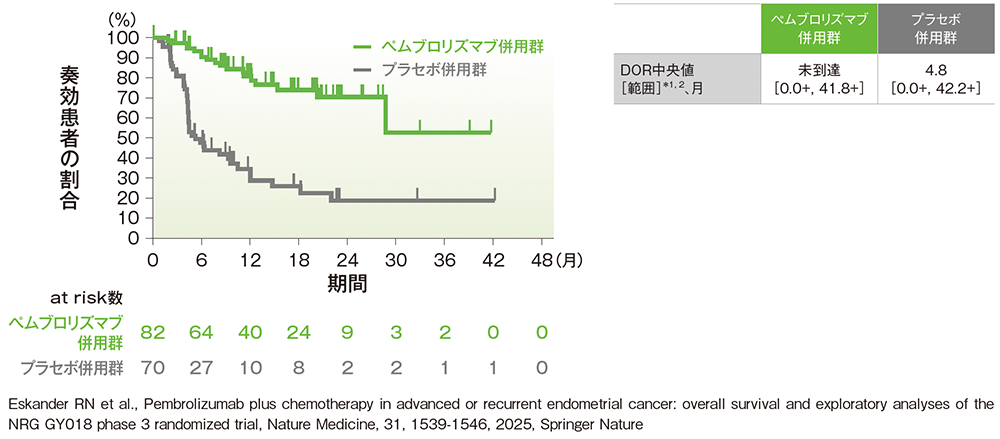
副次評価項目:pMMR集団における奏効期間(DOR)

■pMMR集団におけるDOR
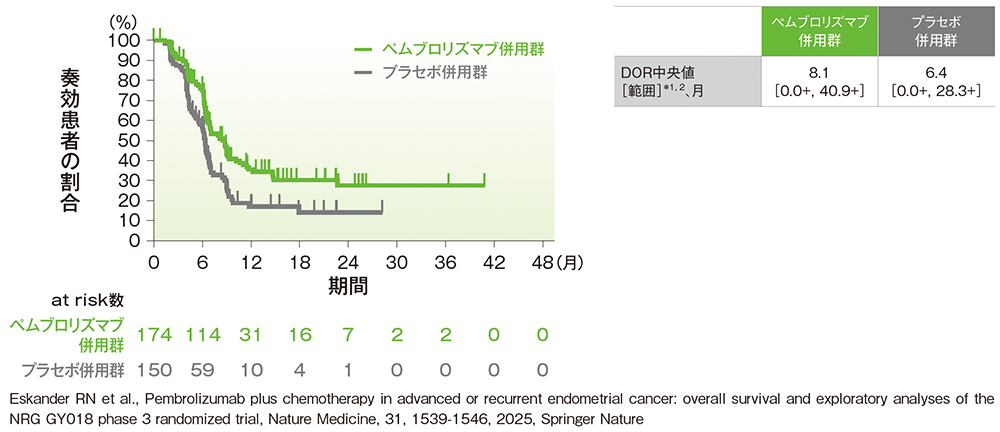
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2「+」は最後の疾患評価までPDがみられなかったことを示す
(データカットオフ日:2023年8月18日[pMMR集団])
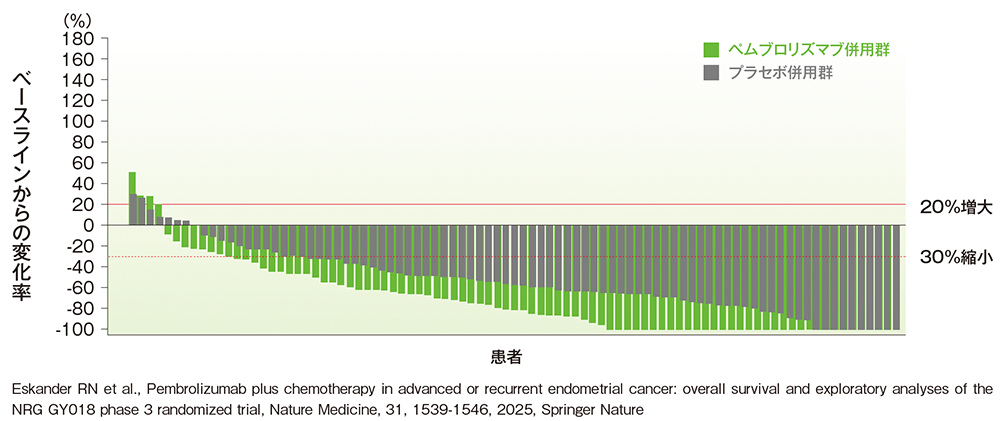
pMMR集団における標的病変のベースラインからの最大変化率

■pMMR集団における標的病変のベースラインからの最大変化率のウォーターフォールプロット
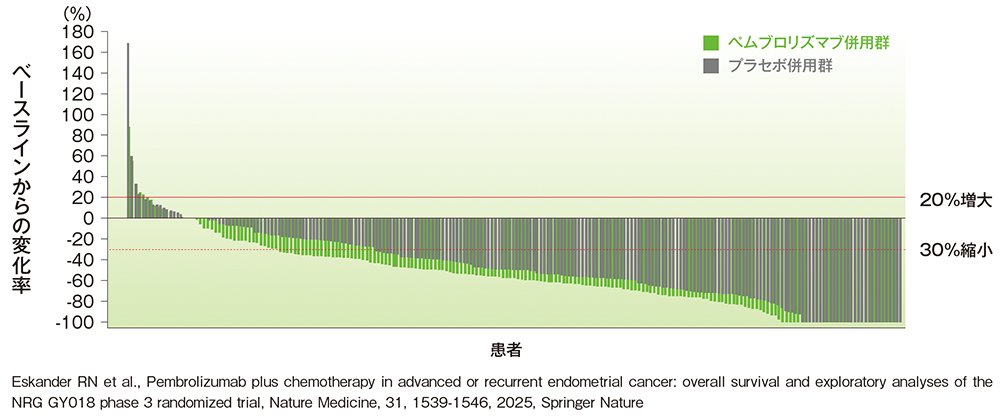
治験担当医師によるRECISTガイドライン1.1版に基づく評価
(データカットオフ日:2023年8月18日[pMMR集団])
dMMR集団の患者背景(ITT集団)
NOS:Not Otherwise Specified(他に分類されない)
*中央検査機関又は治験実施医療機関のMMRに対する免疫組織化学(IHC)検査結果に基づき患者を割り付けた。ただし、無作為割り付けされた患者のMMRステータスについて、中央検査機関の確認を必須とした
主要評価項目:dMMR集団における無増悪生存期間(PFS)[検証的解析結果]

キイトルーダ®併用群では、プラセボ併用群と比較して、PFSの有意な延長が認められ(p<0.0001、層別ログランク検定[片側]、有意水準α=0.002074、検証的解析結果)、ハザード比は0.34(95%CI: 0.22, 0.53)でした。PFS中央値は、キイトルーダ®併用群で未到達(95%CI: 30.7, NE)、プラセボ併用群で8.3ヵ月(95%CI: 6.5, 12.3)でした。12ヵ月時点の無増悪生存率はキイトルーダ®併用群で73.0%(95%CI: 62.0, 81.3)、プラセボ併用群で40.0%(95%CI: 29.3, 50.4)でした。24ヵ月時点では、それぞれ65.2%(95%CI: 52.7, 75.2)、27.4%(95%CI: 15.2, 41.1)でした。
■dMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)

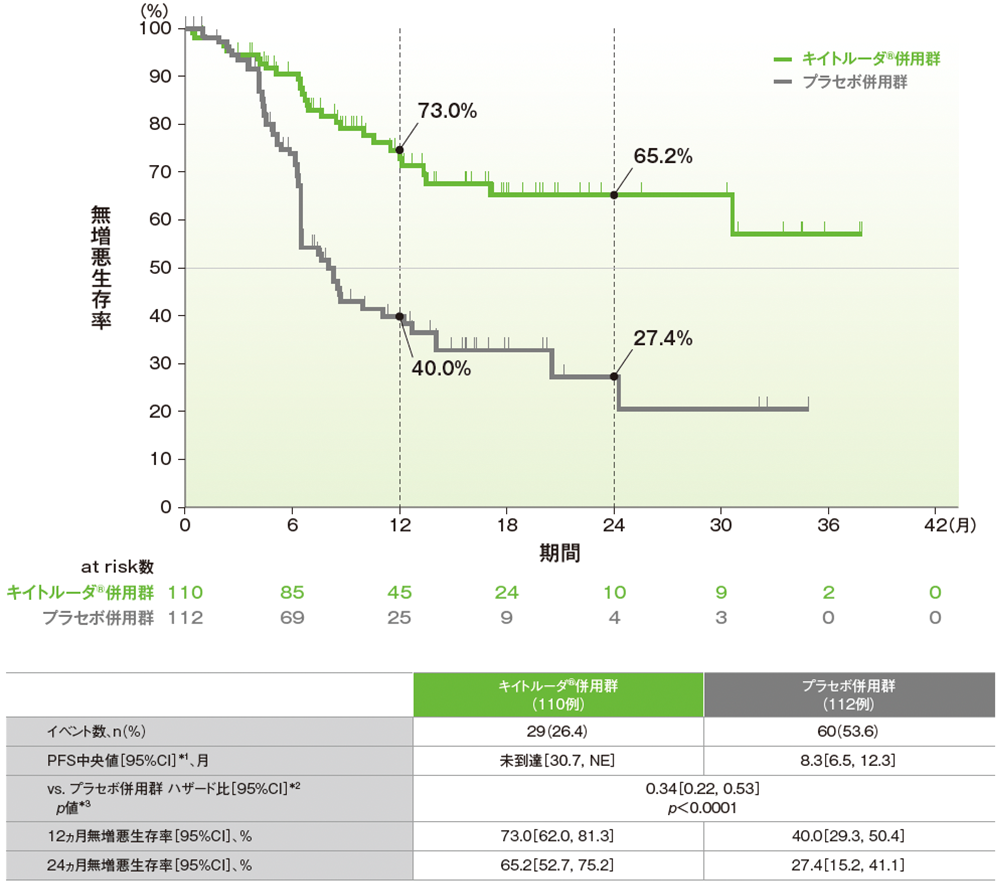
治験担当医師によるRECISTガイドライン1.1版に基づく評価
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別ログランク検定[片側]、有意水準α=0.002074(検証的解析結果)
(データカットオフ日:2022年12月16日[dMMR集団])
探索的評価項目:dMMR集団におけるPD-L1発現状況別の無増悪生存期間(PFS)

■dMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS≧1]
![dMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS≧1]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2025/12/ken_keynote-868_23.png)
NE:Not Estimated
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデル
(データカットオフ日:2022年12月16日[dMMR集団])
■dMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS<1]
![dMMR集団におけるPFSのKaplan-Meier曲線(ITT集団)[CPS<1]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2025/12/ken_keynote-868_24.png)
NE:Not Estimated
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量としたCox比例ハザードモデル
(データカットオフ日:2022年12月16日[dMMR集団])
副次評価項目:dMMR集団における全生存期間(OS)

■dMMR集団におけるOSのKaplan-Meier曲線(ITT集団)

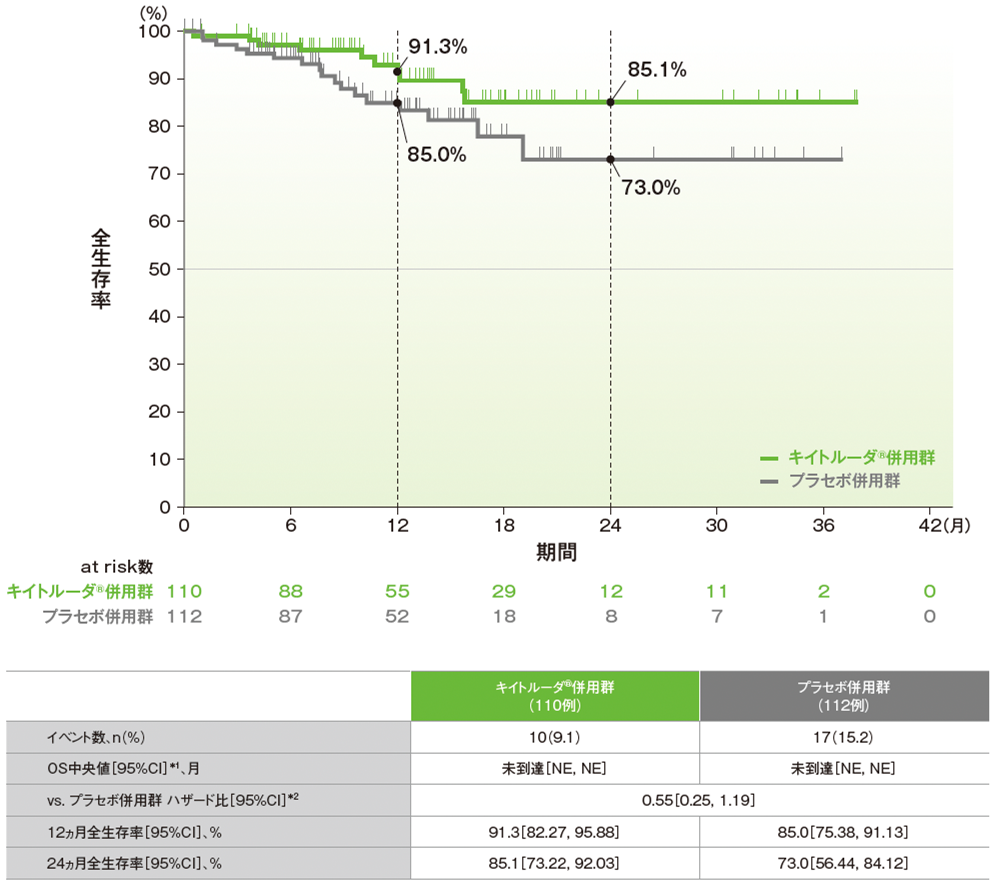
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
(データカットオフ日:2022年12月16日[dMMR集団])
副次評価項目:dMMR集団における奏効率(ORR)

■dMMR集団におけるORR(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

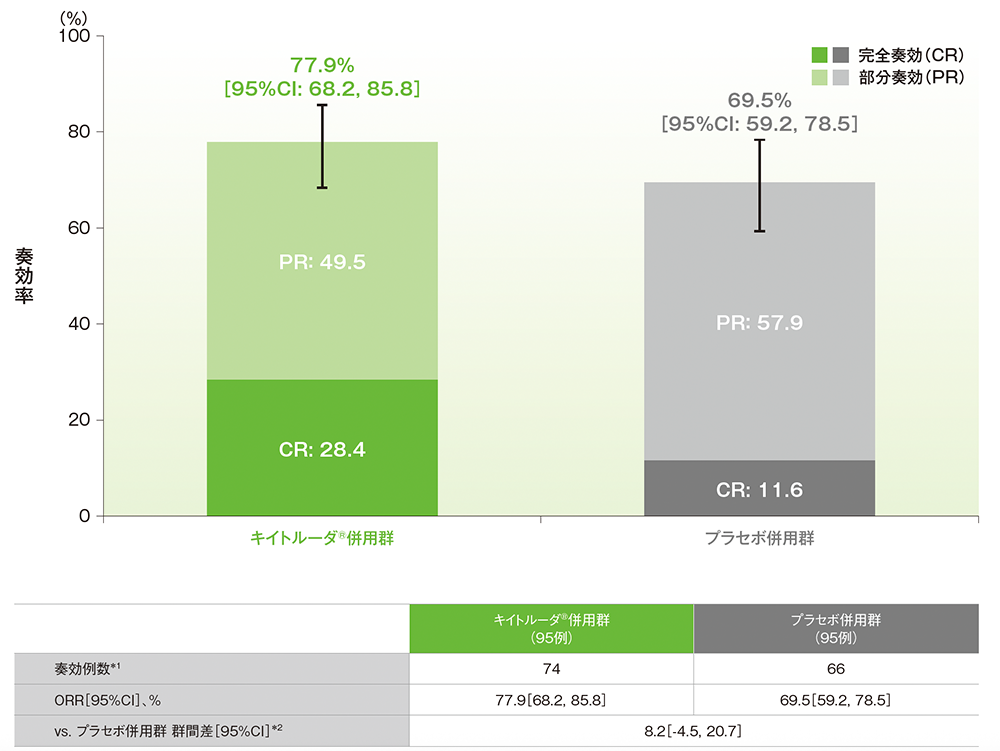
治験担当医師によるRECISTガイドライン1.1版に基づいた評価
*1 CR又はPRが認められた患者数
*2 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Miettinen and Nurminen法に基づく
(データカットオフ日:2022年12月16日[dMMR集団])
副次評価項目:dMMR集団における奏効期間(DOR)

■dMMR集団で奏効が認められた患者におけるDORのKaplan-Meier曲線(ITT集団のうち、組み入れ時に測定可能病変を有する集団)

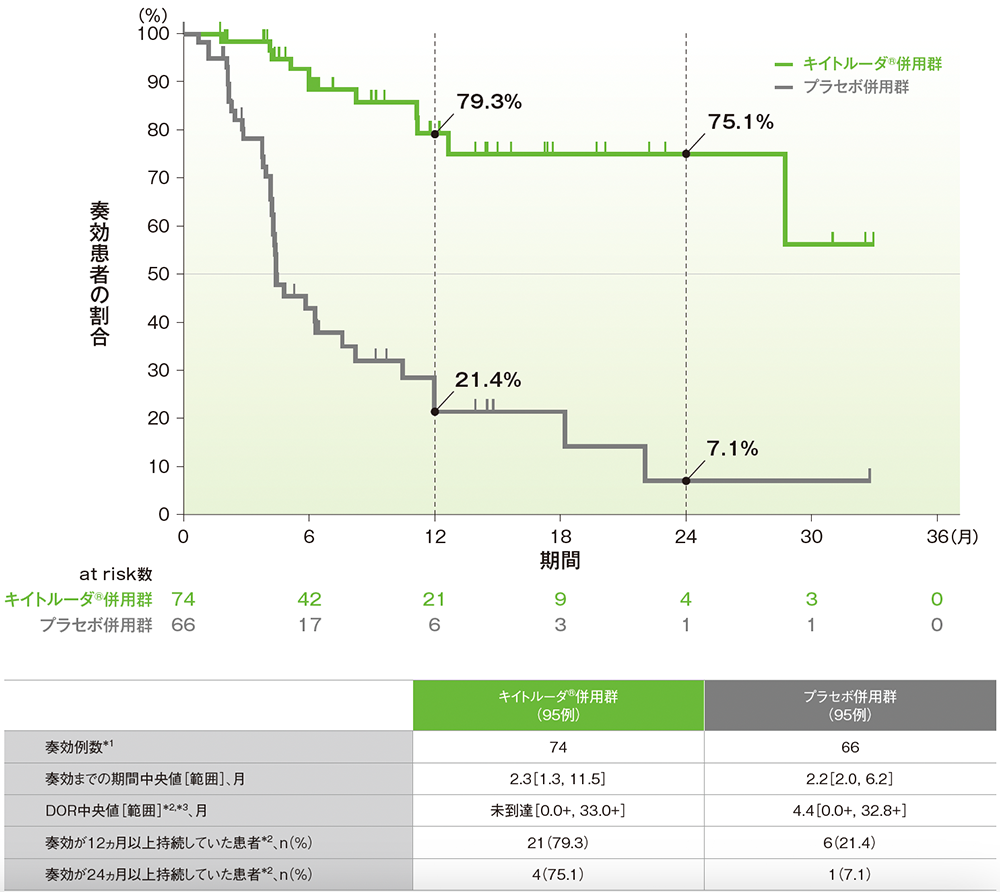
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3「+」は最後の疾患評価までPDがみられなかったことを示す
(データカットオフ日:2022年12月16日[dMMR集団])
本解析は事前に規定された解析時点ではないが、以下の理由により掲載する。
中間解析のデータカットオフ日は最後に患者が登録された日に近接しており、すべての患者がこの段階で無作為化されていなかったため、一部の患者では奏効評価のためのベースライン後の評価が得られていなかった。したがって、約9ヵ月の追加フォローアップを伴う事後解析が実施された。
また本試験の中間解析の結果は、特に追跡期間に関して未熟であることから、欧州医薬品委員会より更新された記述的分析の要請があった。
副次評価項目:dMMR集団における全生存期間(OS)

※ 中間解析にてPFSデータより有用性が認められたため、データモニタリング委員会により本試験の中止と盲検化解除が推奨され、以降は盲検が解除された状況下で試験が行われた。
■dMMR集団におけるOSのKaplan-Meier曲線(ITT集団)
NE:Not Estimated
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 術後補助化学療法の前治療歴(あり、なし)を層別因子とした層別ログランク検定[片側]、p値は名目上のp値
(データカットオフ日:2023年8月18日[dMMR集団])
副次評価項目:dMMR集団における奏効率(ORR)

■dMMR集団におけるORR(ITT集団のうち、組み入れ時に測定可能病変を有する集団)
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 CR又はPRが認められた患者数
(データカットオフ日:2023年8月18日[dMMR集団])
副次評価項目:dMMR集団における奏効期間(DOR)

■dMMR集団におけるDOR
治験担当医師によるRECISTガイドライン1.1版に基づく評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2「+」は最後の疾患評価までPDがみられなかったことを示す
(データカットオフ日:2023年8月18日[dMMR集団])
dMMR集団における標的病変のベースラインからの最大変化率

■dMMR集団における標的病変のベースラインからの最大変化率のウォーターフォールプロット
治験担当医師によるRECISTガイドライン1.1版に基づく評価
(データカットオフ日:2023年8月18日[dMMR集団])
安全性
全体集団における主な副作用(APaT集団)

■キイトルーダ®併用群(382例)

MedDRA/J v26.0(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
■プラセボ併用群(377例)

MedDRA/J v26.0(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
*有害事象/副作用/合併症により投与中止となった患者数
本試験では、治験薬の投与中止に至った有害事象を特定することを規定していなかったため、社内資料に治験薬の投与中止に至った有害事象の割合及び内訳はなし
全体集団における主な副作用(いずれかの投与群で発現率5%以上)(APaT集団)

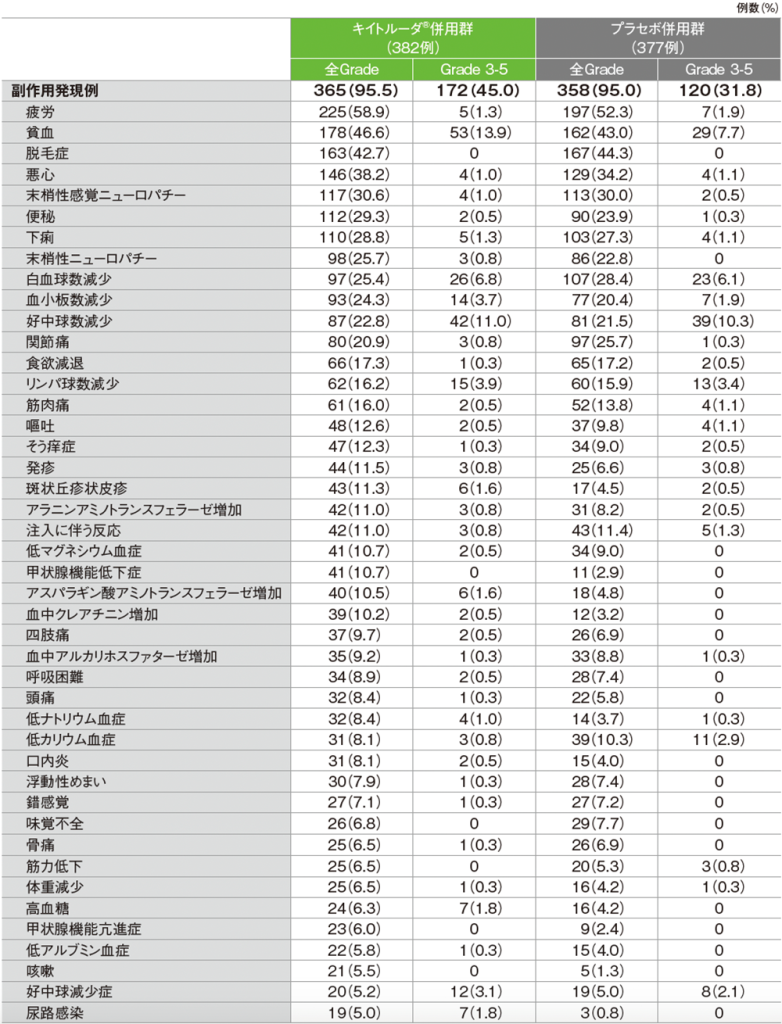
MedDRA/J v26.0、GradeはCTCAE v5.0
(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
全体集団における免疫関連など特に注目すべき有害事象(APaT集団)※

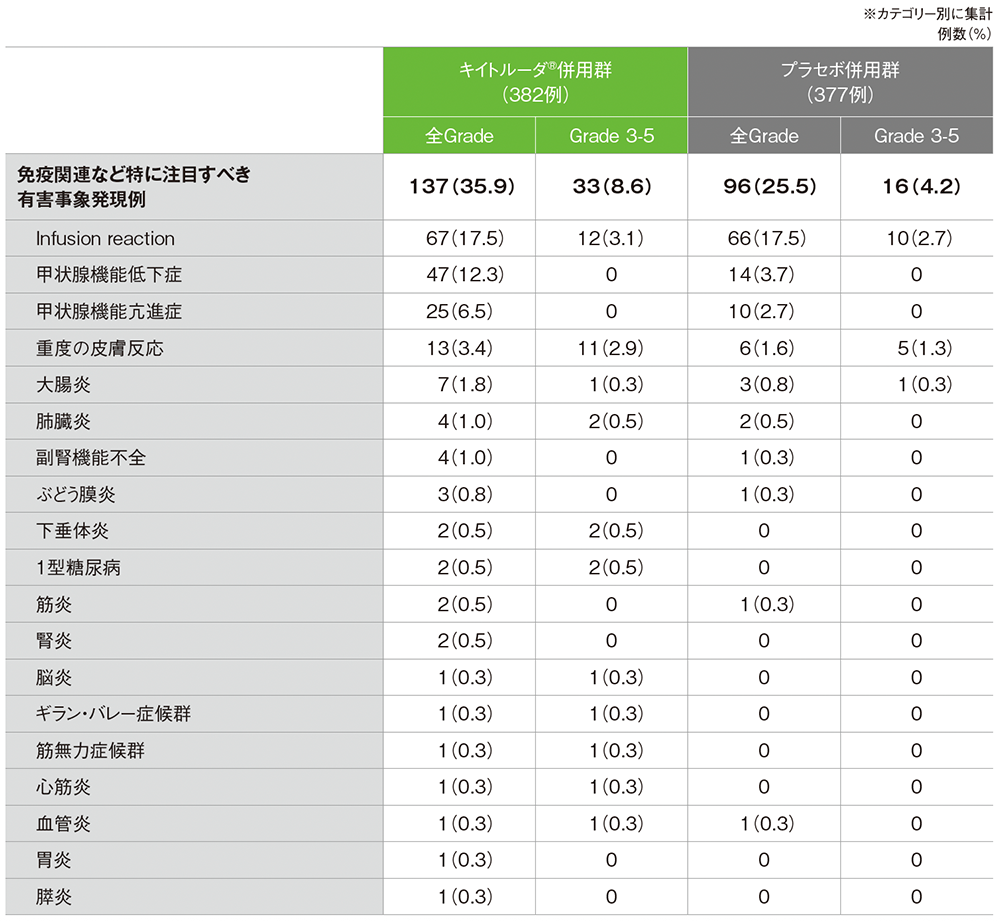
MedDRA/J v26.0、GradeはCTCAE v5.0
(データカットオフ日:2022年12月6日[pMMR集団]、2022年12月16日[dMMR集団])
本解析は事前に規定された解析時点ではないが、以下の理由により掲載する。
中間解析のデータカットオフ日は最後に患者が登録された日に近接しており、すべての患者がこの段階で無作為化されていなかったため、一部の患者では奏効評価のためのベースライン後の評価が得られていなかった。したがって、約9ヵ月の追加フォローアップを伴う事後解析が実施された。
また本試験の中間解析の結果は、特に追跡期間に関して未熟であることから、欧州医薬品委員会より更新された記述的分析の要請があった。
全体集団における主な有害事象及び免疫関連など特に注目すべき有害事象(APaT集団)

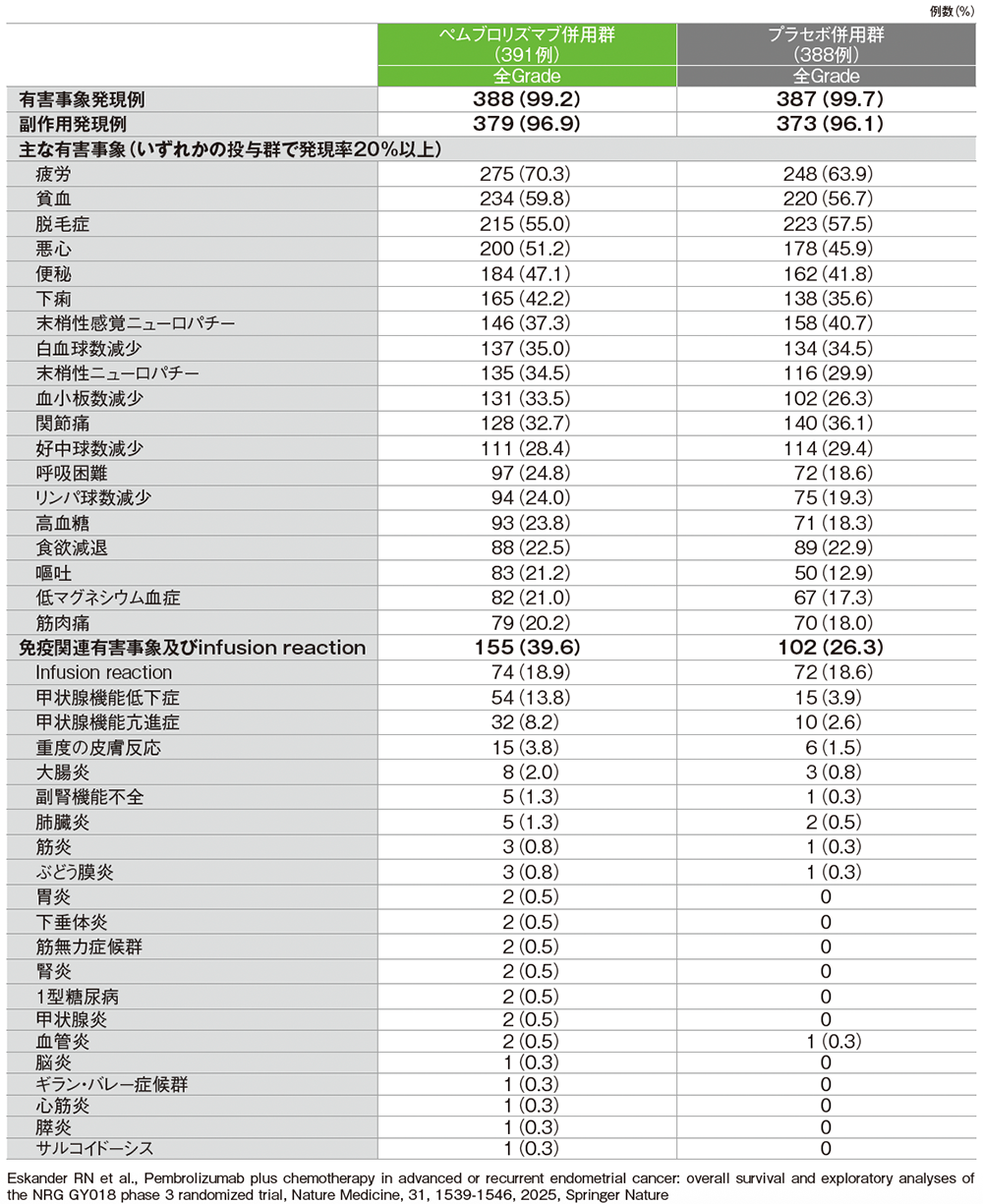
GradeはCTCAE v5.0
(データカットオフ日:2023年8月18日)
全体集団における重篤な副作用、治験薬投与が中止となった患者、治験薬投与が中止となった副作用、死亡に至った副作用(APaT集団)

● 重篤な副作用
論文中に記載なし
● 治験薬投与が中止となった患者
キイトルーダ®併用群:18.2%
pMMR集団で50/284例、dMMR集団で21/107例
プラセボ併用群:7.2%
pMMR集団で22/283例、dMMR集団で6/105例
● 治験薬投与が中止となった副作用
論文中に記載なし
● 死亡に至った副作用
論文中に記載なし
治療を中止した患者における後治療(ITT集団)

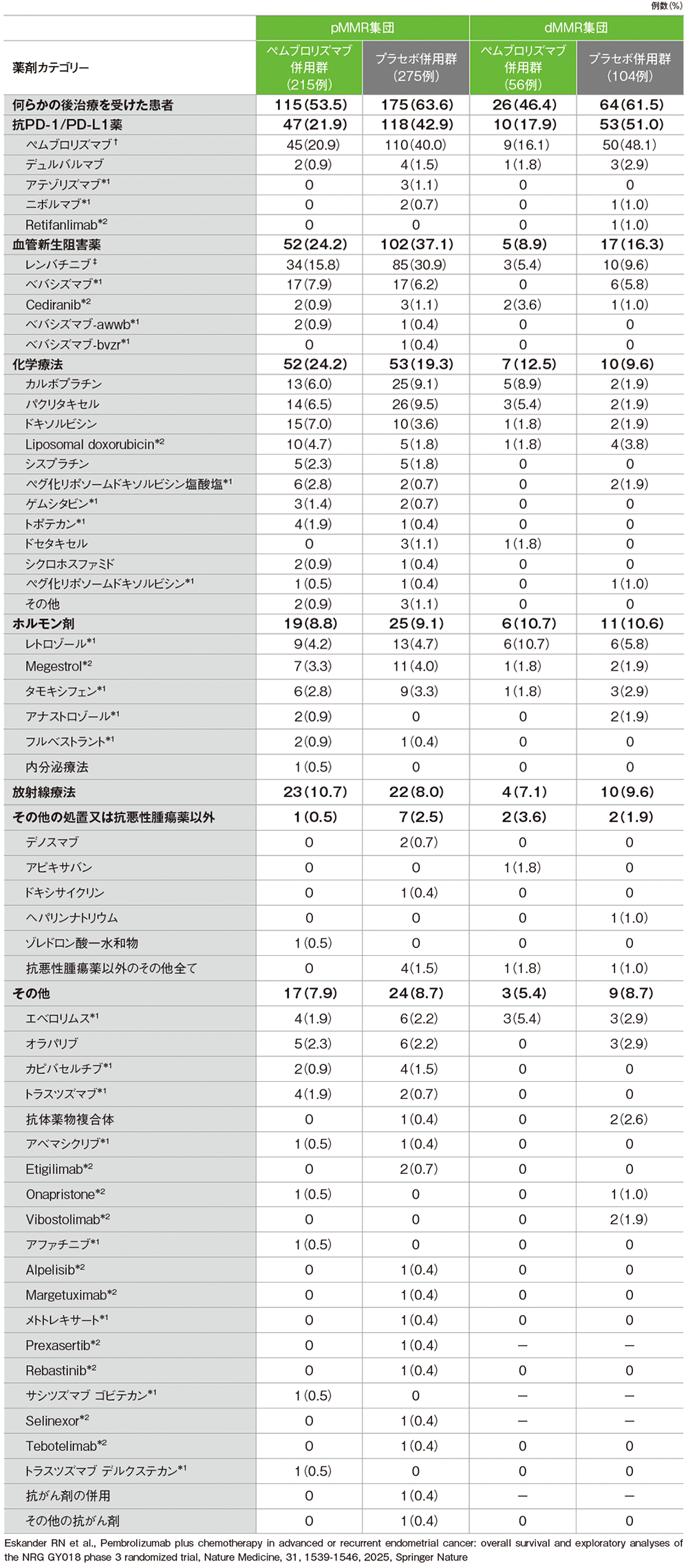
*1 子宮体癌に対し国内未承認
*2 国内未承認
†pMMRの子宮体癌に対する単独投与は国内未承認
‡子宮体癌に対する単独投与は国内未承認
ある治療カテゴリー内で複数の抗がん治療を受けた患者は、そのカテゴリーについて1回としてカウントした
(データカットオフ日:2023年8月18日)
キイトルーダ®(ペムブロリズマブ)の効能又は効果、用法及び用量
4.効能又は効果(抜粋)がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形癌(標準的な治療が困難な場合に限る)
6.用法及び用量(抜粋)
〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7.用法及び用量に関連する注意(抜粋)
〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉
7.15 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
〈効能共通〉
7.16 本剤投与により副作用が発現した場合には、電子添文記載の表を参考に、本剤を休薬又は中止すること。
アテゾリズマブの効能又は効果
〈製剤共通〉
○切除不能な進行・再発の非小細胞肺癌○PD-L1陽性の非小細胞肺癌における術後補助療法○進展型小細胞肺癌○切除不能な胞巣状軟部肉腫○再発又は難治性の節外性NK/T細胞リンパ腫・鼻型
〈テセントリク点滴静注1200mg〉
○切除不能な肝細胞癌
〈テセントリク点滴静注840mg〉
○PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
ニボルマブの効能又は効果
〇悪性黒色腫〇切除不能な進行・再発の非小細胞肺癌〇非小細胞肺癌における術前補助療法〇根治切除不能又は転移性の腎細胞癌〇再発又は難治性の古典的ホジキンリンパ腫〇再発又は遠隔転移を有する頭頸部癌〇治癒切除不能な進行・再発の胃癌〇切除不能な進行・再発の悪性胸膜中皮腫〇悪性中皮腫(悪性胸膜中皮腫を除く)〇治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌〇根治切除不能な進行・再発の食道癌〇食道癌における術後補助療法〇原発不明癌〇尿路上皮癌における術後補助療法〇根治切除不能な尿路上皮癌〇根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〇切除不能な肝細胞癌
レンバチニブの効能又は効果、用法及び用量
4. 効能又は効果(抜粋)
〈レンビマカプセル4mg〉がん化学療法後に増悪した切除不能な進行・再発の子宮体癌
〈レンビマカプセル10mg〉がん化学療法後に増悪した切除不能な進行・再発の子宮体癌
6. 用法及び用量(抜粋)
〈がん化学療法後に増悪した切除不能な進行・再発の子宮体癌〉
ペムブロリズマブ(遺伝子組換え)との併用において、通常、成人にはレンバチニブとして1日1回20mgを経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意(抜粋)
〈がん化学療法後に増悪した切除不能な進行・再発の子宮体癌〉
7.6 副作用があらわれた場合は、症状、重症度等に応じて電子添文記載の基準を考慮して、本剤を減量、休薬又は中止すること。減量して投与を継続する場合には、1日1回14mg、10mg、8mg又は4mgに減量すること。
ベバシズマブの効能又は効果
○治癒切除不能な進行・再発の結腸・直腸癌○扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌○手術不能又は再発乳癌○悪性神経膠腫○卵巣癌○進行又は再発の子宮頸癌○切除不能な肝細胞癌
ベバシズマブ後続2(ベバシズマブ-awwb)の効能又は効果
○治癒切除不能な進行・再発の結腸・直腸癌○扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌○手術不能又は再発乳癌○悪性神経膠腫○卵巣癌
ベバシズマブ後続1(ベバシズマブ-bvzr)の効能又は効果
〇治癒切除不能な進行・再発の結腸・直腸癌〇扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌〇手術不能又は再発乳癌○悪性神経膠腫○卵巣癌
ドキシルビシン塩酸塩(ペグ化リポソームドキソルビシン塩酸塩、ペグ化リポソームドキソルビシン)の効能又は効果
○がん化学療法後に増悪した卵巣癌○エイズ関連カポジ肉腫
ゲムシタビンの効能又は効果
〇非小細胞肺癌〇膵癌〇胆道癌〇尿路上皮癌〇手術不能又は再発乳癌〇がん化学療法後に増悪した卵巣癌〇再発又は難治性の悪性リンパ腫
ノギテカン塩酸塩(トポテカン)の効能又は効果
○小細胞肺癌○がん化学療法後に増悪した卵巣癌○小児悪性固形腫瘍○進行又は再発の子宮頸癌
レトロゾールの効能又は効果
○閉経後乳癌○生殖補助医療における調節卵巣刺激○多嚢胞性卵巣症候群における排卵誘発○原因不明不妊における排卵誘発
タモキシフェンの効能又は効果
乳癌
アナストロゾールの効能又は効果
閉経後乳癌
フルベストラントの効能又は効果
乳癌
エベロリムスの効能又は効果
○根治切除不能又は転移性の腎細胞癌○神経内分泌腫瘍○手術不能又は再発乳癌○結節性硬化症
カピバセルチブの効能又は効果
内分泌療法後に増悪したPIK3CA、AKT1又はPTEN遺伝子変異を有するホルモン受容体陽性かつHER2陰性の手術不能又は再発乳癌
トラスツズマブの効能又は効果
○HER2過剰発現が確認された乳癌○HER2過剰発現が確認された治癒切除不能な進行・再発の胃癌○HER2陽性の根治切除不能な進行・再発の唾液腺癌○がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌
アベマシクリブの効能又は効果
〇ホルモン受容体陽性かつHER2陰性の手術不能又は再発乳癌〇ホルモン受容体陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法
アファチニブの効能又は効果
EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌
メトトレキサートの効能又は効果
メトトレキサート錠
下記疾患の自覚的並びに他覚的症状の緩解
〇急性白血病〇絨毛性疾患(絨毛癌、破壊胞状奇胎、胞状奇胎)〇慢性リンパ性白血病〇慢性骨髄性白血病
注射用メトトレキサート
〈メトトレキサート通常療法〉
下記疾患の自覚的並びに他覚的症状の緩解
〇急性白血病〇慢性リンパ性白血病〇慢性骨髄性白血病〇絨毛性疾患(絨毛癌、破壊胞状奇胎、胞状奇胎)
〈CMF療法〉
〇乳癌
〈M-VAC療法〉
〇尿路上皮癌
サシツズマブ ゴビテカンの効能又は効果
化学療法歴のあるホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
トラスツズマブ デルクステカンの効能又は効果
○化学療法歴のあるHER2陽性の手術不能又は再発乳癌○ホルモン受容体陽性かつHER2低発現又は超低発現の手術不能又は再発乳癌○化学療法歴のあるHER2低発現の手術不能又は再発乳癌○がん化学療法後に増悪したHER2(ERBB2)遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌○がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の胃癌

