【胆道癌】治癒切除不能な胆道癌の1次治療におけるキイトルーダ®+化学療法(ゲムシタビン+シスプラチン)の併⽤療法 適正使⽤のポイント-KEYNOTE-966試験-
キイトルーダ® は2024年5⽉、「治癒切除不能な胆道癌」を効能⼜は効果として承認を取得いたしました。本動画では、治癒切除不能な胆道癌の1次治療において、キイト […]
承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-966試験)
Kelley RK et al. Lancet 2023; 401: 1853-1865
Kelley RK et al. Lancet 2023; 401: 1853-1865 Supplementary appendix
本試験はMSD社の資金提供により行われた。すべての著者が同社より原稿料を受領している。
Li Yu、Usha Malhotra、Abby B Siegelは、同社の社員である。
KEYNOTE-966試験は、治癒切除不能な胆道癌の1次治療において、キイトルーダ®+ゲムシタビン+シスプラチン療法のOSにおける優越性が検証された国際共同無作為化二重盲検第Ⅲ相試験です。
実薬群・プラセボ群ともに、8サイクルまでゲムシタビンとシスプラチンを併用し、9サイクル以降もゲムシタビンを継続するという投与方法を用いており、実臨床に即した試験デザインで有効性及び安全性を検討しました。
【目的】
未治療の治癒切除不能な胆道癌(肝内/肝外胆管癌及び胆嚢癌、ただし十二指腸乳頭部癌は除く)患者におけるキイトルーダ®とゲムシタビン(G)及びシスプラチン(C)併用群と、プラセボとGC併用群の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性試験](第1回中間解析結果 データカットオフ日:2021年12月15日)(最終解析結果 データカットオフ日:2022年12月15日)
【対象】
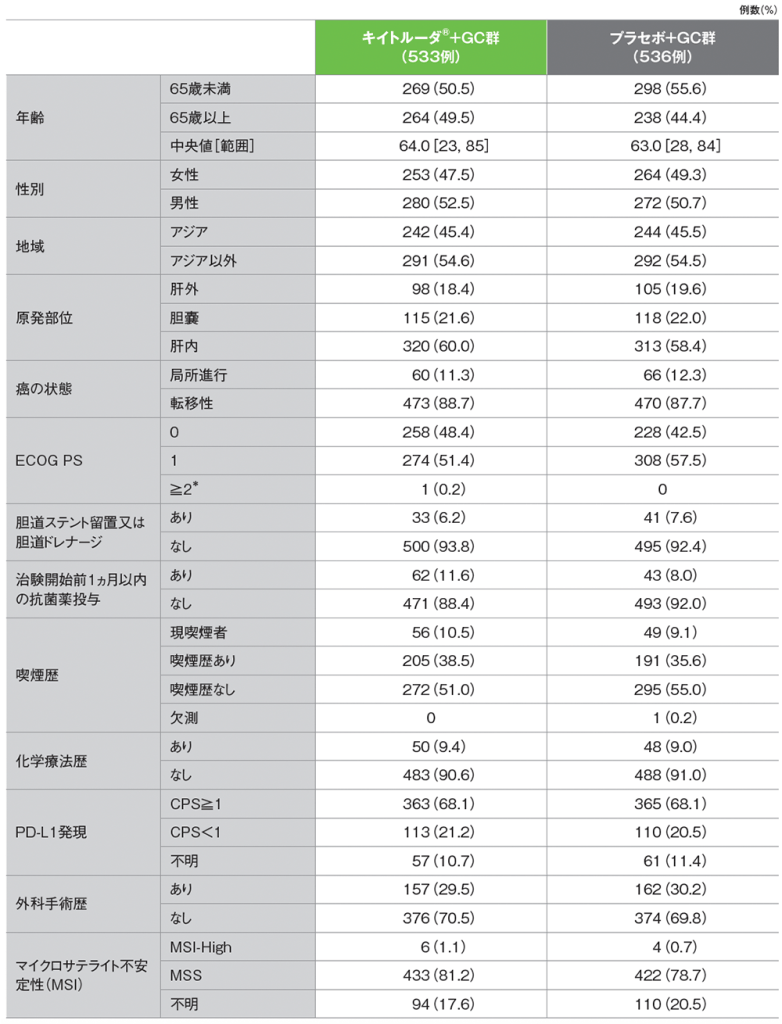
未治療の治癒切除不能な胆道癌(肝内/肝外胆管癌及び胆嚢癌)患者1,069例(日本人102例を含む)
【方法】
キイトルーダ®とGC併用群(以下、キイトルーダ®+GC群:キイトルーダ®200mg 3週間間隔(Q3W)+ゲムシタビン1000mg/m2及びシスプラチン25mg/m2 Q3W(1日目及び8日目に投与))又はプラセボとGC併用群(以下、プラセボ+GC群:プラセボ Q3W+ゲムシタビン1000mg/m2及びシスプラチン25mg/m2Q3W(1日目及び8日目に投与))に1:1の割合で無作為に割り付けた。キイトルーダ®又はプラセボは最大35サイクル、シスプラチンは最大8サイクルまで投与可能であり、ゲムシタビンは疾患進行又は許容できない有害事象の発現等まで投与可能とした。画像診断は、原則として無作為割り付けから54週時までは6週間間隔、その後は12週間間隔で実施した。
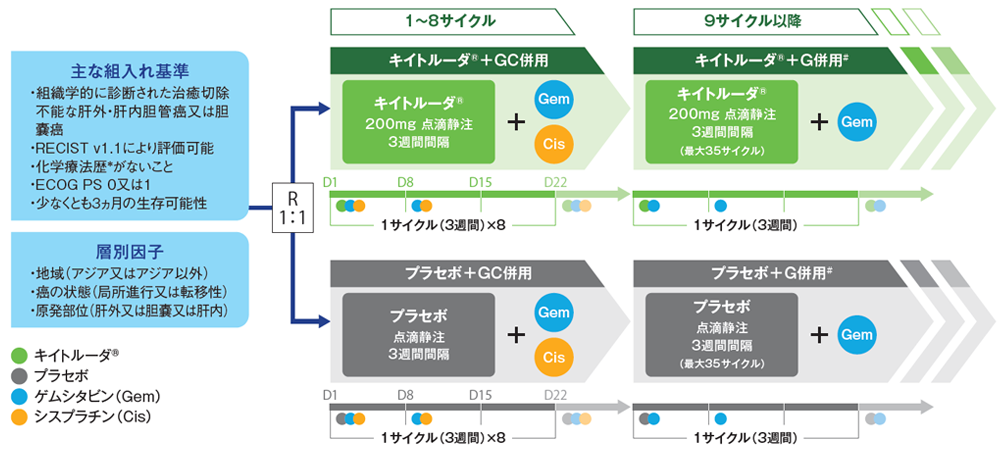
GC併用: ゲムシタビン1000mg/m2点滴静注3週間間隔(1日目及び8日目)+シスプラチン25mg/m2点滴静注3週間間隔(1日目及び8日目、最大8サイクルまで)
G併用: ゲムシタビン1000mg/m2点滴静注3週間間隔(1日目及び8日目)(中止事由に該当しない限り、期間の上限なし)
*術前又は術後補助療法としてゲムシタビン又はシスプラチンが投与された患者、及び治癒切除不能と診断された時点以前の6ヵ月間に術前又は術後補助療法が施行中であった患者は対象外とした
#治療は疾患進行(PD)、許容できない有害事象、治験担当医師の判断、投与期間の上限など中止事由が生じるまで継続した
肝炎ウイルス感染に関する基準: HCV感染患者及びコントロールされたHBV感染患者(治験薬初回投与の4週間以上前からHBVに対する抗ウイルス療法を受けており、かつ、治験薬初回投与前のHBVウイルス量が100IU/mL未満である患者)は本試験に組入れ可能とされた
【評価項目】
主要評価項目:全生存期間(overall survival:OS)※
副次評価項目:無増悪生存期間(progression free survival:PFS)※、奏効率(overall response rate:ORR)※、奏効期間(duration of response:DOR)、安全性(注目すべき肝臓関連事象を含む)など
探索的評価項目:健康関連QOLに関する患者報告アウトカム(PRO); EORTC QLQ-C30及びEORTC QLQ-BIL21のベースラインからのスコア変化及び悪化までの期間(TTD)、並びにEuroQoL EQ-5D-5Lなど
※検証的解析項目
【判定基準】
副次評価項目のPFS、ORR及びDORはRECISTガイドライン1.1版に基づき盲検下の独立判定委員会(BICR)の判定により評価した。
【解析計画】
解析対象集団:有効性の解析はITT*1集団、安全性の解析はAPaT*2集団、PROの解析はPRO FAS*3集団を対象として実施した。
有効性評価の統計手法:OS、PFSの生存曲線はKaplan-Meier法を用いて推定し、群間比較には、層別ログランク検定を用いた。OS、PFSの投与群を共変量とし、層別Cox比例ハザードモデルを用いて、ハザード比(HR)及び95%信頼区間(95%CI)を算出した。ORRの群間比較には、層別Miettinen and Nurminen法を用いた。DORはKaplan-Meier法による中央値と四分位点を用いて記述的に要約した。層別ログランク検定、層別Cox比例ハザードモデル及び層別Miettinen and Nurminen法の層別因子には、無作為化層別因子*4を用いた。
OSのサブグループ解析として、年齢(<65歳、≧65歳)、性別(男性、女性)、地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(胆嚢、肝内、肝外)、胆道ステント留置又は胆道ドレナージ(あり、なし)、治験開始前1ヵ月以内の抗菌薬投与(あり、なし)、化学療法歴(あり、なし)、喫煙歴(喫煙歴なし、喫煙歴あり、現喫煙者)、PD-L1発現(CPS*5≧1、CPS<1)、ECOG PS(0、1)などのベースライン時の背景因子別の部分集団を対象に、Cox比例ハザードモデルを用いて実施した。また、日本人集団については、ITT集団と同様の統計手法により解析したが、層での調整は行わなかった。
PRO評価の統計手法:PROスコアを応答変数として、投与群と時点の交互作用項を説明変数、無作為化層別因子を共変量に含めた制約つき経時データ解析 (cLDA) モデルを適用することとした。ベースラインからの最小二乗平均(LS平均)変化を要約した。EORTC QLQ-C30スコアは、事前に定義された閾値(ベースラインから10ポイント以上の変化)に従ってスコアの「改善」、「安定」、「悪化」に分類し要約した。TTDは、ベースラインのPRO評価から悪化又は死亡に至るまでの期間と定義し、Kaplan-Meier法を用いて生存曲線を推定した。層別因子を無作為化層別因子とする層別Cox比例ハザードモデルを用いて、HR及び95%CIを算出した。
多重性の調整:本試験ではOSについて2回の中間解析及び最終解析を実施し、PFSとORRは1回目の中間解析を最終解析とする計画とした。OS、PFS及びORRの全体の有意水準は片側2.5%となるように厳密に制御した。これらの多重性の調整には、Maurer & Bretzのグラフィカルアプローチを用い、次のように計画した。まず、有意水準をOSに片側2.5%配分する。OSが統計学的に有意であった場合、有意水準をPFSとORRに5割ずつ再配分する。PFSが統計学的に有意であった場合、有意水準をORRに再配分する。ORRが統計学的に有意であった場合、有意水準をPFSに再配分する。2回の中間解析と最終解析における有意水準の配分には、α消費関数を用いることとした。
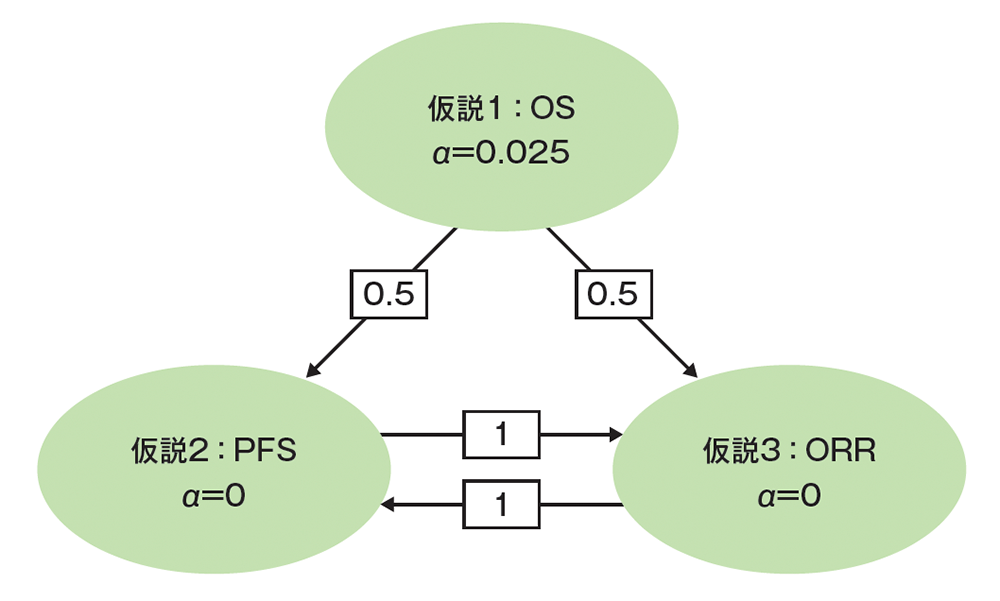
*1 ITT(intention to treat):無作為化されたすべての患者
*2 APaT( All Participants as Treated):治験薬を1回以上投与されたすべての患者
*3 PRO FAS(Patient-reported outcomes Full analysis set):治験薬投与を1回以上受け、1回以上の患者アンケート(PRO)の評価を実施したすべての患者
*4 無作為化層別因子:地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(胆嚢、肝内、肝外)
*5 CPS(combined positive score):PD-L1発現陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた数値
EORTC:European Organisation for the Research and Treatment of Cancer
EQ-5D-5L:European Quality of Life 5-dimension, 5-level Questionnaire
ECOG PS:Eastern Cooperative Oncology Group Performance Status
ゲムシタビンの用法及び用量は以下のとおりです。
6. 用法及び用量(抜粋)
〈膵癌、胆道癌、尿路上皮癌、がん化学療法後に増悪した卵巣癌、再発又は難治性の悪性リンパ腫〉
通常、成人にはゲムシタビンとして1回1000mg/m2を30分かけて点滴静注し、週1回投与を3週連続し、4週目は休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
* プロトコール違反
MSI-High:高頻度マイクロサテライト不安定性 MSS:マイクロサテライト安定性
■OSのKaplan-Meier曲線
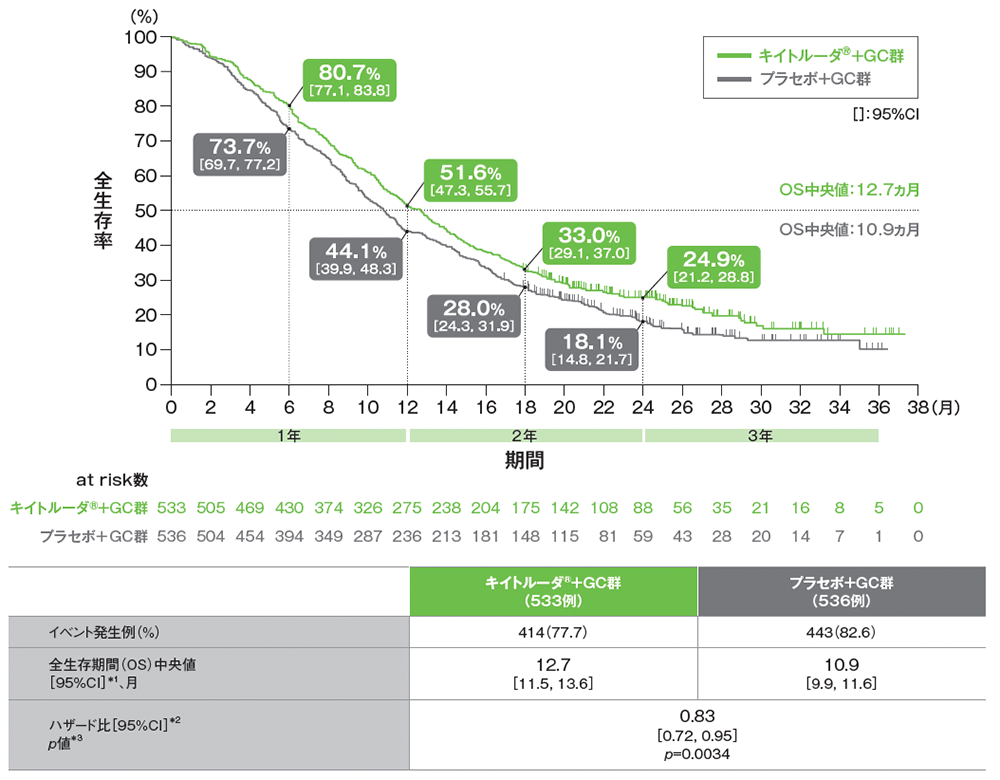
データカットオフ日:2022年12月15日[追跡期間中央値:25.6ヵ月(四分位範囲:21.7, 30.4)]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群のみを共変量とし、地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(肝外、胆嚢、肝内)を層別因子(無作為化層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定に基づく(層別因子は無作為化層別因子)[片側]、有意水準α=0.0200
■OSのフォレストプロット(ITT集団)
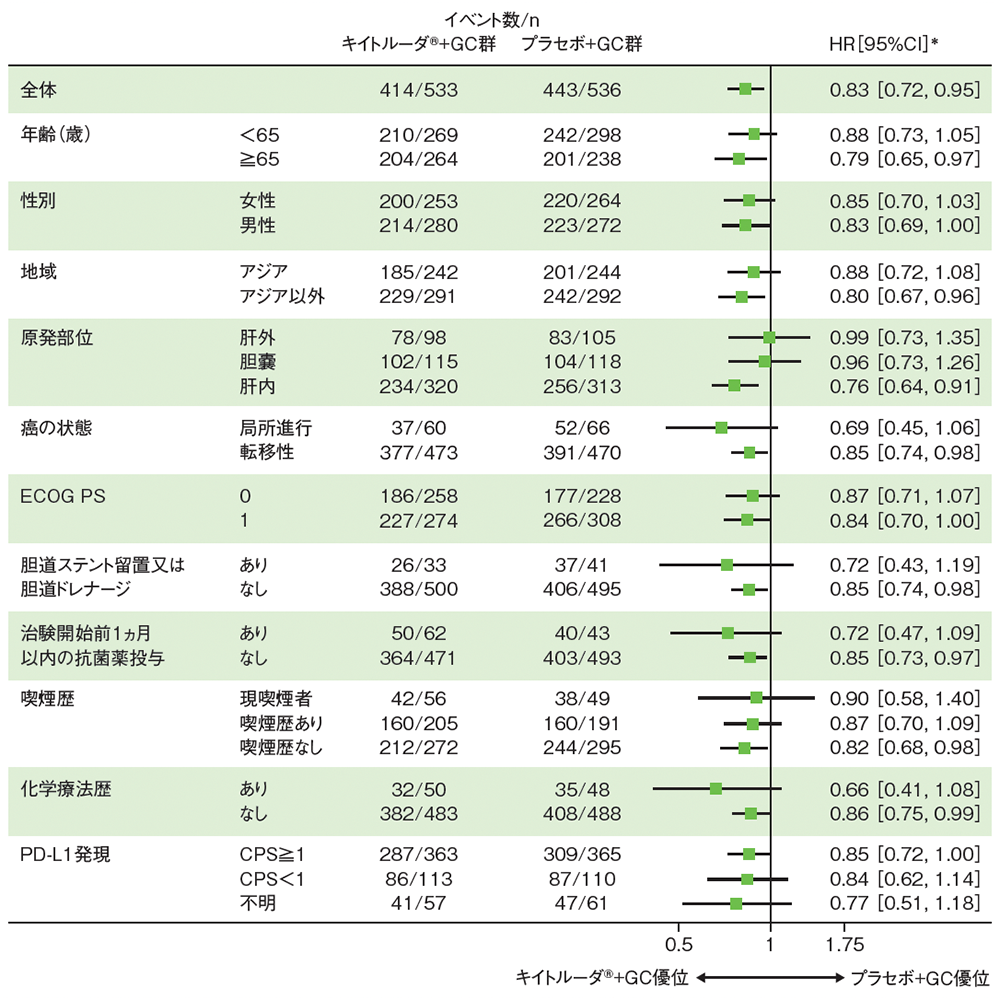
データカットオフ日:2022年12月15日[追跡期間中央値:25.6ヵ月(四分位範囲:21.7, 30.4)]
* サブグループ:投与群のみを共変量としたCox比例ハザードモデルに基づく 全体:投与群のみを共変量とし、地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(肝外、胆嚢、肝内)を層別因子とした層別Cox比例ハザードモデルに基づく
BICR:盲検下の独立判定委員会
■PFSのKaplan-Meier曲線
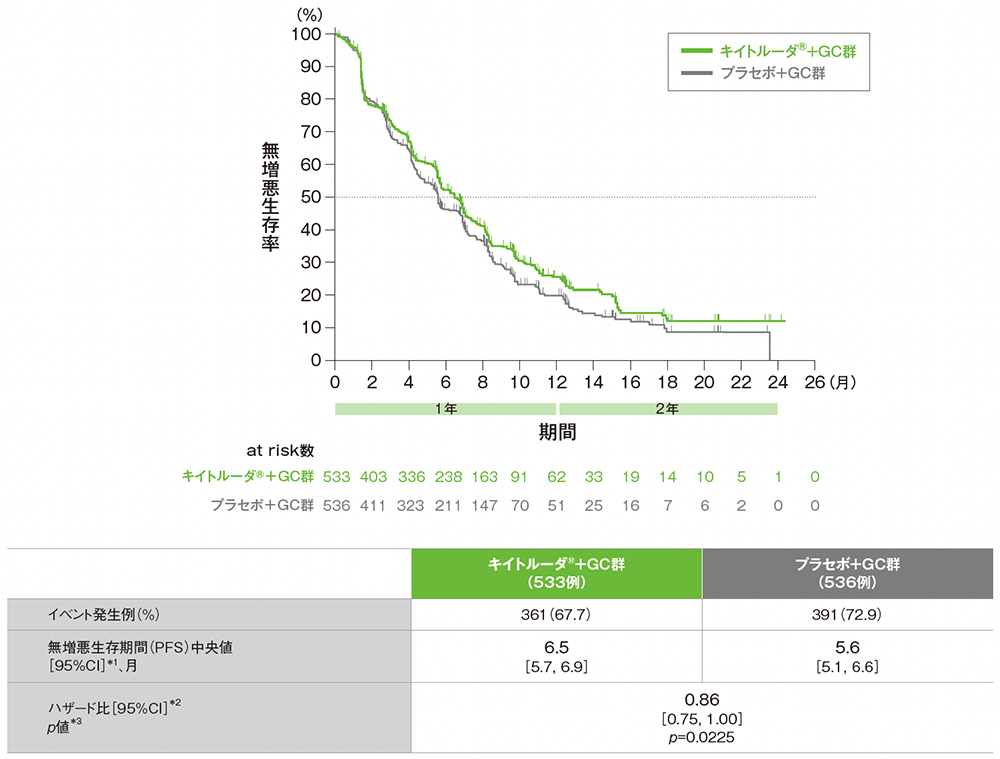
データカットオフ日:2021年12月15日[追跡期間中央値:13.6ヵ月(四分位範囲:9.7, 18.4)]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群のみを共変量とし、地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(肝外、胆嚢、肝内)を層別因子(無作為化層別因子)とした層別Cox比例ハザードモデルに基づく
*3 層別ログランク検定に基づく(層別因子は無作為化層別因子)[片側]、有意水準α=0.0125
■PFSのKaplan-Meier曲線
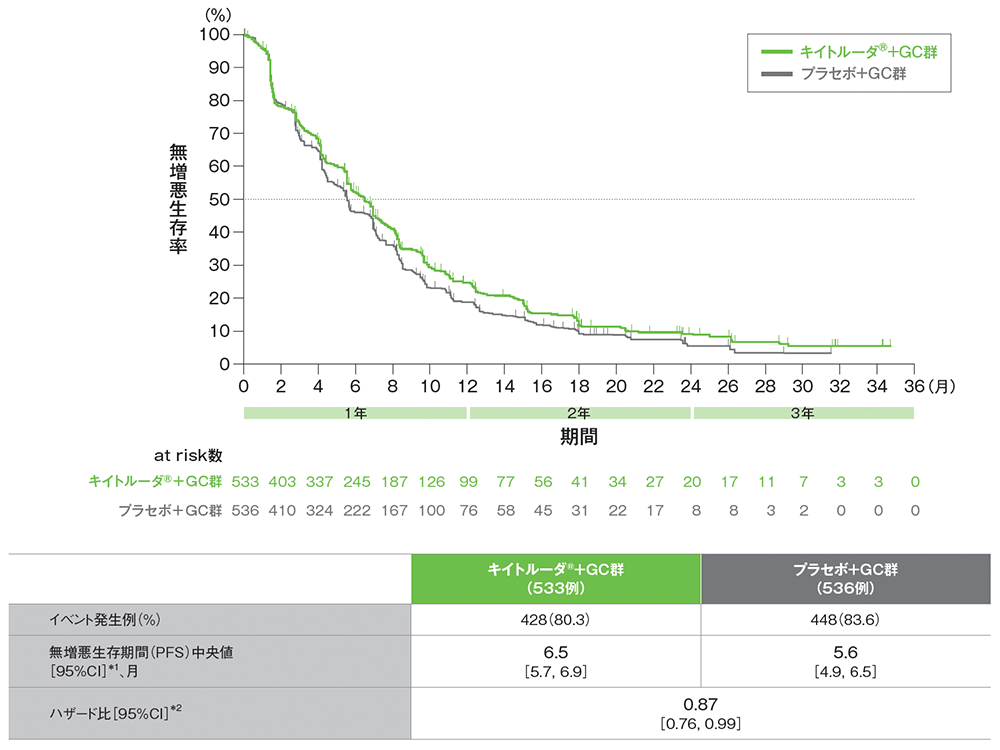
データカットオフ日:2022年12月15日[追跡期間中央値:25.6ヵ月(四分位範囲:21.7, 30.4)]
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群のみを共変量とし、地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(肝外、胆嚢、肝内)を層別因子(無作為化層別因子)とした層別Cox比例ハザードモデルに基づく
BICR:盲検下の独立判定委員会
■ORR
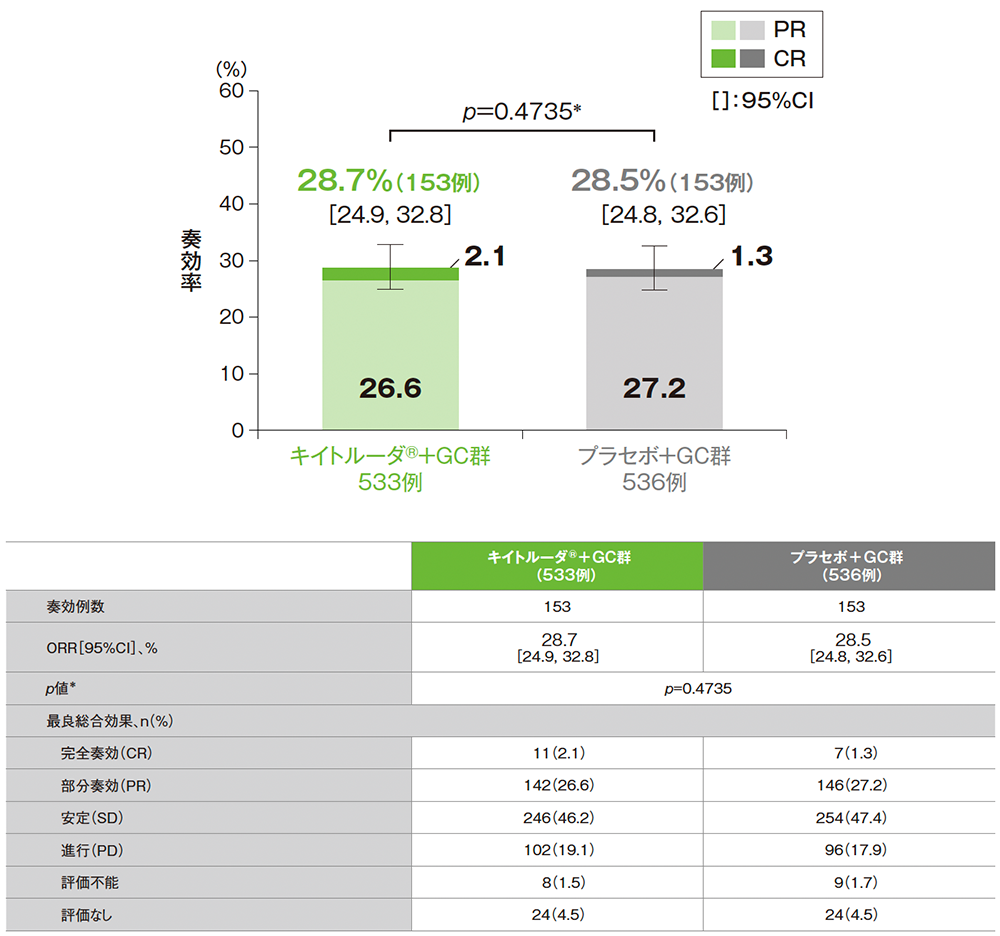
データカットオフ日:2021年12月15日[追跡期間中央値:13.6ヵ月(四分位範囲:9.7, 18.4)]
* 地域(アジア、アジア以外)、癌の状態(局所進行、転移性)、原発部位(肝外、胆嚢、肝内)を層別因子とした層別Miettinen and Nurminen法に基づく[片側]、α=0.0125
■ORR
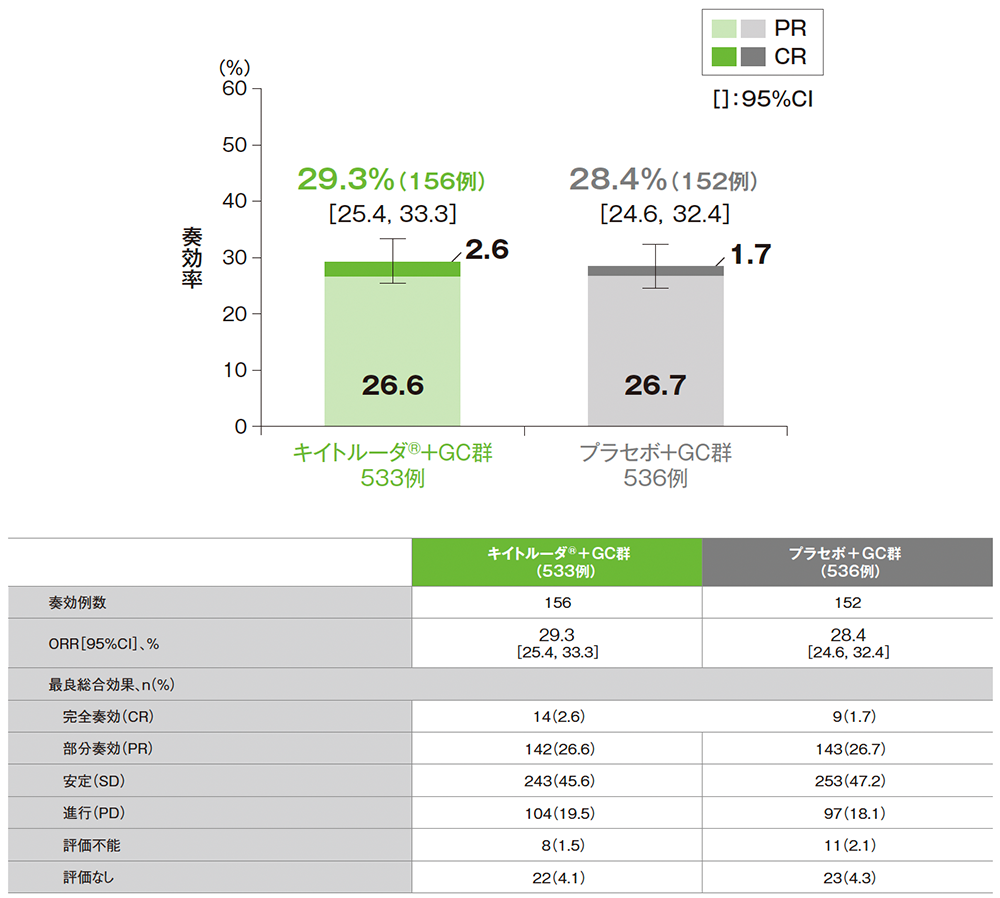
データカットオフ日:2022年12月15日[追跡期間中央値:25.6ヵ月(四分位範囲:21.7, 30.4)]
BICR:盲検下の独立判定委員会
■DORのKaplan-Meier曲線
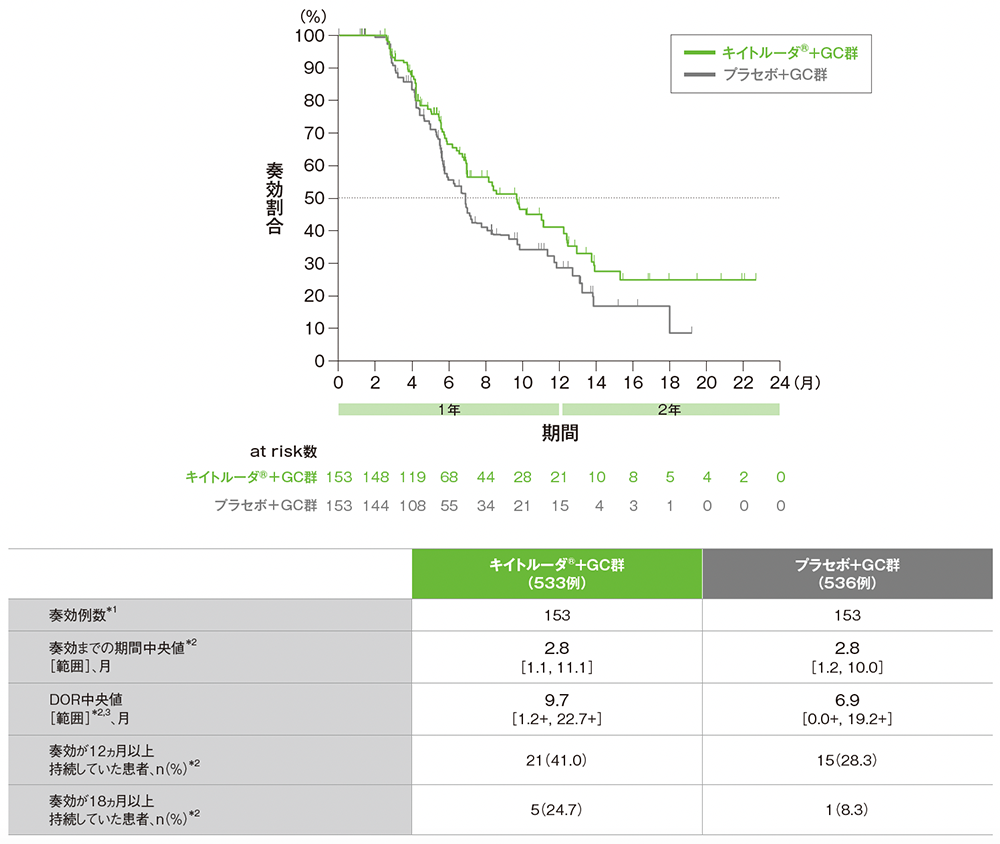
データカットオフ日:2021年12月15日[全体集団の追跡期間中央値:13.6ヵ月(四分位範囲:9.7, 18.4)]
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価までにPDがみられなかったことを示す
■DORのKaplan-Meier曲線
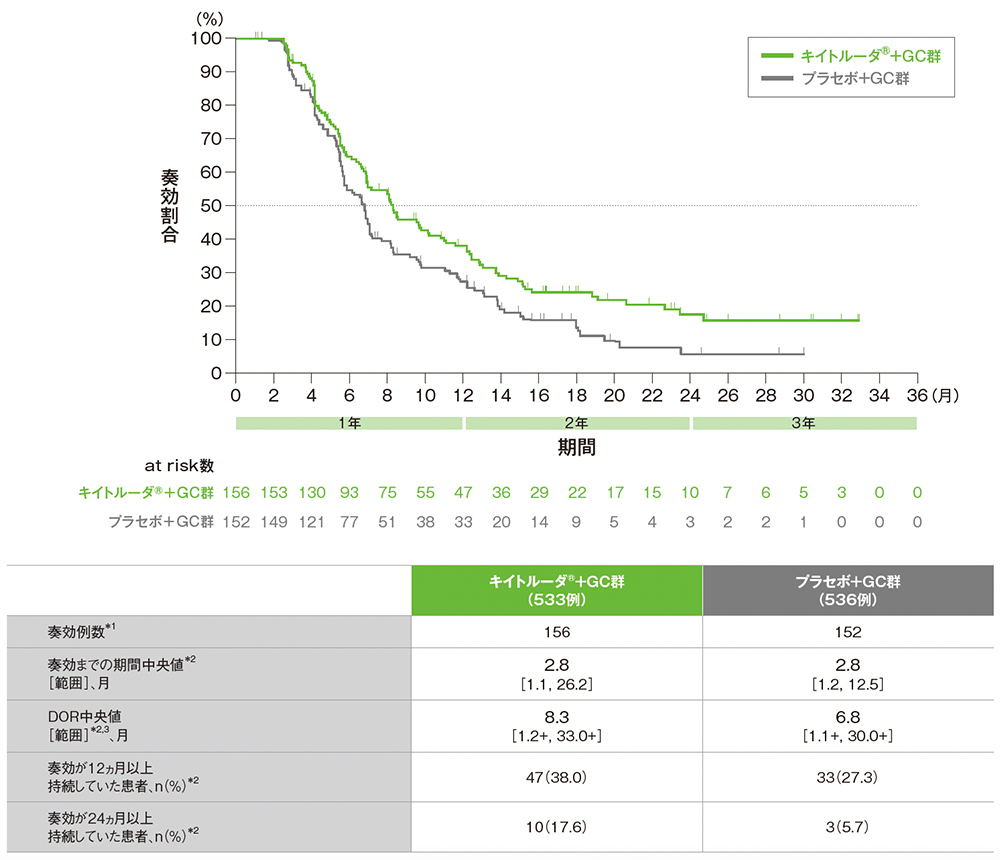
データカットオフ日:2022年12月15日[全体集団の追跡期間中央値:25.6ヵ月(範囲:21.7, 30.4)]
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価までにPDがみられなかったことを示す
■主な副作用
キイトルーダ®+GC群:529例中493例(93.2%) 内訳(発現割合20%以上):好中球数減少321例(60.7%)、貧血278例(52.6%)、血小板数減少199例(37.6%)、悪心195例(36.9%)、疲労154例(29.1%)、白血球数減少139例(26.3%)
プラセボ+GC群:534例中500例(93.6%) 内訳(発現割合20%以上):好中球数減少320例(59.9%)、貧血269例(50.4%)、悪心219例(41.0%)、血小板数減少197例(36.9%)、疲労147例(27.5%)、白血球数減少124例(23.2%)
■主なGrade 3以上の副作用
キイトルーダ®+GC群:529例中377例(71.3%) 内訳(発現割合5%以上):好中球数減少247例(46.7%)、貧血123例(23.3%)、血小板数減少85例(16.1%)、白血球数減少61例(11.5%)
プラセボ+GC群:534例中370例(69.3%) 内訳(発現割合5%以上):好中球数減少246例(46.1%)、貧血131例(24.5%)、血小板数減少99例(18.5%)、白血球数減少46例(8.6%)
■主な副作用一覧(いずれかの群で発現割合5%以上)
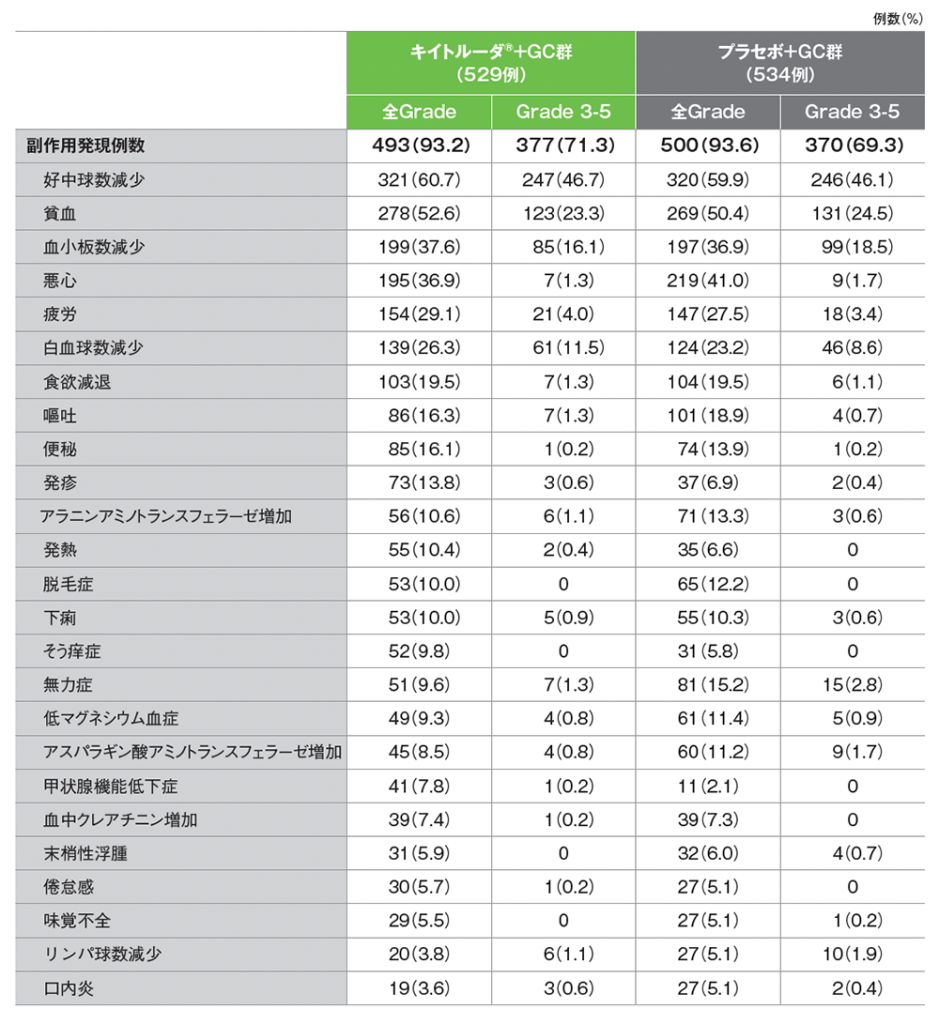
データカットオフ日:2022年12月15日
GradeはCTCAE v5.0、MedDRA v25.1
■重篤、投与中止及び死亡に至った副作用
● キイトルーダ®+GC群(529例)
重篤な副作用:121例(22.9%)
内訳(2例以上に発現):血小板数減少16例(3.0%)、好中球数減少11例(2.1%)、発熱9例(1.7%)、貧血、発熱性好中球減少症、肺臓炎 各7例(1.3%)、嘔吐5例(0.9%)、食欲減退4例(0.8%)、菌血症、胆管炎、免疫性肝炎、血栓性微小血管症 各3例(0.6%)、急性腎障害、アラニンアミノトランスフェラーゼ増加、大腸炎、下痢、腸炎、疲労、高カリウム血症、低カリウム血症、免疫性血小板減少症、骨髄抑制、悪心、膵炎、肺塞栓症、発疹、トランスアミナーゼ上昇 各2例(0.4%)
いずれかの薬剤の投与中止に至った副作用:102例(19.3%)
内訳(2例以上に発現):好中球数減少、血小板数減少 各19例(3.6%)、血中クレアチニン増加8例(1.5%)、肺臓炎7例(1.3%)、貧血5例(0.9%)、疲労4例(0.8%)、血栓性微小血管症、免疫性肝炎、急性腎障害 各3例(0.6%)、白血球減少症、腸炎、悪心、嘔吐、自己免疫性肝炎、腎機能障害、肺塞栓症 各2例(0.4%)
・キイトルーダ®の投与中止に至った副作用:47例(8.9%)
内訳(2例以上に発現):肺臓炎7例(1.3%)、血小板数減少5例(0.9%)、免疫性肝炎3例(0.6%)、自己免疫性肝炎、腸炎、肺塞栓症 各2例(0.4%)
・化学療法の投与中止に至った副作用:90例(17.0%)
内訳(2例以上に発現):好中球数減少19例(3.6%)、血小板数減少17例(3.2%)、血中クレアチニン増加8例(1.5%)、貧血、肺臓炎 各5例(0.9%)、疲労4例(0.8%)、急性腎障害、血栓性微小血管症 各3例(0.6%)、腸炎、自己免疫性肝炎、白血球減少症、悪心、嘔吐、肺塞栓症 各2例(0.4%)
死亡に至った副作用:8例(1.5%)
内訳:腹部膿瘍、心筋梗塞、胆管炎、下気道感染症、ウイルス性肺炎、敗血症性ショック、悪性新生物進行、肺臓炎 各1例(0.2%)
重篤な副作用:84例(15.7%)
内訳(2例以上に発現):血小板数減少10例(1.9%)、発熱性好中球減少症8例(1.5%)、貧血5例(0.9%)、免疫性肝炎、肺炎、急性腎障害 各4例(0.7%)、無力症3例(0.6%)、発熱、肺臓炎、嘔吐、胆管炎、アラニンアミノトランスフェラーゼ増加、大腸炎、疲労、悪心、敗血症、白血球数減少、慢性閉塞性肺疾患、呼吸困難、腎不全 各2例(0.4%)
いずれかの薬剤の投与中止に至った副作用:81例(15.2%)
内訳(2例以上に発現):好中球数減少15例(2.8%)、貧血、血中クレアチニン増加 各6例(1.1%)、無力症、免疫性肝炎、血小板数減少、急性腎障害 各4例(0.7%)、発熱性好中球減少症、疲労、末梢性感覚ニューロパチー、腎不全 各3例(0.6%)、末梢性ニューロパチー、呼吸困難、肺臓炎 各2例(0.4%)
・プラセボの投与中止に至った副作用:26例(4.9%)
内訳(2例以上に発現):免疫性肝炎4例(0.7%)、血中クレアチニン増加3例(0.6%)、肺臓炎2例(0.4%)
・化学療法の投与中止に至った副作用:73例(13.7%)
内訳(2例以上に発現):好中球数減少15例(2.8%)、血中クレアチニン増加、貧血 各6例(1.1%)、血小板数減少、急性腎障害、無力症 各4例(0.7%)、発熱性好中球減少症、疲労、腎不全、末梢性感覚ニューロパチー 各3例(0.6%)、肺臓炎、末梢性ニューロパチー、呼吸困難 各2例(0.4%)
死亡に至った副作用:3例(0.6%)
内訳:敗血症、肝腎症候群、上部消化管出血 各1例(0.2%)
データカットオフ日:2022年12月15日
GradeはCTCAE v5.0、MedDRA v25.1
免疫関連など特に注目すべき有害事象は、キイトルーダ®+GC群で117例(22.1%)、プラセボ+GC群で69例(12.9%)に認められました。キイトルーダ®+GC群の1例に肺臓炎による死亡が認められました。
■免疫関連など特に注目すべき有害事象一覧(いずれかの群で1例以上に発現、カテゴリー別で集計)
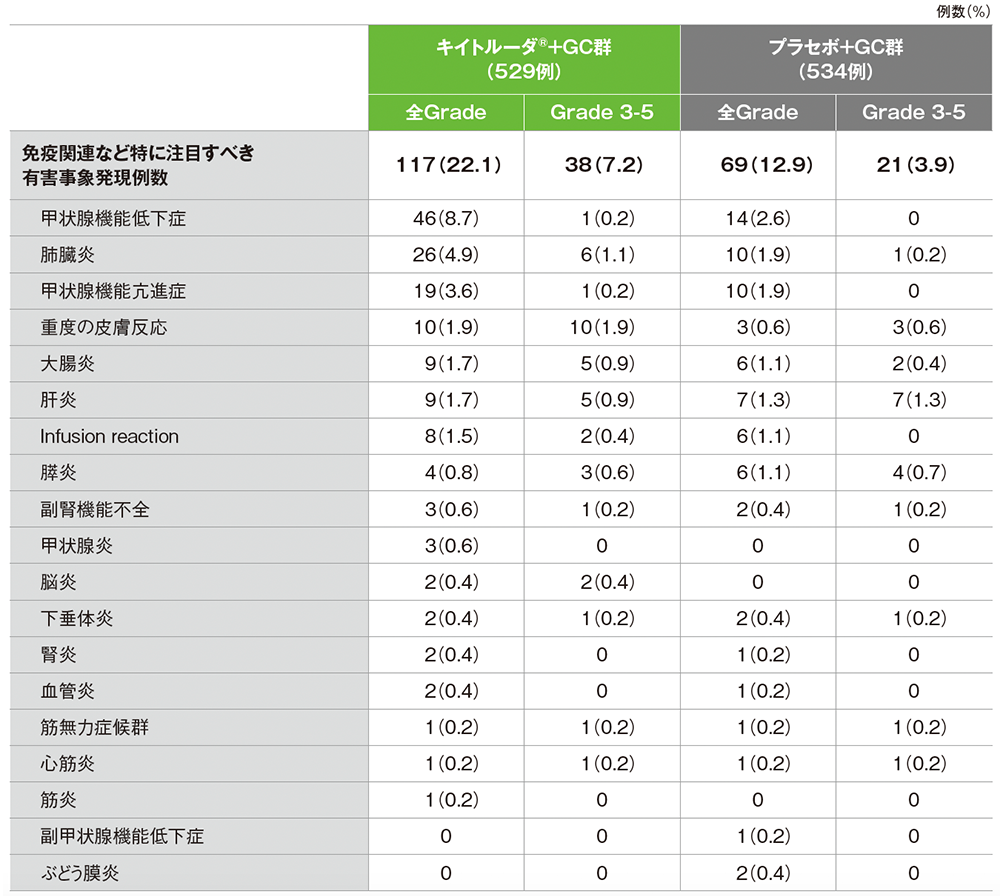
データカットオフ日:2022年12月15日
GradeはCTCAE v5.0、MedDRA v25.1

キイトルーダ® は2024年5⽉、「治癒切除不能な胆道癌」を効能⼜は効果として承認を取得いたしました。本動画では、治癒切除不能な胆道癌の1次治療において、キイト […]

2024年5⽉、キイトルーダ®+ゲムシタビン+シスプラチン併⽤療法が「治癒切除不能な胆道癌」に対して承認を取得しました。本動画では、適応追加のエビデンスとなった […]


WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?