シルガード®9(男性)
男性を対象とした臨床試験成績
肛門性器部※1のHPV持続感染予防効果および安全性
*:本試験では一部承認外の疾患の情報が含まれますが、承認時評価資料として評価されたため掲載いたします。
●第Ⅲ相無作為化プラセボ対照二重盲検試験(国内試験/検証的)の概要
承認時評価資料 国内第Ⅲ相試験(064試験)(社内資料)
| 【目 的】 | 日本人男性におけるシルガード®9の有効性、免疫原性および安全性をプラセボと比較して検討する。 |
| 【試験デザイン】 | 無作為化、二重盲検※2、プラセボ対照、多施設共同試験 |
| 【対 象】 | 16~26歳の日本人男性1,059例(性交渉経験がある被験者の割合は、シルガード®9群で99.6%、プラセボ群で99.8%) |
| 【方 法】 | シルガード®9またはプラセボを0、2、6ヵ月の3回接種し、有効性、免疫原性および安全性について検討した。 |
| 【評 価 項 目】 | 主要評価項目: ●有効性:HPV6/11/16/18型に関連した肛門性器部※1の6ヵ月以上の持続感染※3(検証的解析結果) ●安全性:有害事象 副次評価項目: ●有効性:HPV31/33/45/52/58型に関連した肛門性器部※1の6ヵ月以上の持続感染※3(検証的解析結果) 探索的評価項目: ●有効性:HPV6/11/16/18/31/33/45/52/58型に関連した肛門性器部※1の6ヵ月以上の持続感染※3 |
| 【解 析 計 画】 | 本試験はベース試験および延長試験で構成される。有効性の主要評価項目および副次評価項目のイベント数がそれぞれ17件以上認められた時点でベース試験を終了し、有効性の主要解析を行った。 有効性の主たる解析はPer-Protocol Efficacy(PPE)解析対象集団で実施した。PPE解析対象集団は、有効性の評価に影響を与えるような治験実施計画書からの重大な逸脱がなく、3回のワクチン接種を1年以内にすべて受け、該当するHPV型に対して1日目に血清抗体反応陰性かつ1日目から7ヵ月目までPCR陰性を示した被験者で構成された。 予防効果={1-(シルガード®9群のイベント発生数/シルガード®9群の追跡期間)/(プラセボ群のイベント発生数/プラセボ群の追跡期間)}×100(%)ワクチンの予防効果が0%を超えるという仮説に対して、二項分布に基づく正確法を用いて、95%信頼区間および仮説検定のp値を計算した。統計学的な成功基準は両側95%信頼区間の下限が0%を上回ることとした。有効性の主要および副次仮説の検定に対する全体の有意水準が、片側2.5%を超えないよう固定順序法を用いて第一種の過誤の確率を制御した(主要仮説および副次仮説:有意水準α=0.025)。副次仮説は主要仮説が成立した場合のみ検証した。 安全性はAll participants as treated(APaT)集団で解析を実施した。 APaT集団は1回以上の治験薬接種を受け、治験中の安全性データが得られたすべての被験者で構成された。接種後1~5日目に発現した事前に規定した注射部位の有害事象※4(発赤/紅斑、腫脹、圧痛/疼痛)、その他の注射部位の有害事象※4 、接種後1~15日目に発現した注射部位以外の有害事象、全治験期間中の死亡、重篤な有害事象および新たな医学的事象を要約した。 |
※1:肛門内および性器周辺部
※2:すべての被験者は、有効性の主要解析を目的とした初回データ固定の後、盲検解除された。
※3:6ヵ月以上の間隔(最短間隔4ヵ月、来院ごとの許容範囲±1ヵ月)を空けて採取された連続する2回以上のPCR用の性器スワブ(陰茎、陰茎亀頭、陰嚢 、肛門周囲及び会陰)および肛門内スワブまたは生検検体において、指定のHPV型のうち、いずれかの同一HPV型の共通遺伝子に対しPCR検査で陽性となった場合、または、病理審査委員会により尖圭コンジローマ、PIN*、陰茎癌*、肛門癌、会陰の癌*と診断され、その生検組織と同じHPV型がThinsection PCRで検出され、かつその直前または直後の来院時に採取された検体においても同一のHPV型の1つ以上の共通遺伝子に対しPCR陽性であった場合。
※4:すべての注射部位の有害事象は、治験薬との因果関係のある有害事象(副反応)として扱った。
注)本ページ作成時点においては、本試験の延長試験が進行中です。本ページでは、ベース試験の結果について記載しました。
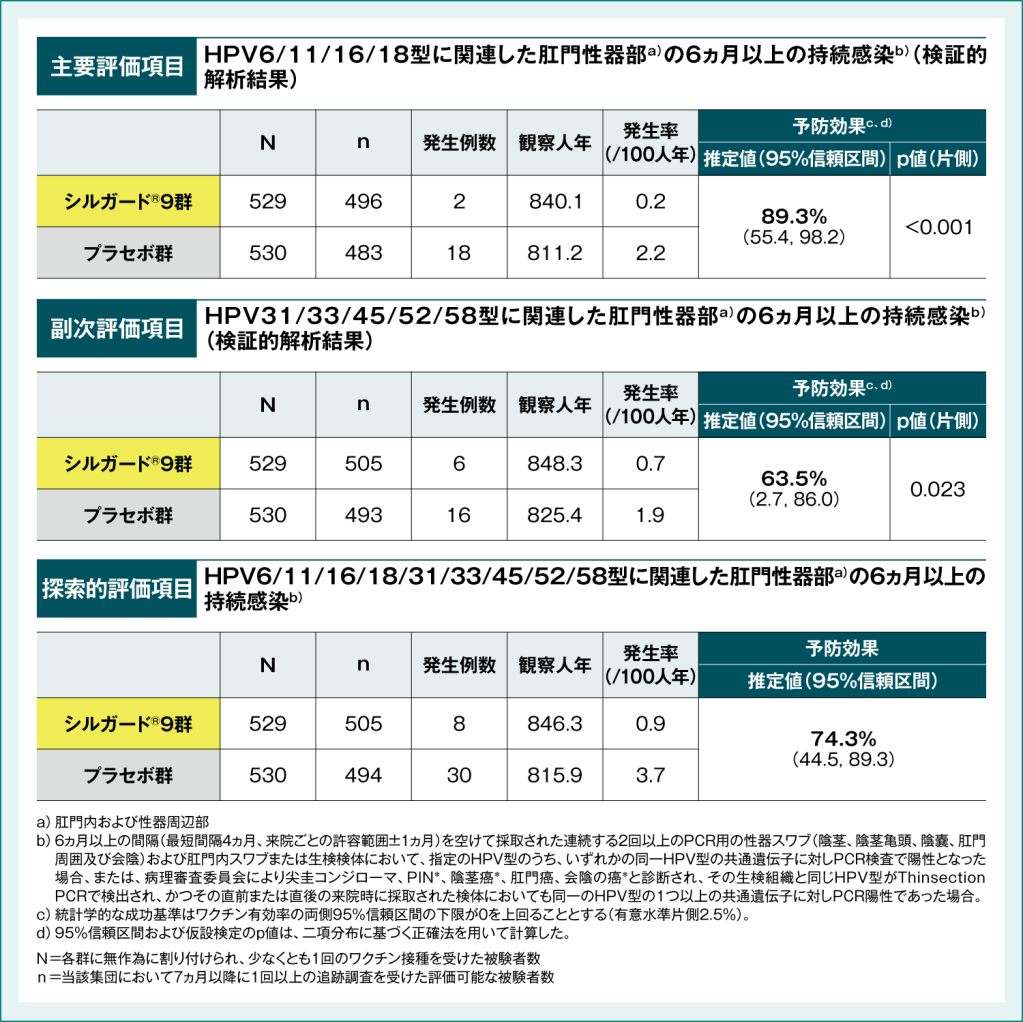
●国内第Ⅲ相無作為化プラセボ対照二重盲検試験(064試験)におけるシルガード®9の予防効果(主要評価項目/副次評価項目/探索的評価項目)
HPV6/11/16/18型に関連した肛門性器部※の持続感染に対する予防効果は89.3%(95%信頼区間:55.4, 98.2、P<0.001)、HPV31/33/45/52/58型に関連した肛門性器部※の持続感染に対する予防効果は63.5%(95%信頼区間:2.7, 86.0、P=0.023)であり、主要評価項目および副次評価項目においてシルガード®9群のプラセボ群に対する優越性が検証されました†。
※:肛門内および性器周辺部
†:統計学的な成功基準はワクチン有効率の両側95%信頼区間の下限が0を上回ることとする(有意水準片側2.5%) 。
表1:国内第Ⅲ相無作為化プラセボ対照二重盲検試験(064試験)におけるシルガード®9の予防効果
4. 効能又は効果
ヒトパピローマウイルス6、11、16、18、31、33、45、52及び58型の感染に起因する以下の疾患の予防
○ 子宮頸癌(扁平上皮癌及び腺癌)及びその前駆病変(子宮頸部上皮内腫瘍(CIN)1、2及び3並びに上皮内腺癌(AIS))
○ 外陰上皮内腫瘍(VIN)1、2及び3並びに腟上皮内腫瘍(VaIN)1、2及び3
○ 肛門癌(扁平上皮癌)及びその前駆病変(肛門上皮内腫瘍(AIN)1、2及び3)
○ 尖圭コンジローマ
シルガード®9の安全性[有害事象](主要評価項目)
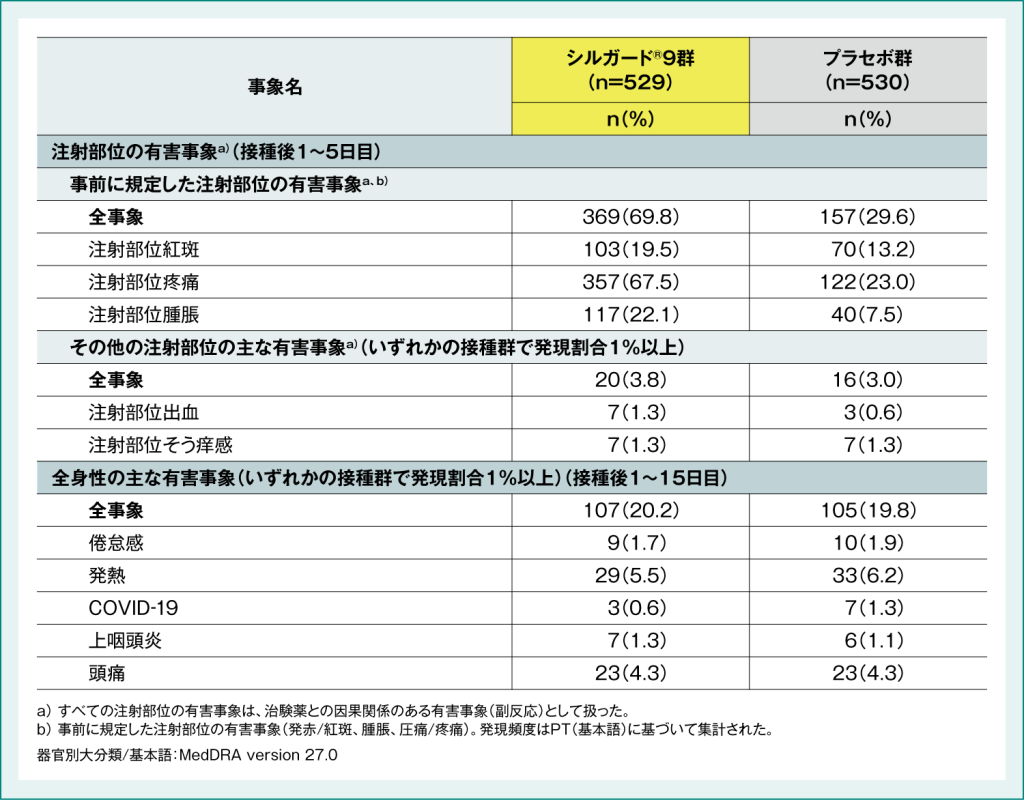
●国内第Ⅲ相無作為化プラセボ対照二重盲検試験(064試験)における有害事象
接種後5日間の事前に規定した注射部位の有害事象a、b)は、シルガード®9群で529例中369例(69.8%)、プラセボ群で530例中157例(29.6%)、接種後15日間の全身性の有害事象はシルガード®9群で529例中107例(20.2%)に、プラセボ群で530例中105例(19.8%)に認められました。死亡や投与中止に至った有害事象はいずれの群においても認められませんでした。接種後15日間の重篤な有害事象はシルガード®9群で7例(虫垂炎、COVID-19、脳挫傷、慢性扁桃炎、気胸、潰瘍性大腸炎、カンピロバクター胃腸炎)、プラセボ群で5例(腱断裂および処置後感染、虫垂炎および腹膜炎、COVID-19、橈骨骨折、肛門性器疣贅)に認められましたが、いずれの事象も治験薬との因果関係は否定されました。
表2:国内第Ⅲ相無作為化プラセボ対照二重盲検試験(064試験)における有害事象発現頻度
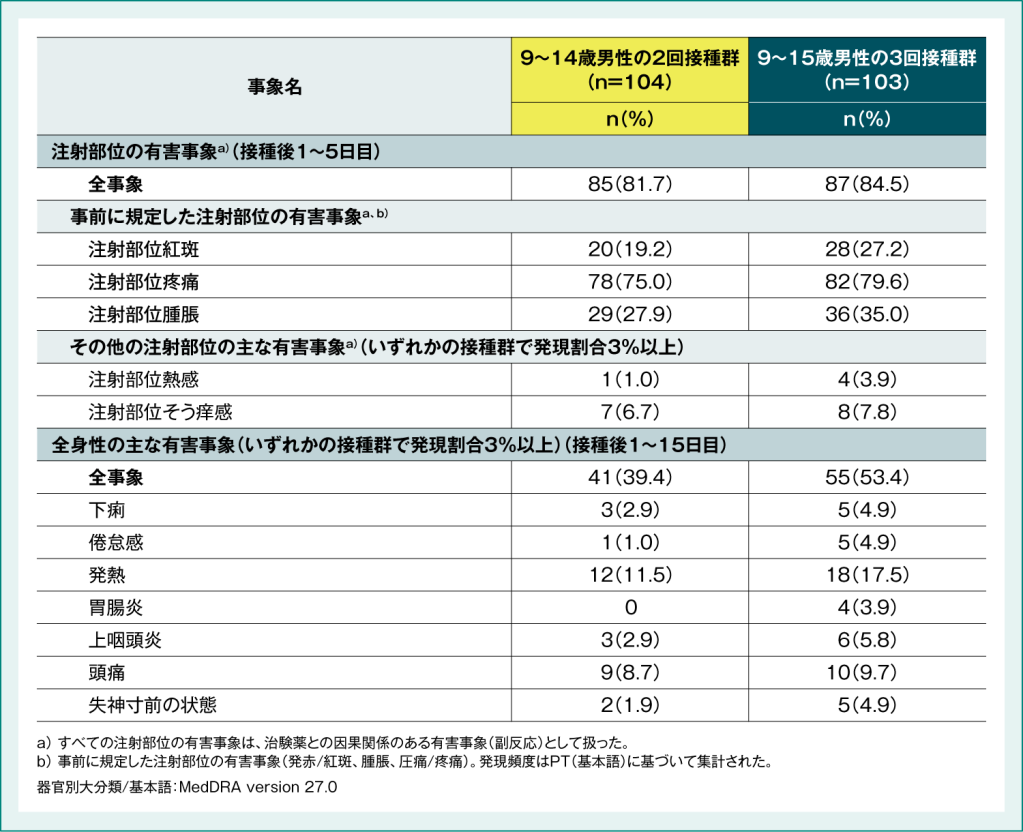
9~14歳日本人男性の2回接種および9~15歳日本人男性の3回接種における免疫原性と安全性
●第Ⅲ相非盲検並行群間多施設共同試験(国内試験)の概要
承認時評価資料 国内第Ⅲ相試験(066試験)(社内資料)
| 【目 的】 | シルガード®9の異なる接種レジメン(9~14歳の日本人男女に対する2回接種、9~15歳の日本人男性に対する3回接種)における免疫原性および安全性を検討する。 |
| 【試験デザイン】 | 非盲検、並行群間、多施設共同試験 |
| 【対 象】 | 9~15歳の日本人男女314例(9~14歳男性の2回接種群:104例、9~14歳女性の2回接種群:105例、9~15歳男性の3回接種群:105例) |
| 【方 法】 | シルガード®9を9~14歳男女には0、6ヵ月の2回接種、9~15歳男性には0、2、6ヵ月の3回接種し、最長30ヵ月まで観察した。 |
| 【評 価 項 目】 | 主要評価項目: ●免疫原性:シルガード®9の2回接種後(最終接種1ヵ月後)のHPV6/11/16/18/31/33/45/52/58型に対する抗体陽転率 シルガード®9の3回接種後(最終接種1ヵ月後)のHPV6/11/16/18/31/33/45/52/58型に対する抗体陽転率 ●安全性:有害事象 |
| 【解 析 計 画】 | 本試験は2期で構成され、第Ⅰ期ではシルガード®9の最終接種1ヵ月後(初回接種から7ヵ月後)までの免疫原性および安全性/忍容性を評価し、第Ⅱ期では最終接種1ヵ月後から最終接種24ヵ月後(初回接種から30ヵ月後)までの長期免疫原性および安全性を評価した。 免疫原性の解析はPer-Protocol Immunogenicity(PPI)解析対象集団で実施した。PPI解析対象集団は、事前に規定した期間内にシルガード®9の必要な回数の接種をすべて受け、最終接種から21~49日以内に評価可能な血清検体の検査結果が得られ、治験実施計画書からの重大な逸脱がなく、また該当する各HPV型に対して、初回接種前に血清反応陰性であった被験者で構成された。 抗体陽転率は、最終接種1ヵ月後に評価可能な血清抗体価の結果が閾値以上となった被験者の割合を計算し、抗体陽転率の点推定値および95%信頼区間を接種群ごとに算出した。95%信頼区間の計算には、Clopper and Pearson(1934)による二項分布に基づく正確法を用いた。 安全性はAll participants as treated(APaT)集団で解析を実施した。APaT集団は1回以上の治験薬接種を受け、治験中の安全性データが得られたすべての被験者で構成された。接種後1~5日目に発現した事前に規定した注射部位の有害事象※1(発赤/紅斑、腫脹、圧痛/疼痛)、その他の注射部位の有害事象※1、接種後1~15日目に発現した注射部位以外の有害事象、全治験期間中の死亡、重篤な有害事象および新たな医学的事象を要約した。 |
※1:すべての注射部位の有害事象は、治験薬との因果関係のある有害事象(副反応)として扱った。
注)本試験は、9~15歳の日本人男性、9~14歳の日本人女性を対象とした試験ですが、本資材では、9~14歳男性のシルガード®9の2回接種および9~15歳男性のシルガード®9の3回接種の結果について記載しています。
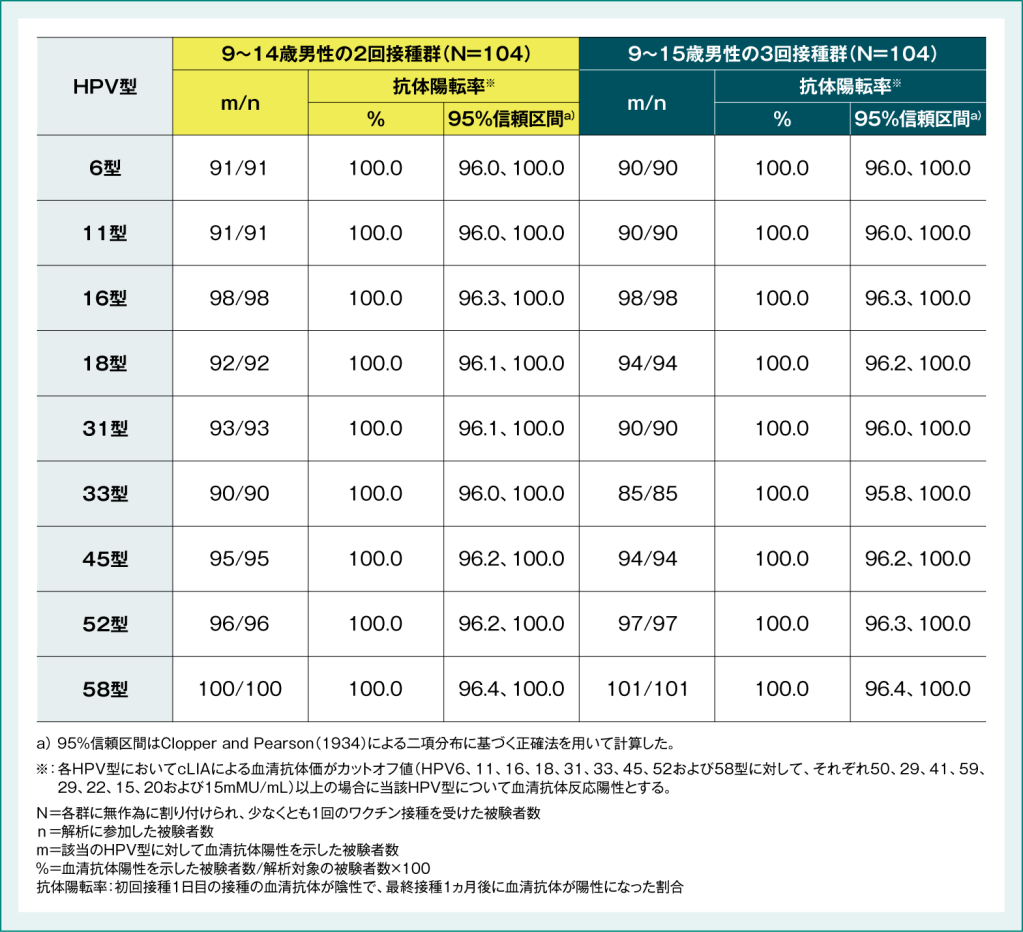
●国内第Ⅲ相試験(066試験)における免疫原性(主要評価項目)
9~14歳男性の2回接種群の最終接種後1ヵ月後の各HPV型に対する抗体陽転率は、 9~15歳男性の3回接種群と同様に、いずれも100%でした。
表3:国内第Ⅲ相試験(066試験)における各HPV型(6/11/16/18/31/33/45/52/58)型に対する抗体陽転率
●国内第Ⅲ相無作為化プラセボ対照二重盲検試験(066試験)における安全性[有害事象](主要評価項目)
接種後5日間の注射部位の有害事象a)は9~14歳男性の2回接種群で104例中85例(81.7%)、9~15歳男性の3回接種群で103例中87例(84.5%)、接種後15日間の全身性の有害事象は、 9~14歳男性の2回接種群で104例中41例(39.4%)、9~15歳男性の3回接種群で103例中55例(53.4%)に認められました。死亡や投与中止に至った有害事象はいずれの群においても認められませんでした。接種後15日間の重篤な有害事象は9~14歳男性の2回接種群で2例(鼓膜穿孔、食物依存性運動誘発アナフィラキシー反応)に認められましたが、いずれの事象も治験薬との因果関係は否定されました。9~15歳男性の3回接種群では接種後15日間の重篤な有害事象は認められませんでした。
表4:国内第Ⅲ相試験(066試験)における有害事象の発現頻度