製品基本Q&A
製品基本Q&A
エスラックス®(ロクロニウム臭化物)
製品情報
本剤の電子添文には、下記のとおり記載されています。
4. 効能又は効果
麻酔時の筋弛緩、気管挿管時の筋弛緩
<引用>
電子添文
本剤の電子添文には、下記のとおり記載されています。
18. 薬効薬理
18.1 作用機序
ロクロニウム臭化物は神経筋接合部のニコチン性アセチルコリン受容体のアンタゴニストとして作用することにより、筋弛緩作用を示すことが認められている。
18.1.1 摘出ニワトリヒナの神経筋標本において、ロクロニウム臭化物は多重神経支配を受けている筋線維の収縮を引き起こさず、間接刺激による筋収縮を抑制した。
18.1.2 麻酔下のネコ及びブタを用いた試験において、ロクロニウム臭化物は筋束の不随収縮を引き起こさず、筋収縮の抑制時にはテタヌス減衰またはTOF(四連)刺激による減衰を示した。またネオスチグミンはロクロニウム臭化物による筋収縮の抑制を拮抗した。
<引用>
電子添文
使用方法
本剤の電子添文には、下記のとおり記載されています。
6.用法及び用量
通常、成人には挿管用量としてロクロニウム臭化物0.6mg/kgを静脈内投与し、術中必要に応じて0.1〜0.2mg/kgを追加投与する。持続注入により投与する場合は、7μg/kg/分の投与速度で持続注入を開始する。なお、年齢、症状に応じて適宜増減するが、挿管用量の上限は 0.9mg/kgまでとする。
7. 用法及び用量に関連する注意
7.1 作用持続時間は用量に依存して長くなるため、本剤0.9mg/kgを挿管用量として投与する際は注意すること。
7.2 持続注入により投与する場合は、筋弛緩モニタリング装置を用いて適切に注入速度を調節すること。
<引用>
電子添文
本剤の電子添文には、下記のとおり記載されています。
9.特定の背景を有する患者に関する注意
9.8 高齢者
本剤の排泄が遅れるため作用が遷延することがあります。
患者の状態を観察しながら、挿管用量を 0.6mg/kg として慎重に投与すること。また、術中必要に応じて追加投与する場合は、挿管用量での作用持続時間を考慮の上、用量を決定すること。本剤 0.6mg /kgを投与したとき、高齢者では非高齢者と比較してクリアランスが約16%(高齢者:3.45mL/min/kg、非高齢者:4.11mL/min/kg)低下し、高齢者の作用持続時間は非高齢者と比較して約1.5倍(高齢者:42.4分、非高齢者:27.5分)延長した。
16.6 特定の背景を有する患者
16.6.2. 高齢者
本剤0.6mg/kgを投与したとき、高齢者では非高齢者と比較してクリアランスが約16%(高齢者:3.45mL/min/kg、非高齢者:4.11mL/min/kg)低下した。
<引用>
電子添文
本剤の電子添文には、下記のとおり記載されています。
9.特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)で乳汁中に移行することが報告されている。
<引用>
電子添文
本剤の電子添文には、下記のとおり記載されています。
13.過量投与
13.1 症状
筋弛緩作用が遷延することがある。
13.2 処置
自発呼吸が回復するまで呼吸管理を行うこと。また、筋弛緩モニターを必要に応じて行うこと。
<引用>
電子添文
筋弛緩モニタリングをせずに、エスラックス®追加のタイミングをはかるのは困難です。
エスラックス®をご使用の際には筋弛緩モニターで筋弛緩状態の確認をお願いします。
緊急時のブリディオン®(16mg/kg)でリバース後、再手術のためにエスラックス®が投与された報告がなく、明確にはわかりません。
ブリディオン®分子とエスラックス®分子は1:1で包接しますので、体内に残存している非包接体のブリディオン®の量により、再手術で必要なエスラックス®の量は異なります。
リバース後の再手術時には筋弛緩モニターで筋弛緩状態を確認しながらエスラックス®を投与してください。
本剤の電子添文には下記のとおり記載されています。
エスラックス®の効果を遷延する因子としては、心拍出量低下、高齢、肝機能障害及び腎機能障害、低体温、併用薬剤、肥満などが知られています。
<引用>
電子添文
筋肉量や体脂肪量による影響を検討した報告はみあたりません。
エスラックス®の用法及び用量は、正常体重患者を想定した体重換算投与量で設定しており、BMIに基づいた投与量は設定しておりません。
エスラックス®に対する各筋肉の反応性は、喉頭筋<横隔膜<皺眉筋<眼輪筋<拇指内転筋の順番で強くなると報告されています(1)。また咬筋やオトガイ舌筋は拇指内転筋よりも反応性は強いと報告されています(2)(3)。
<引用>
(1)Hemmerling TM et al. Br J Anaesth. 2000;85:856-860.
(2)Vega EA et al. Acta Anaesth Scand. 2016;60:734–746.
(3)Eikermann M et al. Am J Respir Crit Care Med. 2007;175:9–15.
安全性
本剤の電子添文には下記のとおり記載されています。
11. 副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 ショック、アナフィラキシー(頻度不明)
ショック、アナフィラキシー(気道内圧上昇、血圧低下、頻脈、全身発赤等)を起こすことがある。
11.1.2 遷延性呼吸抑制(頻度不明)
11.1.3 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.1.4 気管支痙攣(頻度不明)
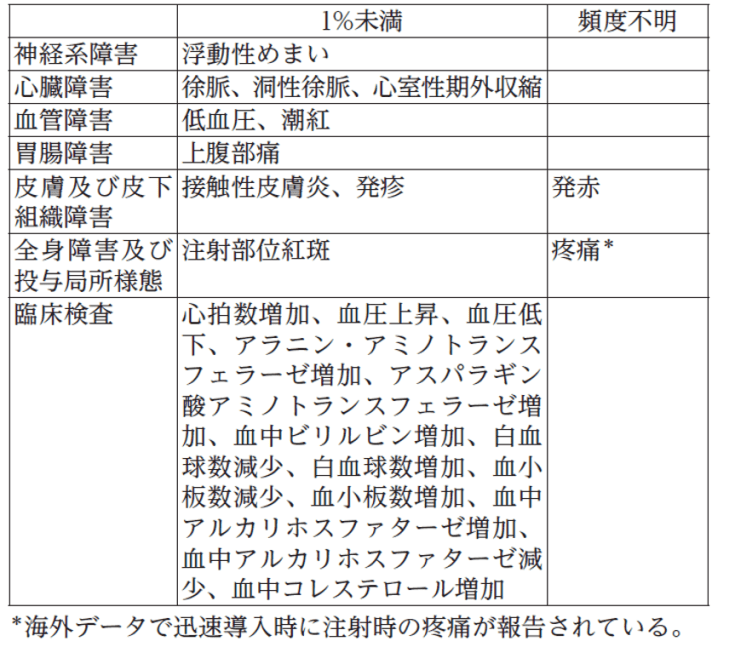
11.2 その他の副作用
<引用>
電子添文
本剤の電子添文には下記のとおり記載されています。
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分又は臭化物に対して過敏症の既往歴のある患者
本剤を使用しない麻酔方法をご検討いただくようお願いします。
<引用>
電子添文
特別な対処法はありません。
また、漏出部位の壊死等の副作用報告はありません。
なお、皮下投与した場合の薬物動態パラメータを検討した報告はなく、作用発現時間や作用持続時間は不明ですが、皮下に漏出した場合は、作用発現時間の遅延や作用持続時間の遷延がある可能性があります。抜管時には、筋弛緩モニターで十分回復したことを確認していただくようお願いします。
ベクロニウムと交差反応を示した報告(1)があります。
<引用>
(1)Ebo DG et al. Allergy. 2006;61(8):935-9.
その他
本剤の電子添文には、下記のとおり記載されています。
14. 適用上の注意
14.1 薬剤投与時の注意
アムホテリシン、エリスロマイシンラクトビオン酸塩、クロキサシリン、ヒドロコルチゾンコハク酸エステルナトリウム、メチルプレドニゾロンコハク酸エステル、セファゾリン、チアミラールナトリウム、チオペンタールナトリウム、デキサメタゾン、ドパミン塩酸塩、バンコマイシン、フロセミドと混合すると沈殿を生じるので、別々の投与経路で使用するか、又は同一点滴回路を使用する場合は回路内を生理食塩水等の中性溶液を用いて洗浄するなど混合しないようにすること。
<引用>
電子添文
本剤の電子添文には、下記のとおり記載されています。
貯法:2~8℃で保存する
有効期間:3年
20. 取扱い上の注意
バイアルを開封後は速やかに使用すること。
<引用>
電子添文
フィルターの透過性(通過性)データはありません。