Drug Information
Drug Information
2. 禁忌(次の患者には投与しないこと)
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 本剤の投与開始前の血小板数が50,000/mm3未満の患者[9.1.2参照]
4. 効能又は効果
肺動脈性肺高血圧症
5. 効能又は効果に関連する注意
5.1 本剤は肺血管拡張薬による治療を受けている患者に適用を考慮すること。
5.2 本剤の使用にあたっては、「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(前治療、併用薬等)を十分に理解した上で、最新の治療ガイドライン等を参考に投与の要否を検討すること。[17.1.1、17.1.2参照]
5.3 肺動脈性肺高血圧症の治療に関する十分な知識及び経験を有する医師のもとで、本剤の投与が適切と判断される患者のみに使用すること。
5.4 WHO機能分類クラスⅠ及びⅣにおける有効性及び安全性は確立していない。
6. 用法及び用量
通常、成人にはソタテルセプト(遺伝子組換え)として初回に0.3mg/kgを投与し、2回目以降は0.7mg/kgに増量し、3週間ごとに皮下投与する。
7. 用法及び用量に関連する注意
7.1 本剤の投与開始前及び投与中はヘモグロビン値及び血小板数を測定すること。少なくとも、本剤の投与5回目まで並びにその後もヘモグロビン値及び血小板数が安定するまでの間は、各投与前にヘモグロビン値及び血小板数を測定すること。それ以降も本剤投与中は定期的にヘモグロビン値及び血小板数を測定すること。
7.2 本剤の投与中は、下記7.3を参照の上、増量、維持又は投与の延期を行うこと。用量調整の必要性がない限り、維持用量(0.7mg/kg)を継続すること。
7.3 次のいずれかに該当する場合は、本剤の投与を3週間延期すること。
・ヘモグロビン値の増加が前回の投与時から2.0 g/dLを超え、かつ基準値上限(ULN)を上回る。
・ヘモグロビン値の増加がベースライン値から4.0 g/dLを超える。
・ヘモグロビン値がULNより2.0 g/dLを超える値に増加する。
・血小板数が50,000/mm3未満に減少する。
7.4 血小板数が50,000/mm3未満に減少後に本剤の投与を再開する場合及び前回投与からの投与間隔が9週間を超える場合、初回用量(0.3mg/kg)から投与を再開すること。
8. 重要な基本的注意
8.1 本剤投与によるヘモグロビン増加及び血小板減少症が認められている。本剤投与中は、定期的にヘモグロビン値及び血小板数を確認し、患者の状態をモニタリングすること。
8.2 肺血行動態の明らかな悪化が認められていないにもかかわらず、原因不明の低酸素症の発現や悪化が認められた場合には、肺内右左シャントの可能性も考慮し、コントラスト心エコー検査等による原因精査を考慮する等、適切に対応すること。[15.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 赤血球増加症の患者
血栓塞栓症又は過粘稠度症候群の発現リスクが高まるおそれがある。[11.1.3参照]
9.1.2 出血傾向並びにその素因のある患者[血小板凝集抑制作用を有する薬剤若しくは抗凝固薬を投与している患者又は血小板数が低値の患者(投与開始前の血小板数が50,000/mm3未満の患者を除く)]
出血のリスクが高まるおそれがある。[2.2、11.1.1、15.1.1参照]
9.4 生殖能を有する者
妊娠する可能性のある女性には、本剤投与中及び最終投与後4ヵ月間において避妊する必要性及び適切な避妊法について説明すること。生殖可能な年齢の患者には、本剤投与による受胎能への潜在的リスクについて説明すること。動物実験において、雌ラットでは、ヒトの9倍以上の曝露量で妊娠率が低下し、着床前後の胚損失率の増加及び同腹児数の減少がみられた。また、21倍の曝露量では、性周期の延長がみられた。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、投与しないことが望ましい。本剤を投与する場合は、胎児への潜在的リスクについて説明すること。動物実験において、妊娠ラット及びウサギにそれぞれヒトの4倍及び0.6倍以上の曝露量に相当する用量で投与したとき、胎児体重の減少、骨化遅延、並びに吸収胚数及び着床後胚損失率の増加がみられた。ラットでは、15倍の曝露量で、胎児に骨格変異(過剰肋骨数の増加及び胸椎又は腰椎数の変化)の増加が認められた。[9.4参照]
9.6 授乳婦
本剤投与中及び最終投与後4ヵ月間は授乳を避けさせること。本剤のヒト乳汁中への移行は検討されていないが、ヒトの2倍以上の曝露量に相当する用量で授乳期間中に母ラットにソタテルセプトを投与したとき、授乳中の児において体重減少及び性成熟の遅延がみられたことから、本剤の乳汁移行が示唆されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。幼若ラットを用いた反復投与試験において、成熟ラットと比較してソタテルセプトの毒性の増強が生後7~91日に認められたことから、本剤投与により小児における臓器発達(副腎、腎臓及び雄性生殖器)に影響が認められる可能性がある。
11. 副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1 重大な副作用
11.1.1 出血(頻度不明)
後腹膜血腫、胃腸出血等の重篤な出血があらわれることがある。[9.1.2、15.1.1参照]
11.1.2 血小板減少症(4.3%)、血小板数減少(1.0%)
11.1.3 ヘモグロビン増加(9.1%)、赤血球増加症(1.4%)、ヘマトクリット増加(0.5%)
[9.1.1参照]
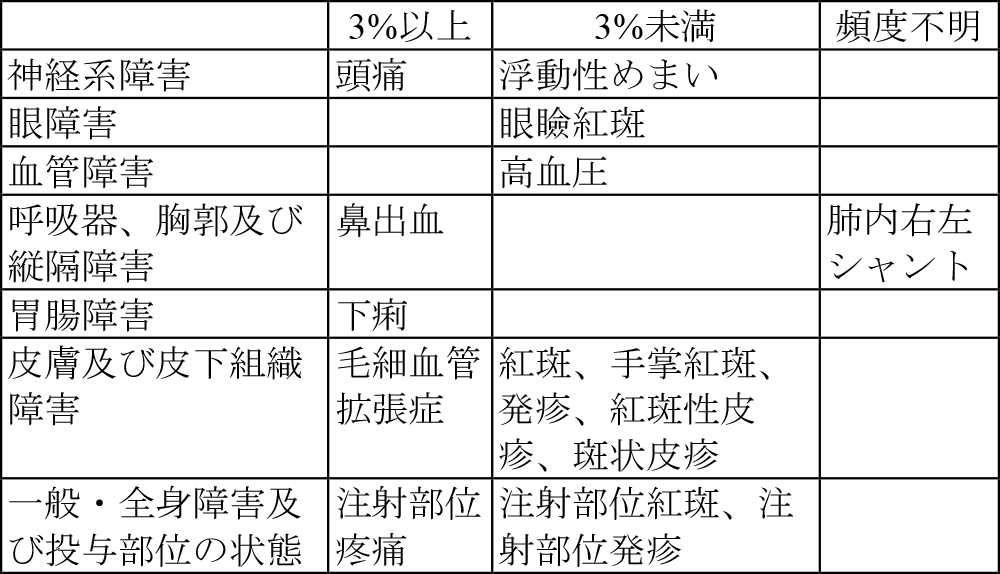
11.2 その他の副作用
13. 過量投与
13.1 処置
本剤は血液透析により体内から除去されない。[16.6.1参照]
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 冷蔵庫からバイアルを取り出し、約15分間放置して室温に戻してから調製すること。
14.1.2 本剤の性状が白色の塊又は粉末であるかを確認し、異常を認めた場合は使用しないこと。
14.1.3 注射用水で本剤を溶解する。45 mgの場合、1バイアル当たり1.0 mLの注射用水を注入する。60 mgの場合、1バイアル当たり1.3 mLの注射用水を注入する。最終濃度は50 mg/mLとなる。

14.1.4 バイアルは緩やかに渦を描くように回して本剤を溶解する。振盪したり激しく撹拌したりしないこと。
14.1.5 気泡が消失するまでバイアルを最大3分間放置する。バイアルの縁の周りに発生したわずかな泡沫(小さな気泡)は問題がない。
14.1.6 溶解後の液は大きな気泡がなく、澄明~乳白光を呈する、無色~微黄褐色であり、塊や粉末がないことを目視で確認すること。
14.1.7 溶解後は速やかに使用すること。すぐに使用できない場合は室温で保管し、4時間以上経過したものは廃棄すること。
14.2 薬剤投与時の注意
注射部位は、腹部(臍から5 cm以上離すこと)、大腿上部、又は上腕部とし、瘢痕、圧痛又は挫傷のある部位を避けること。投与ごとに注射部位を変更して皮下注射する。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外第Ⅲ相試験(003試験)では、重篤な出血関連の有害事象(胃腸出血、頭蓋内出血等)が本剤群で4%、プラセボ群で1%と報告された。また、重篤な出血事象が発現した患者では、プロスタサイクリン製剤による基礎療法若しくは抗血栓薬を使用している患者又は血小板数が低値である患者の割合が高かった。[9.1.2参照]
15.1.2 海外第Ⅲ相試験(003試験)において、24週間の治療期間に本剤を投与した163例中44例(27%)でソタテルセプトに対する抗薬物抗体の発現が認められた。このうち12例(27%)でソタテルセプトに対する中和抗体も陽性であった。また、国内第Ⅲ相試験(020試験)において、24週間の治療期間に本剤を投与した46例中18例(39%)でソタテルセプトに対する抗薬物抗体の発現が認められた。このうち6例(33%)でソタテルセプトに対する中和抗体も陽性であった。しかしながら、これら試験において、24週間の治療期間にわたって、抗薬物抗体により、ソタテルセプトの薬物動態、薬力学、安全性及び有効性に関し、特定された臨床的な影響はなかった。
15.1.3 海外第Ⅲ相非盲検長期追跡調査試験(004試験)において、本剤投与中に肺動脈性肺高血圧症の肺血行動態は改善したが低酸素症を発現し、肺内右左シャントが確認された症例2例(0.5%未満)が報告されている。海外製造販売後においても低酸素症を発現し、肺内右左シャントが確認された本剤投与例が報告されている。[8.2参照]
15.2 非臨床試験に基づく情報
15.2.1 反復投与毒性試験において、ラットでは、ヒトの18倍の曝露量において、雄性生殖器(精巣輸出管及び精巣)、副腎及び腎臓への有害な影響がみられた。サルでは、ヒトの6倍以上の曝露量において、腎臓への有害な影響がみられた。
15.2.2 雄ラットを用いた受胎能試験では、ヒトの0.5倍以上の曝露量で、生殖器(精巣輸出管、精巣及び精巣上体)への回復性のない組織学的な影響がみられ、20倍の曝露量では、回復性のある受胎能の低下が認められた。
20. 取扱い上の注意
20.1 外箱開封後は遮光して保存すること。
20.2 凍結を避けること。
2025年8月改訂(第2版)
「効能又は効果」、「用法及び用量」、「禁忌を含む使用上の注意」、「効能又は効果に関連する注意」、「用法及び用量に関連する注意」、「副作用」等詳細については、電子添文をご参照ください。