開発の経緯
アクチビンシグナル伝達阻害剤であるエアウィン®の開発の経緯をご紹介します。
Humbert M et al. N Engl J Med. 2025; 392(20): 1987-2000.
COI:MSD社より研究助成を受けている。著者にMSD社から助成金等を受領している者、MSD社に所属する者を含む。
*1 6つの非侵襲的臨床パラメータ(WHO機能分類、収縮期血圧、心拍数、6分間歩行距離、NT-proBNP値、腎機能)に基づき患者の1年死亡リスクを評価する。スコアは1〜14の範囲で、スコアが高いほど死亡リスクが高いことを示す。
*2 健康関連QOLの5項目からなる質問票で、各国・地域の一般集団の価値観に基づき重み付けされている。スコアは0未満~1の範囲で、スコアが高いほど健康関連QOLが良好であることを示す。
*3 主要評価項目の結果を受けて本試験は早期中止された。そのためイベント発生数は減少し、副次評価項目を検定する統計的検出力は低下した。副次評価項目の検定手順①全生存率は有意差がなく、検定が終了した。
5. 効能又は効果に関連する注意(抜粋)
5.4 WHO機能分類クラスⅠ及びⅣにおける有効性及び安全性は確立していない。

a:患者は、PAH悪化に関連する入院イベント発現まで二重盲検プラセボ対照投与期を継続し、その後EOT来院を完了し、長期追跡試験であるSOTERIA試験への参加を可能とした。
b:追跡調査期にはEOT及びEOS来院が含まれる。SOTERIA試験へ移行する患者は、EOS来院を完了しない。
c:REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)により層別化した。
d:全死亡、肺移植又はPAH悪化に関連する24時間以上の入院が最初に起こるまでの期間
Adapted with permission from N Engl J Med, Humbert M et al., Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death, 392(20)., 1987-2000. Copyright © 2025 Massachusetts Medical Society.
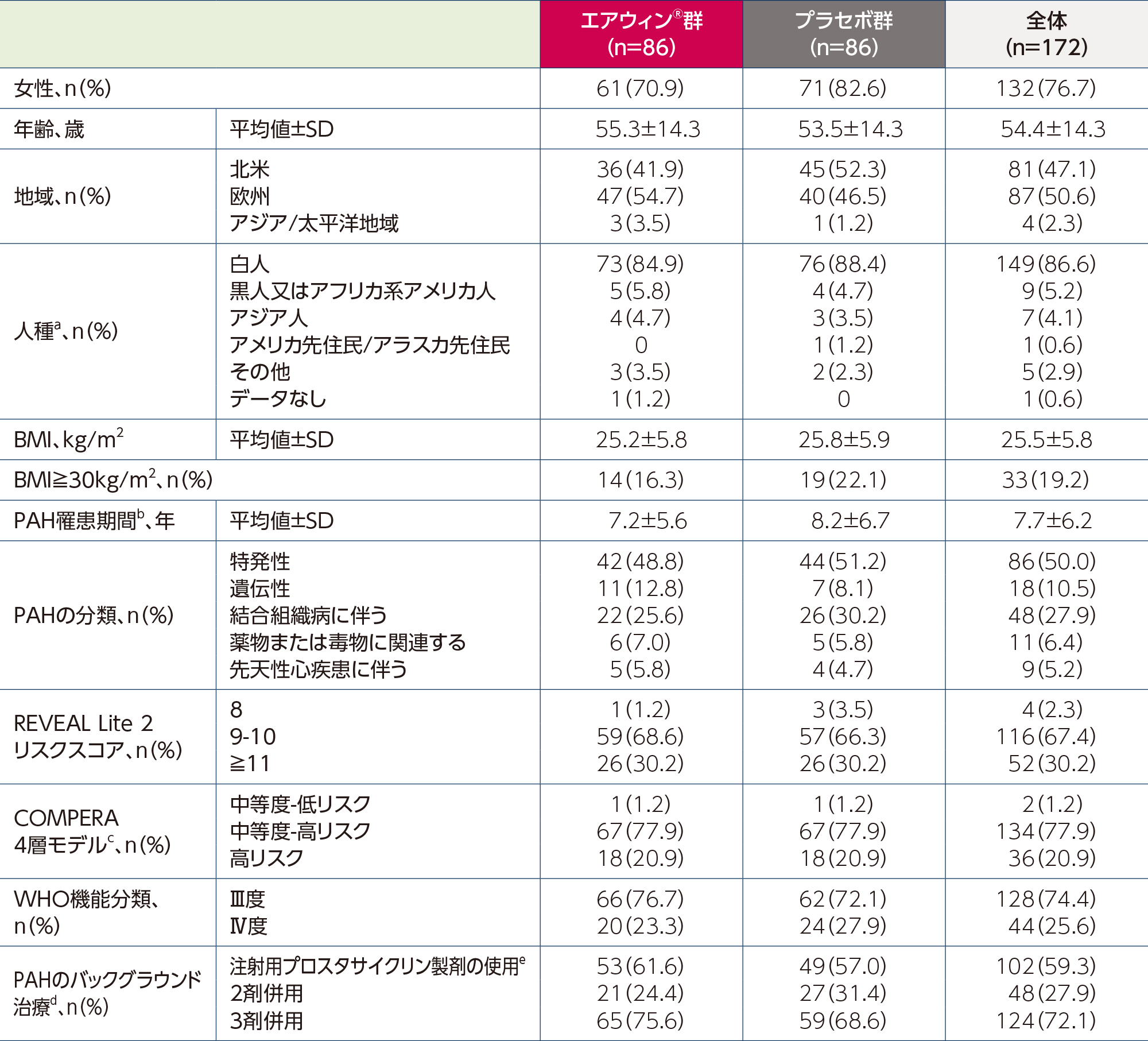
a:人種は患者から報告された。
b:〔インフォームド・コンセント(登録)日-PAH診断日+1〕/365.24により算出した。
c:3つの非侵襲的臨床パラメータ(WHO機能分類、6分間歩行距離、NT-proBNP値)に基づき患者の1年死亡リスクを評価する。スコアは1~4の範囲で、スコアが高いほど死亡リスクが高いことを示す。
d:バックグラウンド治療は治験実施計画書で事前に規定されておらず、患者は医師や各国の医療環境に従って治療を受けた。治療にはエンドセリン受容体拮抗薬、ホスホジエステラーゼ5阻害剤、可溶性グアニル酸シクラーゼ刺激剤、プロスタサイクリン類似体、プロスタサイクリン受容体作動薬による2剤又は3剤併用療法が含まれた。プロスタサイクリン点滴治療を受けている患者も、いずれかの治療カテゴリーに含まれる。
e:エポプロステノールの静脈内投与及びトレプロスチニルの静脈内又は皮下投与を含む。
Adapted with permission from N Engl J Med, Humbert M et al., Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death, 392(20)., 1987-2000. Copyright © 2025 Massachusetts Medical Society.
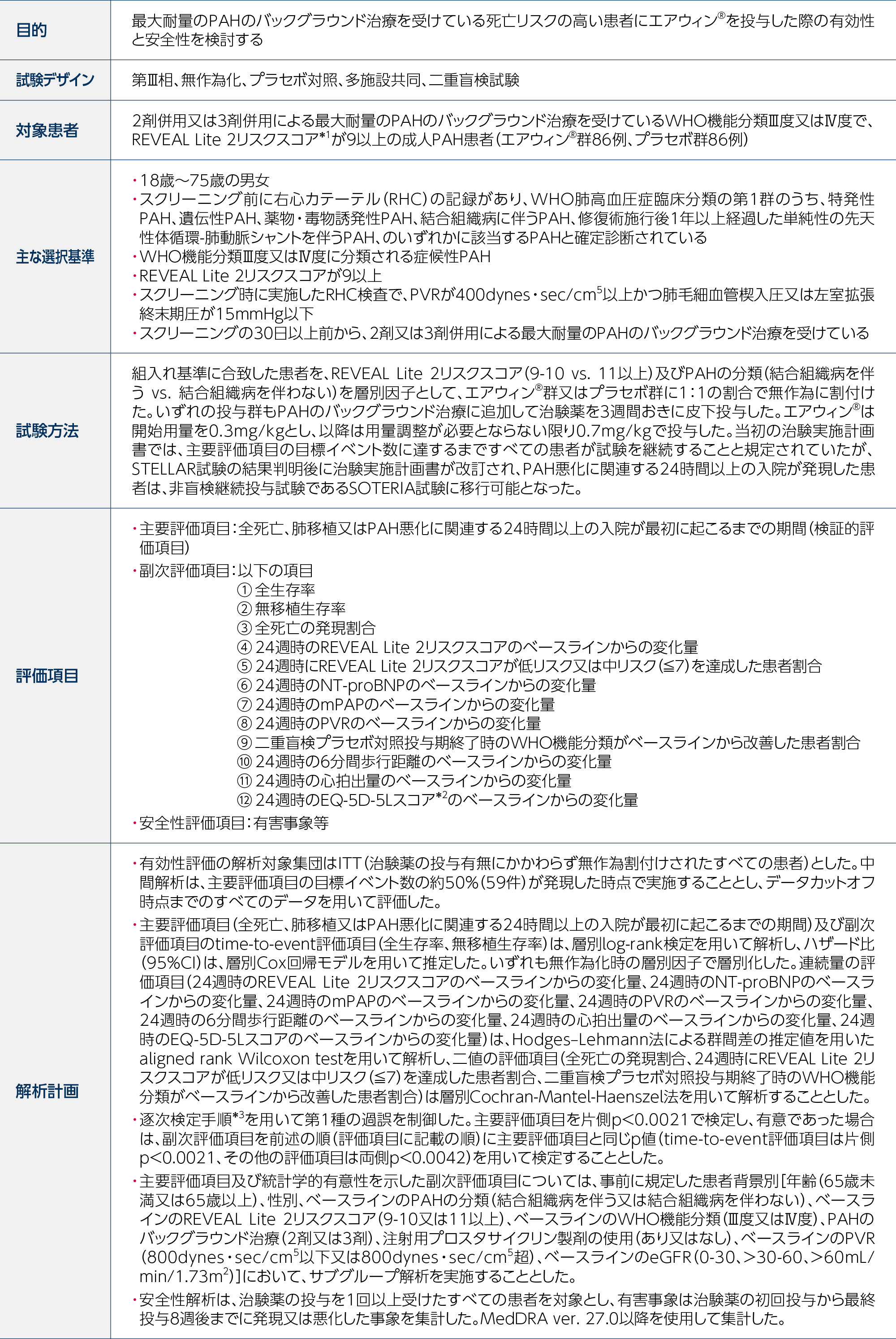
エアウィン®はプラセボに対して、全死亡、肺移植又はPAH悪化による24時間以上の入院が最初に起こるまでの期間を有意に延長しました(片側p<0.001b、層別log-rank検定、検証的解析結果)。プラセボ群に対するエアウィン®群のハザード比は0.24(95%CI:0.13, 0.43)cでした。曝露期間dの中央値は、エアウィン®群で322.0日、プラセボ群で215.5日でした。
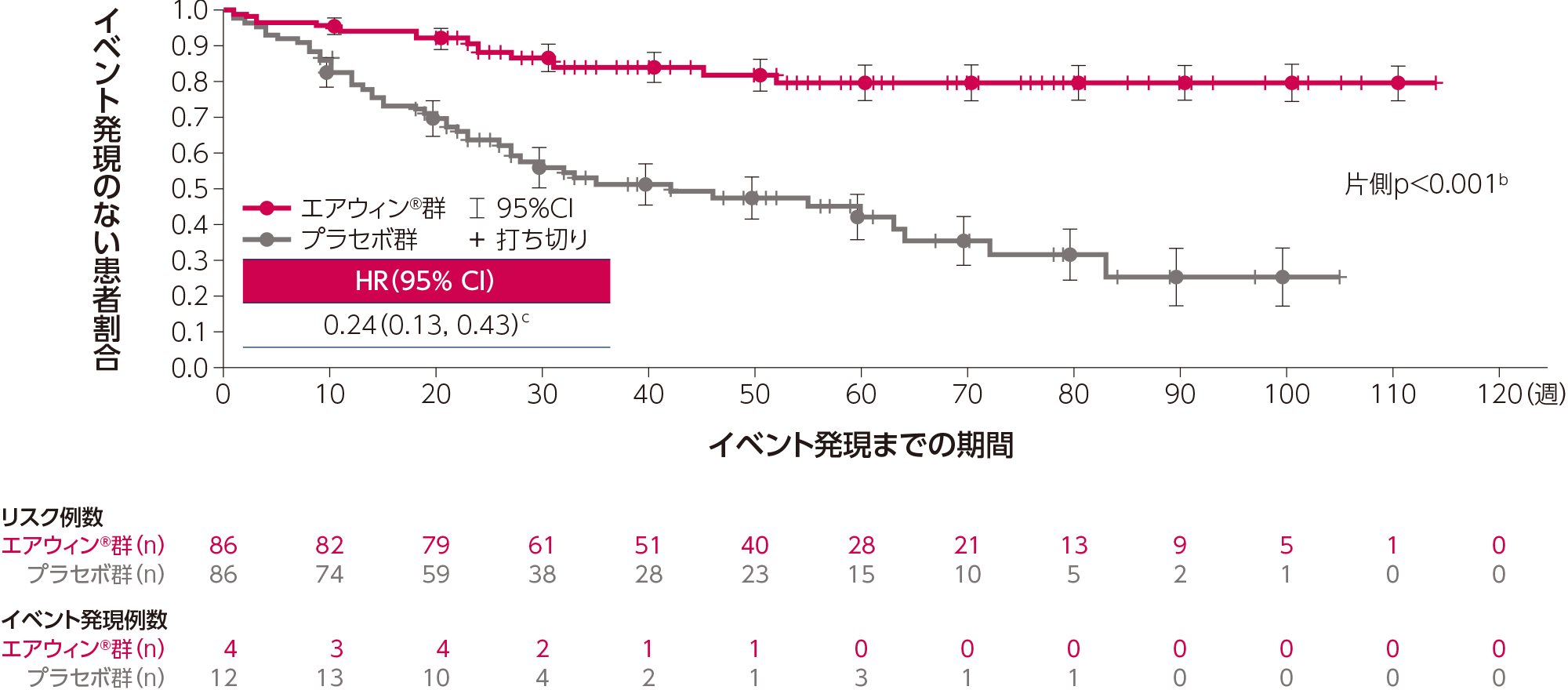
a:解析には、データカットオフ時点までに発現したすべての最初のイベントを含む。データカットオフ時点までに発現した死亡は、肺移植後又はSOTERIA試験への移行後に発現した死亡を除き、すべて対象とした。
b:REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)で層別化したlog-rank検定により算出した(有意水準:片側p<0.0021)。
c:投与群を共変量とし、REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)で層別化したCox回帰モデル(タイデータにはEfron法で対応)により算出した。
d:安全性解析対象集団(治験薬の投与を1回以上受けたすべての患者)を対象に解析した。曝露期間は、最終投与日-初回投与日+21と定義した。
Adapted with permission from N Engl J Med, Humbert M et al., Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death, 392(20)., 1987-2000. Copyright © 2025 Massachusetts Medical Society.
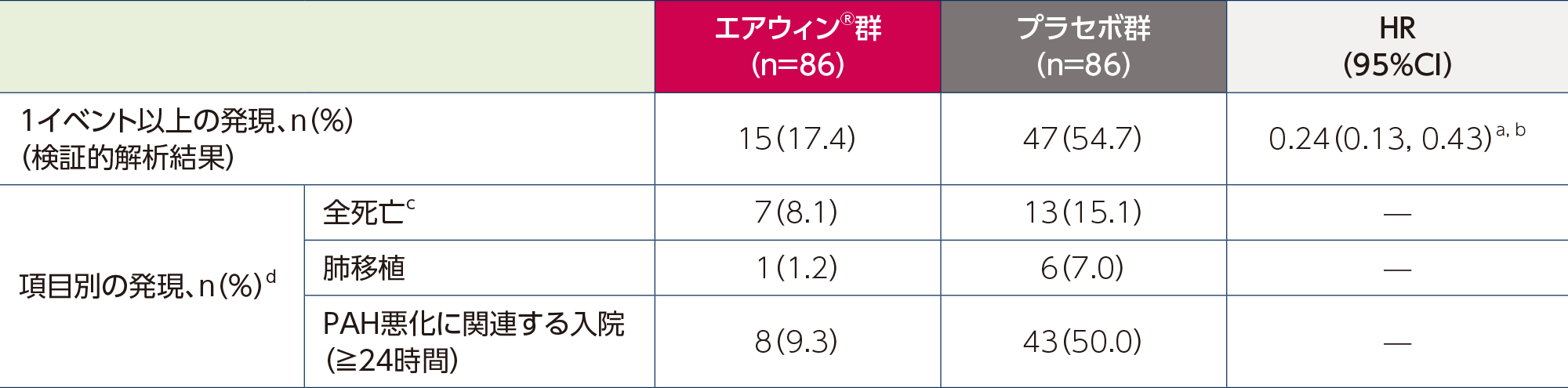
a:投与群を共変量とし、REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)で層別化したCox回帰モデル(タイデータにはEfron法で対応)により算出した。
b:片側p<0.001:REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)で層別化したlog-rank検定により算出した(有意水準:片側p<0.0021)。
c:データカットオフ時点までに発現した死亡は、肺移植後又はSOTERIA試験への移行後に発現した死亡を除き、すべて対象とした。
d:各項目を独立した評価項目として示す。主要評価項目の定義を満たす複数のイベントが観察された患者は、複数の項目に含まれる。
Adapted with permission from N Engl J Med, Humbert M et al., Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death, 392(20)., 1987-2000. Copyright © 2025 Massachusetts Medical Society.

a:患者数がITT集団の10%未満のカテゴリーは、サブグループ解析を行わなかったため表示していない。
b:非層別Cox回帰モデルによりハザード比の点推定値を算出した。
c:ベースラインのREVEAL Lite 2リスクスコアが9未満の患者は、9-10に分類された。
Adapted with permission from N Engl J Med, Humbert M et al., Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death, 392(20)., 1987-2000. Copyright © 2025 Massachusetts Medical Society.
副次評価項目は、第1種の過誤を制御するために全生存率から始まる逐次検定が事前に規定されていましたが、中間解析で全生存率が規定の有意水準(片側p<0.0021)に達しなかったため、その後の副次評価項目は正式な検定が実施されませんでした。

a:time-to-event評価項目について、早期離脱した患者の追跡データの欠損は離脱日で打ち切り、解析はデータがランダムに欠損しているという仮定で行った。連続量の評価項目について、死亡によりデータが欠落した患者については、最も悪い順位のスコアで補完し、肺移植またはPAHの悪化に関連する24時間以上の入院によりデータが欠落した患者については、次に悪い順位のスコアで補完した。その他の欠損値は、データがランダムに欠損しているという仮定のもと、多重補完法により補完した。
b:データカットオフ時点までに発現した死亡は、肺移植後又はSOTERIA試験への移行後に発現した死亡を除き、すべて対象とした。
c:投与群を共変量とし、REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)で層別化したCox回帰モデル(タイデータにはEfron法で対応)により算出した。
d:REVEAL Lite 2リスクスコア(9-10又は11以上)及びPAHの分類(結合組織病を伴う又は結合組織病を伴わない)で層別化したlog-rank検定により算出した。中間解析では、プラセボに対するエアウィン®の統計学的有意性の有意水準を片側p<0.0021に設定した。
e:Hodges-Lehmann法による位置パラメータのシフトによる群間差の中央値
Adapted with permission from N Engl J Med, Humbert M et al., Sotatercept in Patients with Pulmonary Arterial Hypertension at High Risk for Death, 392(20)., 1987-2000. Copyright ©2025 Massachusetts Medical Society.
a:エアウィン®又はプラセボの最終投与後56日までに発現した有害事象を解析対象とした。
Humbert M et al. N Engl J Med. 2025; 392(20): 1987-2000., 社内資料より作成
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?