海外第Ⅲ相試験(STELLAR試験)
海外第Ⅲ相試験(STELLAR試験)
承認時評価資料:海外第Ⅲ相試験(003試験)
Hoeper MM et al. N Engl J Med. 2023; 388(16): 1478-1490.
COI:Acceleron Pharma(現MSD)より研究助成を受けている。著者にMSD及びAcceleron Pharma(現MSD)に所属する者を含む。
- 試験概要
- 試験デザイン
- 患者背景
- 有効性(主要評価項目:24週時の6分間歩行距離のベースラインからの変化量)
- 有効性(副次評価項目:死亡又は最初の臨床的悪化の発現までの期間)
- 有効性(副次評価項目:24週時のPVRのベースラインからの変化量)
- 有効性(探索的評価項目:24週時のmPAPのベースラインからの変化量)
- 有効性(副次評価項目:24週時のWHO機能分類がベースラインから改善した患者割合)
- 安全性
試験概要

*副次評価項目は以下の順で検定を実施した。
①24週時の複合項目がベースラインから改善(6分間歩行距離が30m以上延長、NT-proBNPが30%以上低下又はNT-proBNP 300pg/mL未満を維持/達成、かつWHO機能分類が改善又はWHO機能分類Ⅱ度の維持)した患者割合、②24週時のPVRのベースラインからの変化量、③24週時のNT-proBNPのベースラインからの変化量、④24週時のWHO機能分類がベースラインから改善した患者割合(検証的評価項目)、⑤死亡又は最初の臨床的悪化の発現までの期間、⑥24週時の低リスクスコア(簡易版French Risk Scoreによる)がベースラインと比較して維持又は達成した患者割合、⑦24週時のPAH-SYMPACT®質問票:身体的影響ドメインスコアのベースラインからの変化量、⑧24週時のPAH-SYMPACT®質問票:心肺症状ドメインスコアのベースラインからの変化量、⑨24週時のPAH-SYMPACT®質問票:認知的/感情的影響ドメインスコアのベースラインからの変化量
逐次検定手順は⑨24週時のPAH-SYMPACT®質問票:認知的/感情的影響ドメインスコアのベースラインからの変化量で終了した。
試験デザイン

†いずれの投与期でも、用量調整ガイドラインに基づきエアウィン®の用量を増減する。
‡24週時の治験薬投与前までを主要投与期のデータとして扱った。
§延長投与期は、無作為化された最後の患者が主要投与期を完了するまで継続する。
¶有効性の主要な解析は、無作為化された最後の患者が主要投与期を完了後に実施する。
患者背景
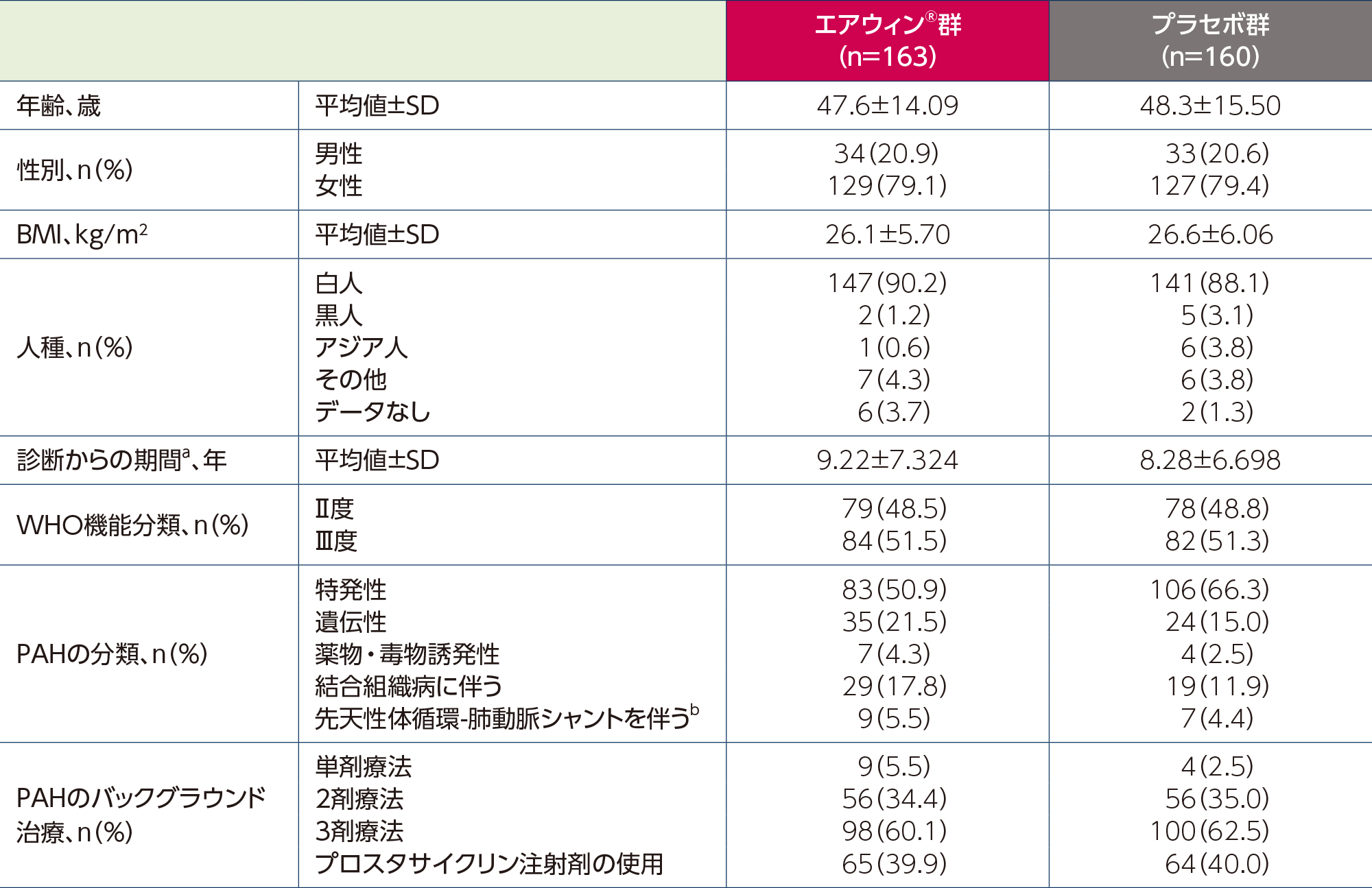
割合は四捨五入により合計が100にならない場合がある
a:(無作為化の日付-PAHの診断日)/365.25により算出した
b:修復術施行後1年以上経過した単純性の先天性体循環-肺動脈シャントを伴うPAH
主要評価項目:24週時の6分間歩行距離のベースラインからの変化量(検証的解析結果)
24週時の6分間歩行距離のベースラインからの変化量(推定中央値)は、エアウィン®群が34.4m、プラセボ群が1.0mでした。ベースラインからの変化量における群間差の中央値aは40.8mで、エアウィン®群で有意に改善しました(p<0.001、aligned rank stratified Wilcoxon testb、検証的解析結果)。

a:Hodges-Lehmann法による位置パラメータのシフトによる群間差の中央値
b:ベースラインのWHO機能分類(Ⅱ度vs.Ⅲ度)及びPAHのバックグラウンド治療(単剤又は2剤vs.3剤)で層別化したaligned rank stratified Wilcoxon test
死亡した患者の24週時の6分間歩行距離のベースラインからの変化量は、最低ランクである-2000mとした。非致死的な臨床的悪化のイベントによりデータが欠落している患者の24週時の6分間歩行距離のベースラインからの変化量は、次に低いランクである-1000mで補完した。
副次評価項目:死亡または最初の臨床的悪化の発現までの期間
死亡または最初の臨床的悪化のイベント発現のリスク
死亡又は最初の臨床的悪化のイベント発現のリスクは、プラセボ群と比較してエアウィン®群で84%低下し、有意差が認められました[ハザード比(95%CI):0.163(0.076, 0.347)、p<0.001、Cox比例ハザードモデルa ]。
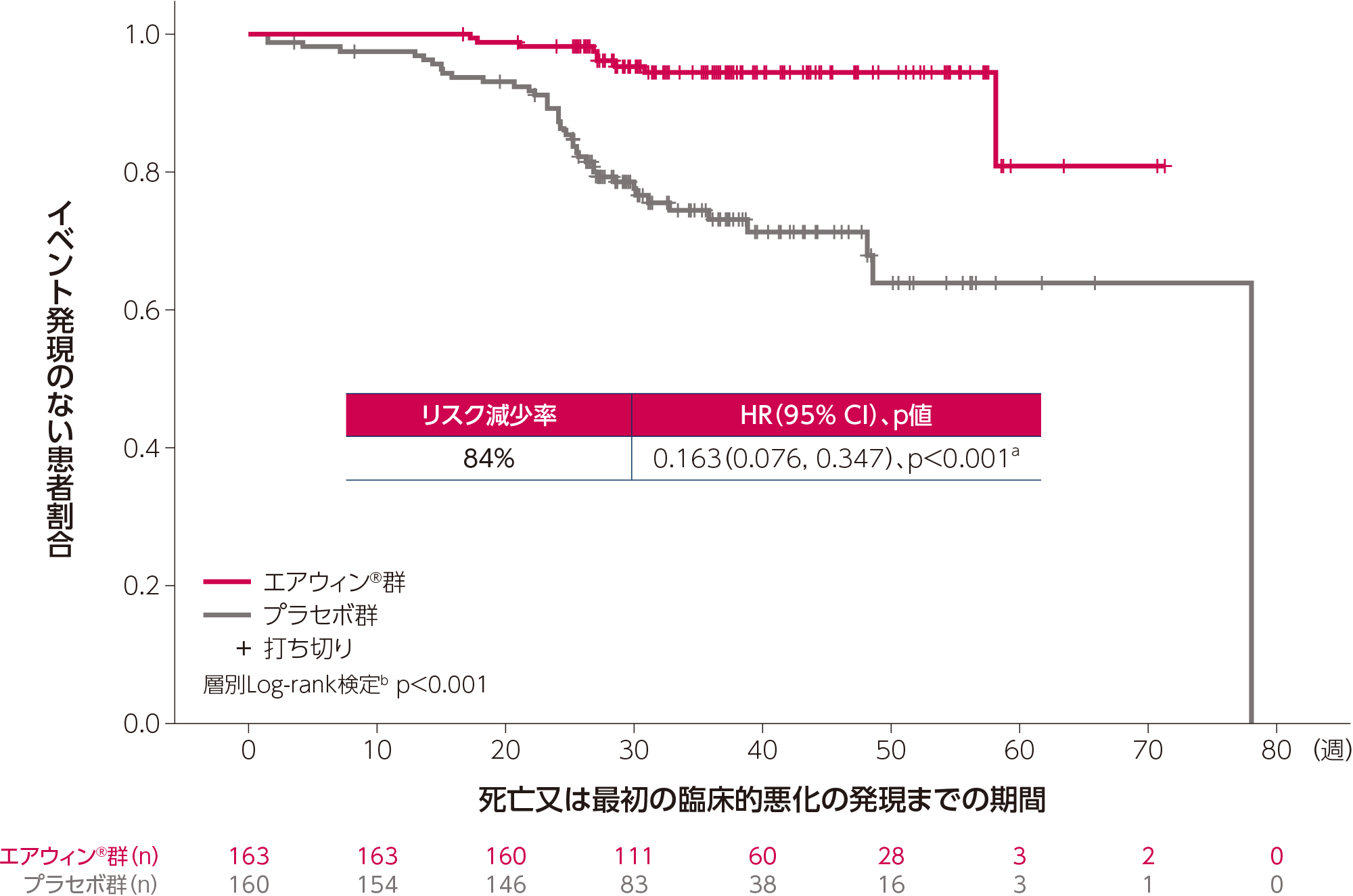
a:投与群を共変量とし、ベースラインのWHO機能分類(Ⅱ度vs.Ⅲ度)及びPAHのバックグラウンド治療(単剤又は2剤vs.3剤)で層別化したCox比例ハザードモデルにより算出した。
b:ベースラインのWHO機能分類(Ⅱ度vs.Ⅲ度)及びPAHのバックグラウンド治療(単剤又は2剤vs.3剤)で層別化したlog-rank検定により算出した。
【臨床的悪化の定義】
〇悪化に伴う肺及び/又は心臓移植のためのリスト登録
〇既承認のPAH治療薬によるレスキュー治療を開始する必要性、又はプロスタサイクリン注射剤を10%以上増量する必要性
〇心房中隔欠損作成術の必要性
〇PAHの悪化による入院(24時間以上)
〇PAHの悪化:PAHの悪化は以下の両方の事象により定義される
-WHO機能分類の悪化
-4時間以上かつ1週間以内の間隔で測定した2回のテストで確認した15%以上の6分間歩行距離の減少
副次評価項目:24週時のPVRのベースラインからの変化量
24週時のPVRのベースラインからの変化量(推定中央値)は、エアウィン®群が-165.1dynes・sec/cm5、プラセボ群が32.8dynes・sec/cm5でした。ベースラインからの変化量における群間差の中央値aは-234.6dynes・sec/cm5で、エアウィン®群で有意に改善しました(p<0.001、aligned rank stratified Wilcoxon testb)。

a:Hodges-Lehmann法による位置パラメータのシフトによる群間差の中央値
b:ベースラインのWHO機能分類(Ⅱ度vs.Ⅲ度)及びPAHのバックグラウンド治療(単剤又は2剤vs.3剤)で層別化したaligned rank stratified Wilcoxon test
死亡した患者の24週時のPVRのベースラインからの変化量は、最低ランクである20000とした。非致死的な臨床的悪化のイベントによりデータが欠落している患者の24週時のPVRのベースラインからの変化量は、次に低いランクである15000で補完した。
探索的評価項目:24週時のmPAPのベースラインからの変化量
24週時のmPAPのベースラインからの変化量における群間差(LS平均値の差)は-13.9mmHgでした。
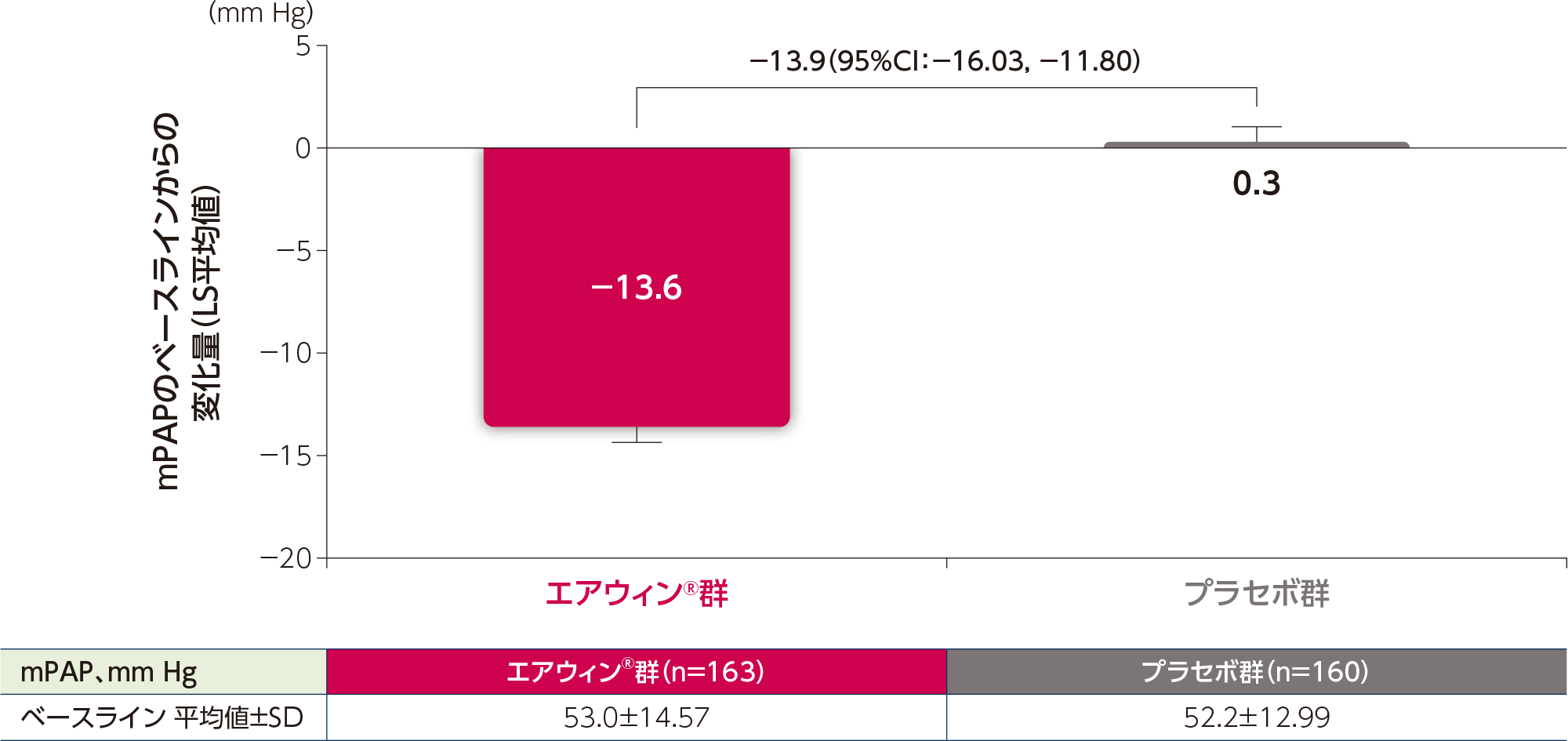
ベースラインのWHO機能分類(Ⅱ度vs.Ⅲ度)、PAHのバックグラウンド治療(単剤又は2剤vs.3剤)及びmPAPを共変量としてANCOVAで解析した。
副次評価項目:24週時のWHO機能分類がベースラインから改善した患者割合(検証的解析結果)
24週時のWHO機能分類がベースラインから改善した患者割合は、エアウィン®群29.4%(48/163例)、プラセボ群13.8%(22/159例)で、エアウィン®群で有意に改善しました(p<0.001、層別Cochran-Mantel-Haenszel法a、検証的解析結果)
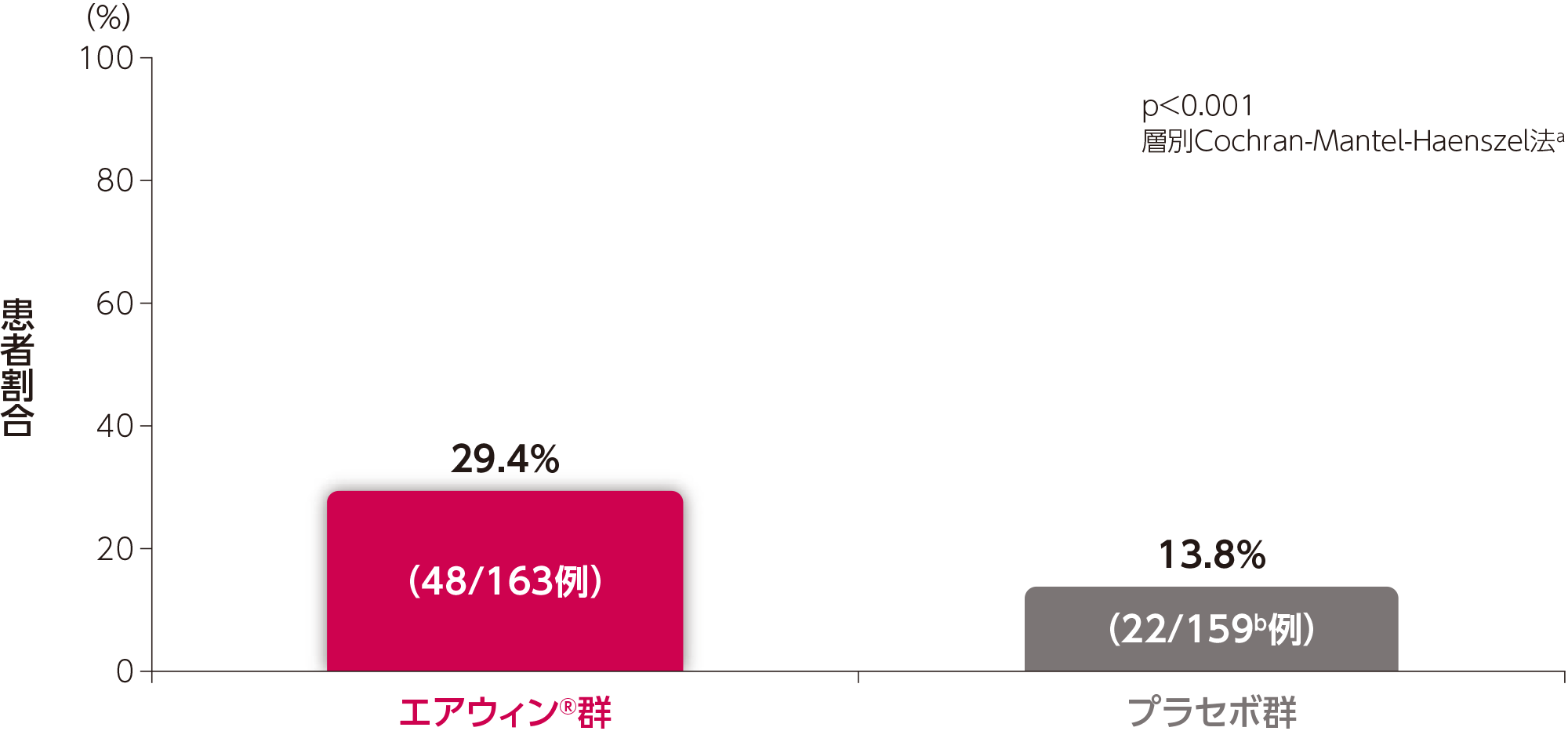
a:バックグラウンド治療(単剤又は2剤vs.3剤)及びベースライン時のWHO機能分類(Ⅱ度vs.Ⅲ度)で層別化したCochran-Mantel-Haenszel法
b:COVID-19のためデータが欠落した1名を解析から除外した
安全性
主な副作用の発現割合(主要投与期+延長投与期)
主要投与期及び延長投与期(データカットオフ:2022年12月6日)の副作用の発現割合は、エアウィン®群50.9%(83/163例)、プラセボ群28.1%(45/160例)でした。

重篤な副作用、投与中止に至った副作用、死亡に至った副作用(主要投与期+延長投与期)
- 重篤な副作用は、エアウィン®群で3例(転倒、喀血、サルコイドーシス、各1例)、プラセボ群で2例(食道カンジダ症及び好中球減少症1例、蕁麻疹1例)が認められました。
- 治験薬の投与中止に至った副作用は、エアウィン®群で3例(喀血1例、鼻出血及び毛細血管拡張症1例、サルコイドーシス1例)が認められました。プラセボ群では認められませんでした。
- 死亡に至った副作用はいずれの群でも認められませんでした。