開発の経緯
アクチビンシグナル伝達阻害剤であるエアウィン®の開発の経緯をご紹介します。
McLaughlin VV et al. N Engl J Med. 2025; 393(16):1599-1611.
COI:MSD社より研究助成を受けている。著者にMSD社に所属する者を含む。
*1 6つの非侵襲的臨床パラメータ(WHO機能分類、収縮期血圧、心拍数、6分間歩行距離、NT-proBNP、腎機能)に基づき患者の1年死亡リスクを評価する。スコアは1〜14の範囲で、スコアが高いほど死亡リスクが高いことを示す。
*2 WHO機能分類、6分間歩行距離、NT-proBNPに基づき患者の無移植での1年死亡リスクを4つのリスクカテゴリー(低リスク、中等度-低リスク、中等度-高リスク、高リスク)で評価する。
*3 あらゆる原因による死亡、PAHの悪化による24時間以上の入院、心房中隔欠損作成術、肺移植、又はPAHに伴う運動機能評価の悪化の複合イベント。
*4 (ⅰ)6分間歩行距離が30m以上延長、(ⅱ)NT-proBNPが30%以上低下又はNT-proBNP300pg/mL未満を維持/達成、(ⅲ)WHO機能分類が改善又はWHO機能分類Ⅱ度を維持、の3項目すべてを達成した患者割合。
*5 簡易版French Risk Scoreの低リスクは(ⅰ)6分間歩行距離が440m超、(ⅱ)NT-proBNP300pg/mL未満、(ⅲ)WHO機能分類Ⅰ又はⅡ度、の3項目すべての達成と定義される。
*6 HYPERION試験の進行中に先行するSTELLAR試験の解析、及びZENITH試験の中間解析において統計的有意な結果が報告されたことから、HYPERION試験は早期に中止されたため、本試験の解析は十分な検出力を有していない。中止時点で利用可能なすべてのデータを使用して本試験の最終解析を実施した。
*7 逐次検定手順は、24週時の簡易版French Risk Scoreが低リスクを維持又は達成した患者割合で終了した。
Adapted with permission from N Engl J Med, McLaughlin VV et al, Sotatercept for Pulmonary Arterial Hypertension within the First Year after Diagnosis, 393(16): 1599-1611. Copyright © 2025 Massachusetts Medical Society.
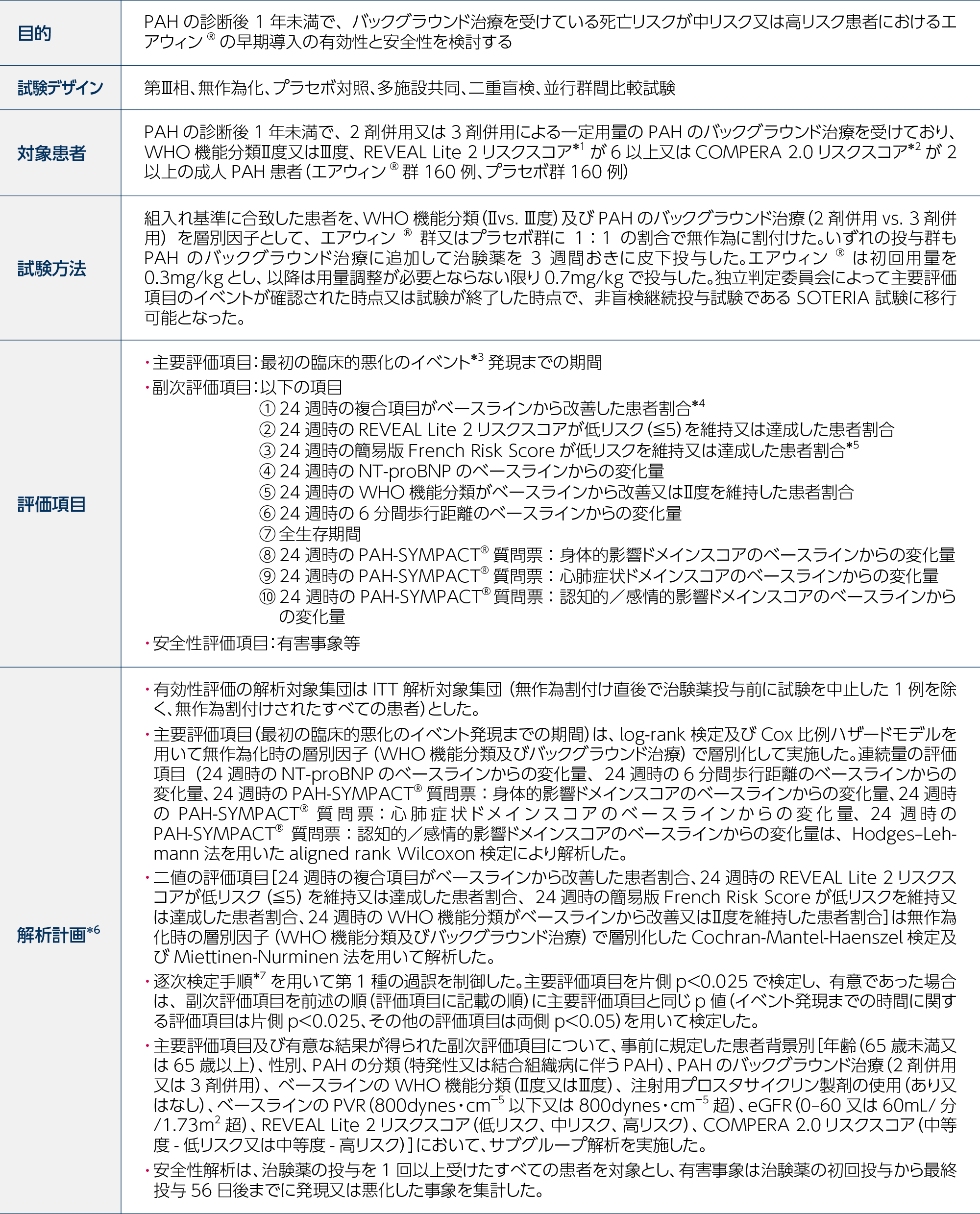
a:患者は、PAHの臨床的悪化を経験するまで二重盲検プラセボ対照投与期を継続し、その後EOT来院を完了し、長期追跡試験であるSOTERIA試験への参加を可能とした。
b:追跡調査期にはEOT及びEOS来院が含まれる。SOTERIA試験へ移行する患者は、EOS来院を完了しない。
c:PAHのバックグラウンド治療は承認されたPAH特異的薬剤を指し、2剤併用又は3剤併用療法で構成された。
d:初回用量0.3mg/kg、2回目以降0.7mg/kg
e:HYPERION試験の進行中に先行するSTELLAR試験の解析、及びZENITH試験の中間解析において統計的有意な結果が報告されたため、HYPERION試験は臨床的平衡を失ったと判断され、計画されていた中間解析を実施する前に早期終了となった。試験終了時にすべての適格患者はSOTERIA試験への移行が可能であった。中止時点で利用可能なすべてのデータを使用して本試験の最終解析を実施した。
Adapted with permission from N Engl J Med, McLaughlin VV et al, Sotatercept for Pulmonary Arterial Hypertension within the First Year after Diagnosis, 393(16): 1599-1611. Copyright © 2025 Massachusetts Medical Society.
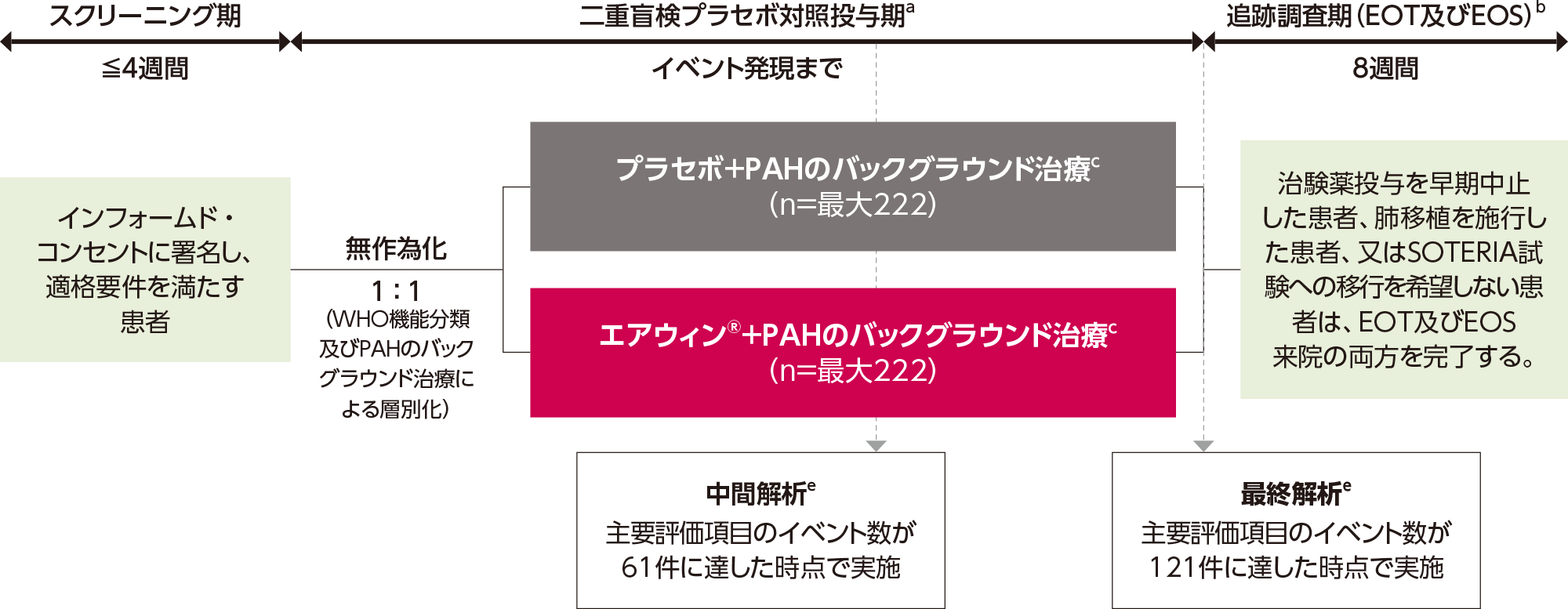
a:プラスマイナス値は平均値±SDを示す。%は四捨五入のため合計が100にならない場合がある。測定値は、スクリーニング時に取得された。
b:人種は患者から報告された。
c:体重(kg)を身長(m)の2乗で割った値。
d:(PAHの診断日+1日)/30.4367により算出した。
e:PAHと診断されてからの期間にプロトコールの逸脱が2例あり、エアウィン®群の1例は442日、プラセボ群の1例は397日であった。
f:6つの非侵襲的臨床パラメータ(WHO機能分類、収縮期血圧、心拍数、6分間歩行距離、NT-proBNP、腎機能)に基づき患者の1年死亡リスクを評価する。スコアは1〜14の範囲で、スコアが高いほど死亡リスクが高いことを示す。
g:WHO機能分類、6分間歩行距離、NT-proBNPに基づき患者の無移植での1年死亡リスクを4つのリスクカテゴリー(低リスク、中等度-低リスク、中等度-高リスク、高リスク)で評価する。
h:WHO機能分類はI~Ⅳの範囲で、数値が高いほど機能制限が大きいことを示す。
i:バックグラウンド治療は治験実施計画書に規定されておらず、医師の判断及び地域の慣行に従って実施された。治療には、ERA、PDE5阻害薬、sGC刺激薬、プロスタサイクリンの併用による2剤又は3剤併用の治療が含まれていた。注射用プロスタサイクリン製剤による治療を受けている患者は、他の治療カテゴリーのいずれかにも含まれていた。
j:エポプロステノールの静脈内投与及びトレプロスチニルの静脈内又は皮下投与を含む。
k:併存疾患は標準化されたMedDRA用語を使用して要約された(糖尿病:糖尿病、1型糖尿病、2型糖尿病、耐糖能障害、高血圧:高血圧及び本態性高血圧、肥満:肥満、BMI≧30kg/m2、冠動脈性心疾患:冠動脈疾患、冠動脈ステント挿入、冠動脈形成術、冠動脈硬化症、冠動脈狭窄、心筋虚血、心筋梗塞、急性心筋梗塞、狭心症)。
l:PVRの大部分は、PAH診断時に右心カテーテル検査(RHC)によって収集された。過去の診断時に組入れ基準の確認に必要なすべての測定値が得られなかった場合、スクリーニング手順としてRHCが実施され、データベースに報告された。
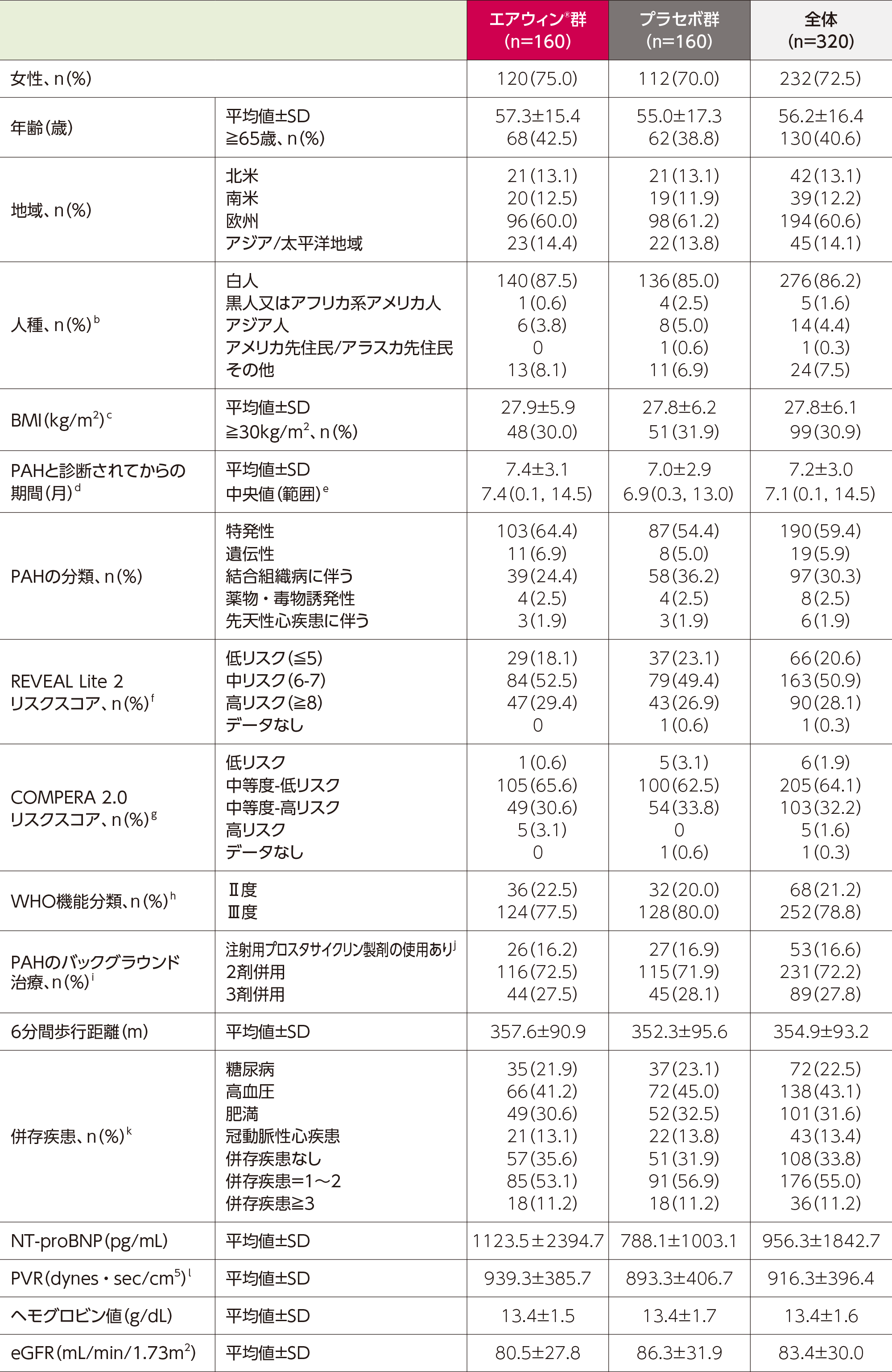
エアウィン®はプラセボに対して、最初の臨床的悪化のイベントa発現までの期間を有意に延長しました(片側p<0.001b 、層別log-rank検定)。プラセボ群に対するエアウィン®群のハザード比は0.24(95%CI:0.14, 0.41)cでした。
Adapted with permission from N Engl J Med, McLaughlin VV et al, Sotatercept for Pulmonary Arterial Hypertension within the First Year after Diagnosis, 393(16): 1599-1611. Copyright © 2025 Massachusetts Medical Society.
a:あらゆる原因による死亡、PAHの悪化による24時間以上の入院、心房中隔欠損作成術、肺移植、又はPAHに伴う運動機能評価の悪化の複合イベント。データベースロックまでに発現した全死亡は、判定の有無、及びHYPERION試験参加中又は参加後に発現したかどうかにかかわらず、SOTERIA試験移行後の死亡例を除き対象とした。PAHに伴う運動機能評価の悪化は、4時間以上間隔をあけて実施された2回の連続した6分間歩行距離の平均がベースラインから減少し、かつ、次の事象を1つ以上伴う場合と定義した:WHO機能分類の悪化、右心室不全の症状または徴候の増悪、新たなPAHバックグラウンド治療の開始、またはバックグラウンド治療の注射剤への変更。
b:多重性を調整しているが、十分な検出力を有していない。投与群を共変量とし、WHO機能分類(Ⅱ度又はⅢ度)及びバックグラウンド治療(2剤又は3剤併用)で層別化したlog-rank検定により算出した(有意水準:片側p<0.025)。
c:HR(エアウィン®群vs.プラセボ群)は、投与群を共変量とし、WHO機能分類(Ⅱ度又はⅢ度)及びバックグラウンド治療(2剤又は3剤併用)で層別化したCox比例ハザードモデルにより算出した。
臨床的悪化イベントを1件以上発現した患者割合は、エアウィン®群で10.6%(17/160例)、プラセボ群で36.9%(59/160例)でした。

Adapted with permission from N Engl J Med, McLaughlin VV et al, Sotatercept for Pulmonary Arterial Hypertension within the First Year after Diagnosis, 393(16): 1599-1611. Copyright © 2025 Massachusetts Medical Society.
a:複合項目の各項目は独立した評価項目として示された。主要評価項目の定義を満たす複数のイベントが観察された場合、患者は複数の項目に含まれる。主要評価項目の各項目について、群間の正式な比較は行われていない。
b:判定の有無、及びHYPERION試験参加中又は参加後に発現したかどうかにかかわらず、SOTERIA試験移行後の死亡例を除き対象とした。
c:4時間以上間隔をあけて実施された2回の連続した6分間歩行距離の平均がベースラインから減少し、かつ、次の事象を1つ以上伴う場合と定義した:WHO機能分類の悪化、右心室不全の症状または徴候の増悪、新たなPAHバックグラウンド治療の開始、またはバックグラウンド治療の注射剤への変更。
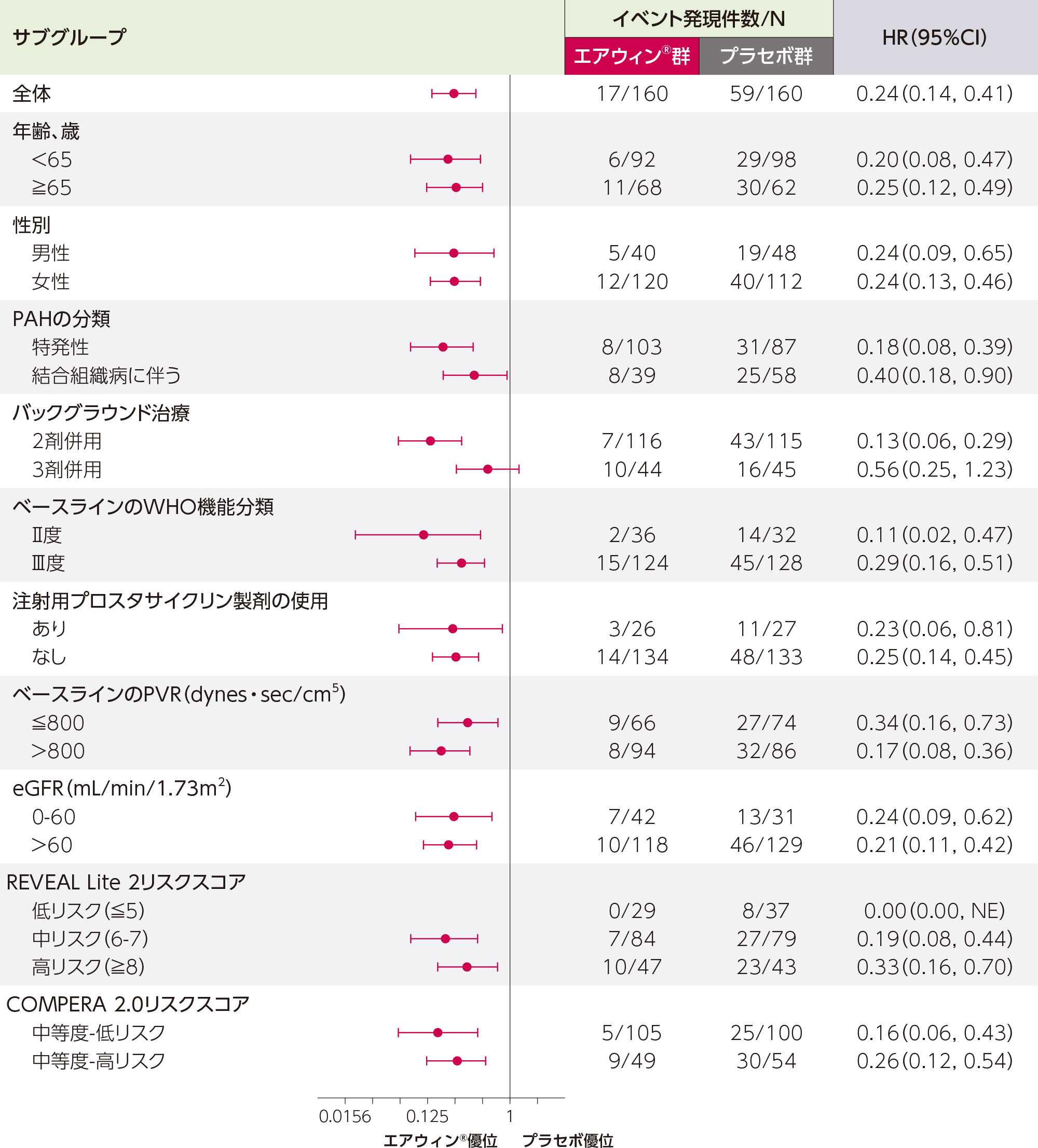
Adapted with permission from N Engl J Med, McLaughlin VV et al, Sotatercept for Pulmonary Arterial Hypertension within the First Year after Diagnosis, 393(16): 1599-1611. Copyright © 2025 Massachusetts Medical Society.
a:ITT解析対象集団(無作為割付け直後で治験薬投与前に試験を中止した1例を除く、無作為割付けされたすべての患者)を対象とした。
b:水平バーはハザード比の95%信頼区間を、円形はハザード比の点推定値を示す。治療群ごとに名目上の95%CIを用いて、Cox回帰モデルにより群間の治療効果を推定した。各患者の割合がITT解析対象集団の10%未満であった場合、サブグループ解析は実施されなかった。
c:統計的検定が行われなかった場合、効果の決定的な根拠として解釈すべきではない。
NE: not evaluable
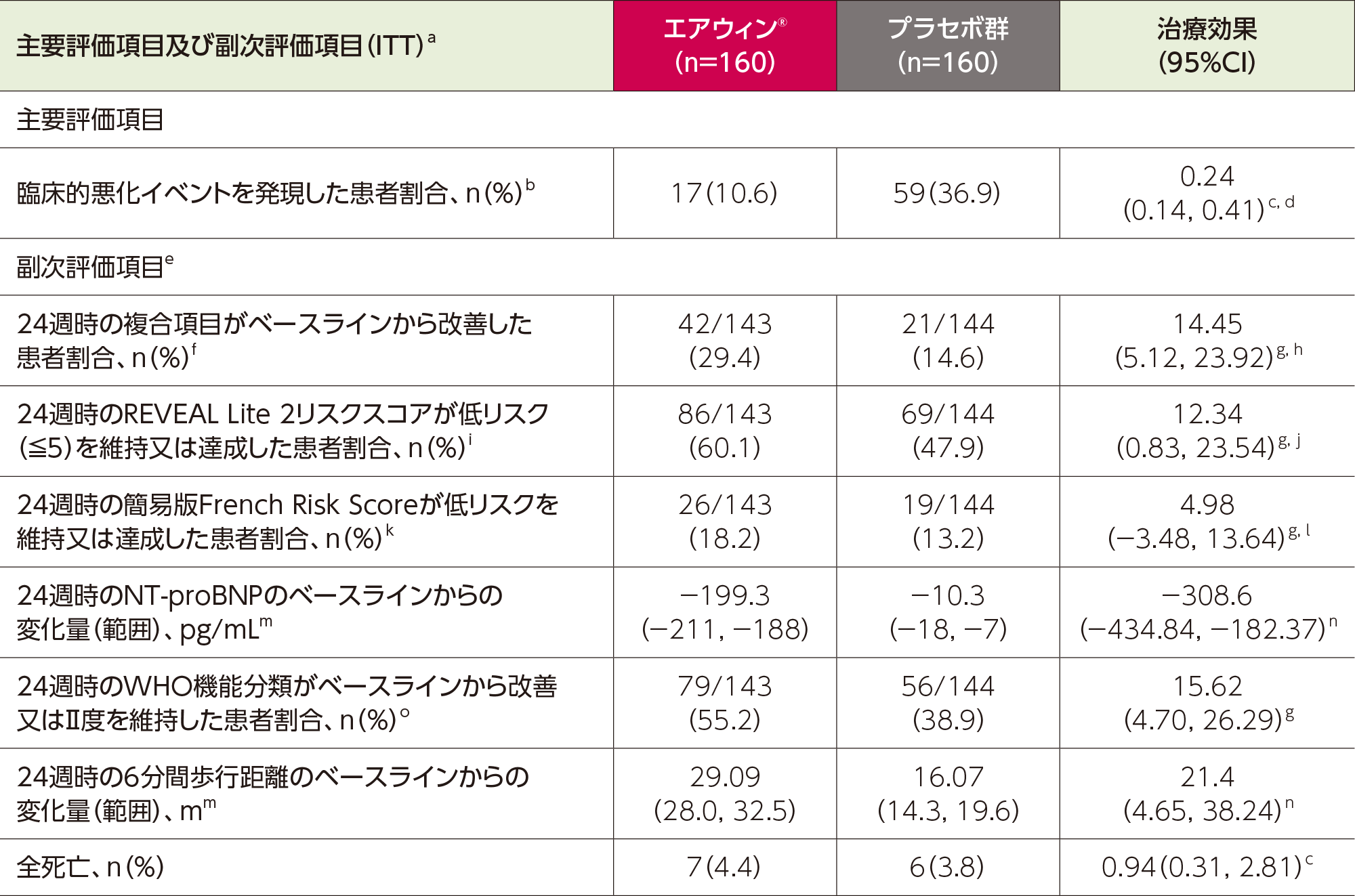
Adapted with permission from N Engl J Med, McLaughlin VV et al, Sotatercept for Pulmonary Arterial Hypertension within the First Year after Diagnosis, 393(16): 1599-1611. Copyright © 2025 Massachusetts Medical Society.
a:特に記載のない限り、ITT解析対象集団で解析を実施した。24週時のNT-proBNPのベースラインからの変化量、24週時の6分間歩行距離のベースラインからの変化量では、死亡によりデータが存在しない患者は最悪値で、非致死的な臨床的悪化によりデータが存在しない患者には最悪値の次の値で欠測値を補完し、それ以外の理由によるデータが存在しない場合は完全条件指定回帰モデルによる多重代入法を用いて欠測値を補完した。24週時の複合項目がベースラインから改善した患者割合、24週時のREVEAL Lite 2リスクスコアが低リスク(≦5)を維持又は達成した患者割合、24週時の簡易版French Risk Scoreが低リスクを維持又は達成した患者割合、24週時のWHO機能分類がベースラインから改善又はⅡ度を維持した患者割合では、欠測値は反応なしとみなした。ベースラインは、エアウィン®またはプラセボ初回投与前に取得された最後の測定値と定義した。
b:臨床的悪化は、あらゆる原因による死亡、PAHの悪化による24時間以上の入院、心房中隔欠損作成術、肺移植、又はPAHに伴う運動機能評価の悪化の複合イベントであり、最初のイベントまでの時間として解析した。PAHに伴う運動機能評価の悪化は、4時間以上間隔をあけて実施された2回の連続した6分間歩行距離の平均がベースラインから減少し、かつ、次の事象を1つ以上伴う場合と定義した:WHO機能分類の悪化、右心室不全の症状または徴候の増悪、新たなPAHバックグラウンド治療の開始、またはバックグラウンド治療の注射剤への変更。データベースロックまでに発現した全ての死亡は、判定の有無、HYPERION試験参加中又は参加後に発現したかどうかにかかわらず、SOTERIA試験移行後の死亡例を除き対象とした。
c:HRを示す。HRは投与群を共変量とし、無作為化層別因子[WHO機能分類(Ⅱ度又はⅢ度)及びバックグラウンド治療(2剤又は3剤併用)]で層別化したCox比例ハザードモデルにより算出した。
d:p<0.001(有意水準:片側p<0.025、多重性を調整しているが、十分な検出力を有していない)。投与群を共変量とし、WHO機能分類(Ⅱ度又はⅢ度)及びバックグラウンド治療(2剤又は3剤併用)で層別化したlog-rank検定により算出した。
e:副次評価項目は逐次検定手順を用いて第1種の過誤を制御した。副次評価項目は事前に定めた順序で逐次検定を行い、各検定は前の検定が統計学的有意となった場合にのみ実施された(有意水準は片側p<0.025又は両側p<0.05)。統計解析が実施されなかった副次評価項目は、調整されていない95%CIを示す。統計解析がなければ、これらの信頼区間は明確な治療効果を推測するために使用すべきではない。
f:(ⅰ)6分間歩行距離が30m以上延長、(ⅱ)NT-proBNPが30%以上低下又はNT-proBNP300pg/mL未満を維持/達成、(ⅲ)WHO機能分類が改善又はWHO機能分類Ⅱ度を維持、の3項目すべてを達成した患者割合と定義した。
g:パーセントポイント差を示す。
h:p=0.003(有意水準:両側p<0.05、多重性を調整しているが、十分な検出力を有していない)。無作為化層別因子で層別化したCochran-Mantel-Haenszel法により算出した。
i:REVEAL Lite 2リスクスコアの低リスクは5以下と定義される。
j:p=0.04(有意水準:両側p<0.05 、多重性を調整しているが、十分な検出力を有していない)。無作為化層別因子で層別化したCochran-Mantel-Haenszel法により算出した。
k:簡易版French Risk Scoreの低リスクは(ⅰ)6分間歩行距離が440m超、(ⅱ)NT-proBNP300pg/mL未満、(ⅲ)WHO機能分類Ⅰ又はⅡ度、の3項目すべての達成と定義される。
l:p値(無作為化層別因子で層別化したCochran-Mantel-Haenszel法により算出)が事前に規定した有意水準(両側p<0.05)を満たさなかったため、逐次検定手順は24週時の簡易版French Risk Scoreが低リスクを維持又は達成した患者割合で終了した。
m:データはエアウィン®群143例、プラセボ群144例で利用可能であった。欠測値を補完した場合、補完データセットにおける中央値の平均値(95%CI)を示す。
n:Hodges–Lehmann法によるプラセボと中央値の差を推定した値を示す。
o:WHO機能分類のベースラインからの変化(Ⅱ→Ⅰ、Ⅲ→Ⅰ、Ⅲ→Ⅱ)、又はWHO機能分類Ⅱの維持を評価した。
追跡調査期間の中央値はエアウィン®群では14.6ヵ月、プラセボ群で11.5ヵ月でした。
a:エアウィン®又はプラセボの初回投与から最終投与56日後までに発現又は悪化した事象を集計した。
McLaughlin VV et al. N Engl J Med. 2025; 393(16):1599-1611.[COI:MSD社より研究助成を受けている。
著者にMSD社に所属する者を含む。]、社内資料:HYPERION試験(安全性)より作成
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?