KEYNOTE-716試験(Adju.,Stage Ⅱ)
本剤は、一部承認外の用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。そのため、国内で承認されている用法及び用量と異なるデータも紹介しています。
悪性黒色腫:国際共同臨床試験成績:国際共同第Ⅲ相試験<KEYNOTE-716試験>
電子添文改訂時評価資料: 国際共同第Ⅲ相試験(KEYNOTE-716試験)
Luke JJ et al. Lancet 2022; 399: 1718-1729
Luke JJ et al. Lancet 2022; 399: 1718-1729 Supplementary appendix
KEYNOTE-716試験はMSD社の資金提供により行われた。本試験は学術機関に所属の著者ら及びMSD社社員によりデザインされた。Jason J LukeはMSD社から研究助成金及び顧問料を受領している。その他の著者に、研究助成金等を受領している者が含まれる。Ke Chen、Scott J Diede、Sama Ahsan、Nageatte IbrahimはMSD社の社員であり、MSD社株式を保有している。
試験概要
【目的】
完全切除後のⅡB期*1又はⅡC期*1の悪性黒色腫患者における術後補助療法としてのキイトルーダ®の有効性及び安全性をプラセボと比較検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性試験][第1回中間解析結果(データカットオフ日: 2020年12月4日)及び第2回中間解析結果(データカットオフ日: 2021年6月21日)]
【対象】
完全切除後のⅡB期又はⅡC期の12歳以上の悪性黒色腫患者976例(日本人3例を含む)
【方法】
パート1:キイトルーダ®群(18歳以上の患者に対しては200mgを3週間間隔[Q3W]で点滴静注、12歳以上18歳未満の患者※に対しては2mg/kg[最大200mg]をQ3Wで点滴静注)又はプラセボ群(生理食塩液をQ3Wで点滴静注)に1:1の割合で無作為割り付けし、再発又は許容できない有害事象が認められるまで最大17サイクル投与した。画像診断を、無作為割り付けから1年間は6ヵ月毎、2年目から4年目は6ヵ月毎、5年目は1回又は臨床的に必要な場合に実施した。
パート2:プラセボ群は疾患再発後にクロスオーバーを許容し、疾患進行又は再発まで最大17サイクル(局所/遠隔再発後に外科的切除した場合)又は35サイクル(切除不能である場合)のキイトルーダ®*2投与を可能とした。キイトルーダ®群は、最終投与から6ヵ月を超えて再発した場合、再投与として最大17サイクル(局所/遠隔再発後に外科的切除した場合)又は35サイクル(切除不能である場合)のキイトルーダ®*2投与を可能とした。投与中は画像診断を12週間毎に実施した。
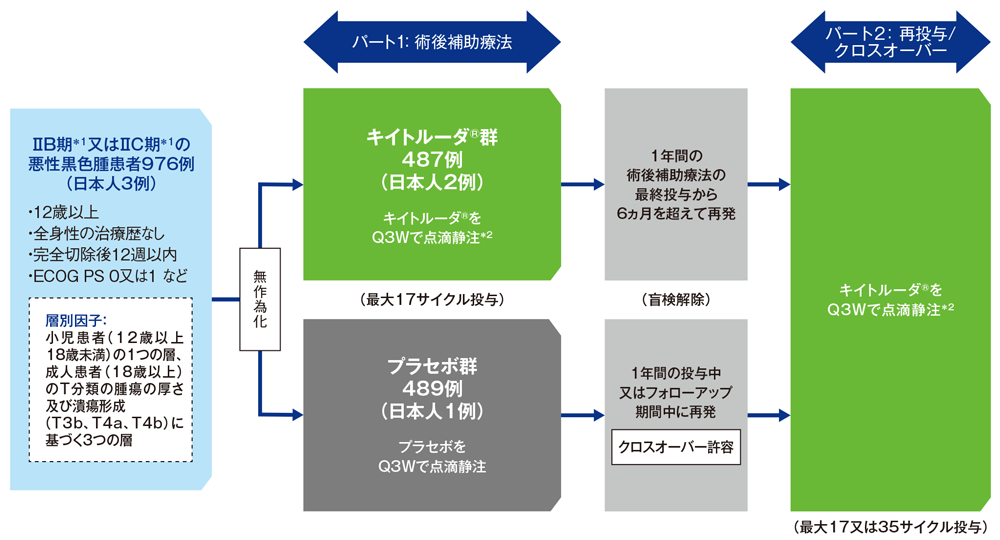
【評価項目】
主要評価項目:無再発生存期間(recurrence-free survival; RFS)※
副次評価項目:無遠隔転移生存期間(distant metastasis-free survival; DMFS)※及び全生存期間(overall survival; OS)※、安全性
探索的評価項目:健康関連QOLに関する患者報告アウトカム(patient reported outcome; PRO)等
※検証的解析項目
【判定基準】
再発はCT又はMRIによる画像検査により評価した。健康関連QOLに関するPROはEORTC QLQ-C30、EuroQoL-5D-5Lにより評価した。
【解析計画】
解析対象集団:有効性はITT集団*3、安全性はAPaT集団*4を対象として解析を行った。健康関連QOLに関するPROはFAS集団*5を対象として解析を行った。
有効性評価の統計手法: RFS及びOSはKaplan-Meier法を用いて生存曲線を推定し、DMFSはCumurative Incidence Curve法を用いて遠隔転移までの期間の曲線を推定した。RFS、DMFS及びOSの群間比較は層別ログランク検定を用いて評価し、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比及びその95%信頼区間(CI)を算出した。層別ログランク検定及び層別Cox比例ハザードモデルの層別因子には、無作為割り付けに用いた層別因子[小児患者(12歳以上18歳未満)の1つの層、成人患者(18歳以上)のT分類の腫瘍の厚さ及び潰瘍形成(T3b、T4a、T4b)に基づく3つの層]を用いた。また、T分類(T3b、T4a、T4b)、年齢区分(<65歳、≧65歳)、性別(男性、女性)、人種(白人、白人以外)、ECOG PS(0、1)、地域(アメリカ、アメリカ以外)についてのRFSの部分集団解析を実施した。
多重性の調整: 本試験では有効性の5回の中間解析と最終解析を事前に計画し、RFSは1回の中間解析及び最終解析、DMFSは1回の中間解析及び最終解析、OSは1回の中間解析及び最終解析を実施することとした。RFS、DMFS及びOSの有意水準が片側2.5%となるように厳密に制御し、これらの多重性の調整には、Maurer & Bretzのgraphical approachを用いた。本試験では3つの仮説(H1:キイトルーダ®群のRFSがプラセボ群を上回る、H2:キイトルーダ®群のDMFSがプラセボ群を上回る、H3:キイトルーダ®群のOSがプラセボ群を上回る)を設定した。まず、RFSの仮説に有意水準片側2.5%を配分し、RFSの比較が統計学的に有意であった場合は有意水準片側2.5%をDMFSに再配分する。DMFSの比較が統計学的に有意であった場合は有意水準片側2.5%をOSに再配分することとした。中間解析及び最終解析における有意水準の配分にはα消費関数を用いる。
患者報告アウトカム(PRO)評価: ベースライン、治験薬投与の1年目、2年目は12週間毎、3年目は6ヵ月毎、投与中止日及び最終投与から30日目の安全性評価の来院時に、EORTC QLQ-C30(対象は18歳以上の患者)、EQ-5D-5L(対象は全患者)の質問票を用いてPROを評価した。
※本邦ではキイトルーダ®は小児に対して承認されていません
*1 AJCCガイドライン第8版に基づく
*2 キイトルーダ®は、18歳以上の患者に対しては200mg、12歳以上18歳未満の患者に対しては2mg/kg(最大200mg)をQ3Wで点滴静注
*3 ITT(intention to treat)集団: 無作為化されたすべての患者
*4 APaT(all patients as treated)集団: 無作為化され治験薬を1回以上投与されたすべての患者
*5 FAS(full analysis set)集団:治験薬が1回以上投与され、かつ、1つ以上のPRO評価を実施した患者
6. 用法及び用量(抜粋)
〈悪性黒色腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
患者背景(ITT集団)
※患者背景、有効性及び安全性についてはパート1のデータをご紹介します。
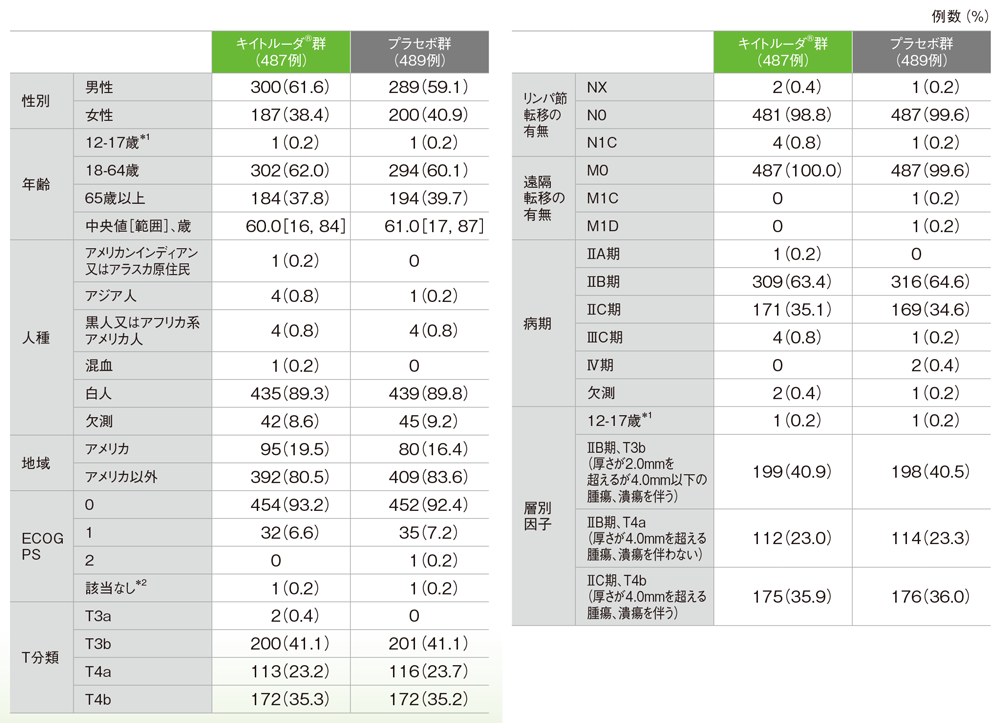
*1 本邦ではキイトルーダ®は小児に対して承認されていない
*2 「該当なし」は小児に対してKarnofsky Performance Status(KPS)で評価された2例である
主要評価項目 無再発生存期間:RFS

- 第1回中間解析(追跡期間中央値: キイトルーダ®群14.4ヵ月、プラセボ群14.2ヵ月)において、プラセボ群に対するキイトルーダ®群のRFSのハザード比は0.65(95%CI: 0.46, 0.92)であり、RFSを有意に延長しました(p=0.00658、層別ログランク検定[片側]、有意水準α=0.0101、検証的解析結果)。
- RFS中央値は、キイトルーダ®群で未到達(95%CI: 22.6, -)、プラセボ群で未到達(95%CI: -, -)でした。
無再発生存期間(RFS)のKaplan-Meier曲線(ITT集団)
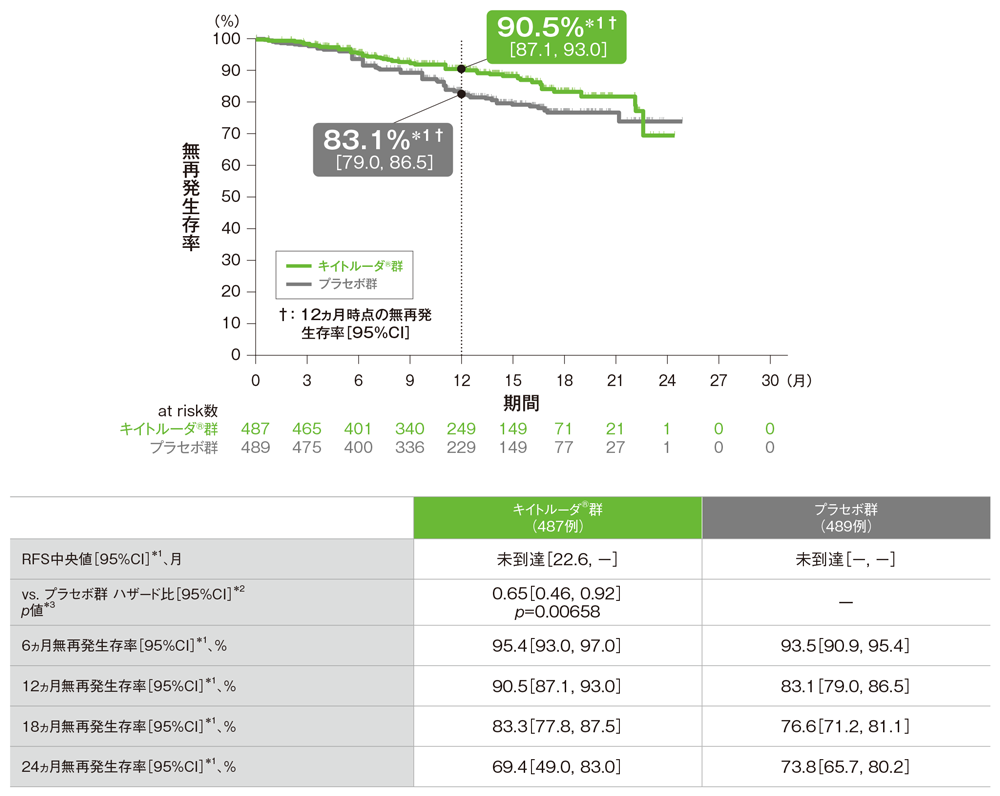
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、T分類の腫瘍の厚さ及び潰瘍形成(T3b、T4a、T4b)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 T分類の腫瘍の厚さ及び潰瘍形成(T3b、T4a、T4b)を層別因子とした層別ログランク検定[片側]、有意水準α=0.0101(検証的解析結果)
(追跡期間中央値: キイトルーダ®群14.4ヵ月[範囲: 1.5, 26.4]、プラセボ群14.2ヵ月[範囲: 1.0, 26.2]、データカットオフ日: 2020年12月4日)
主要評価項目 無再発生存期間:RFS

- 第2回中間解析(追跡期間中央値: キイトルーダ®群20.8ヵ月、プラセボ群20.5ヵ月)において、プラセボ群に対するキイトルーダ®群のRFSのハザード比は0.61(95%CI: 0.45, 0.82)でした(p=0.00046、名目上のp値、層別ログランク検定[片側])。
- RFS中央値は、キイトルーダ®群で未到達(95%CI: -, -)、プラセボ群で未到達(95%CI: 29.9, -)でした。
無再発生存期間(RFS)のKaplan-Meier曲線(ITT集団)
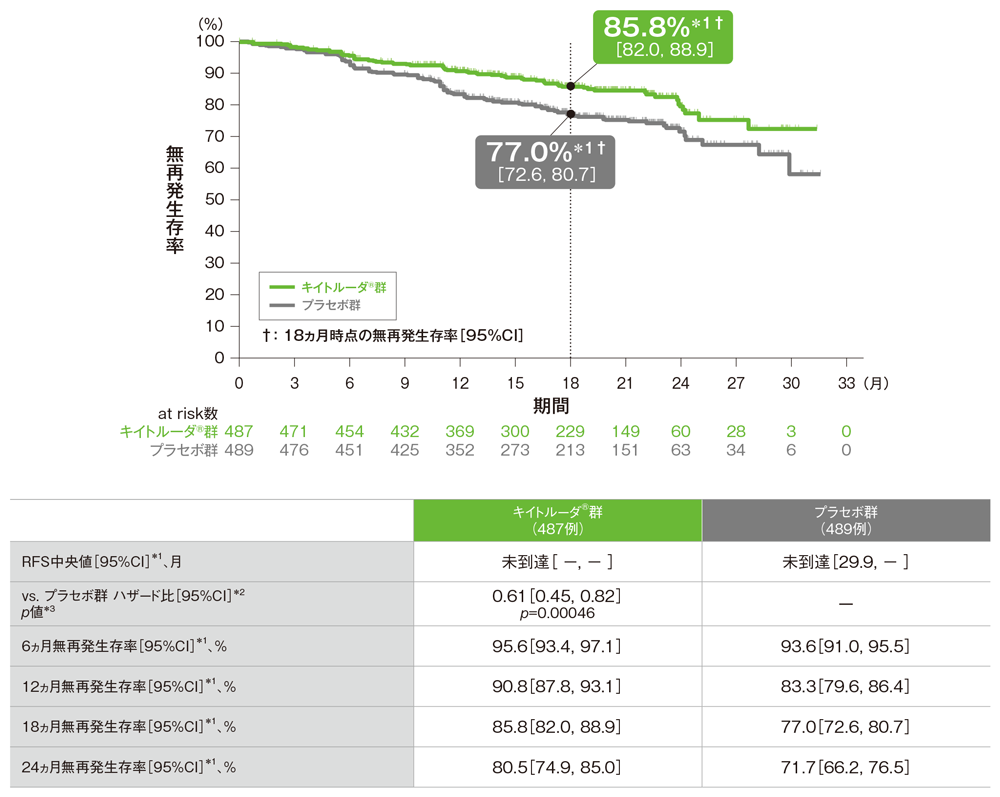
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、T分類の腫瘍の厚さ及び潰瘍形成(T3b、T4a、T4b)を層別因子とした層別Cox比例ハザードモデルに基づく
*3 名目上のp値。T分類の腫瘍の厚さ及び潰瘍形成(T3b、T4a、T4b)を層別因子とした層別ログランク検定[片側]
(追跡期間中央値:キイトルーダ®群20.8ヵ月[範囲: 8.0, 32.6]、プラセボ群20.5ヵ月[範囲: 4.6, 32.7]、データカットオフ日:2021年6月21日)
サブグループ解析 部分集団因子別の無再発生存期間:RFS

無再発生存期間(RFS)のハザード比のフォレストプロット(ITT集団)
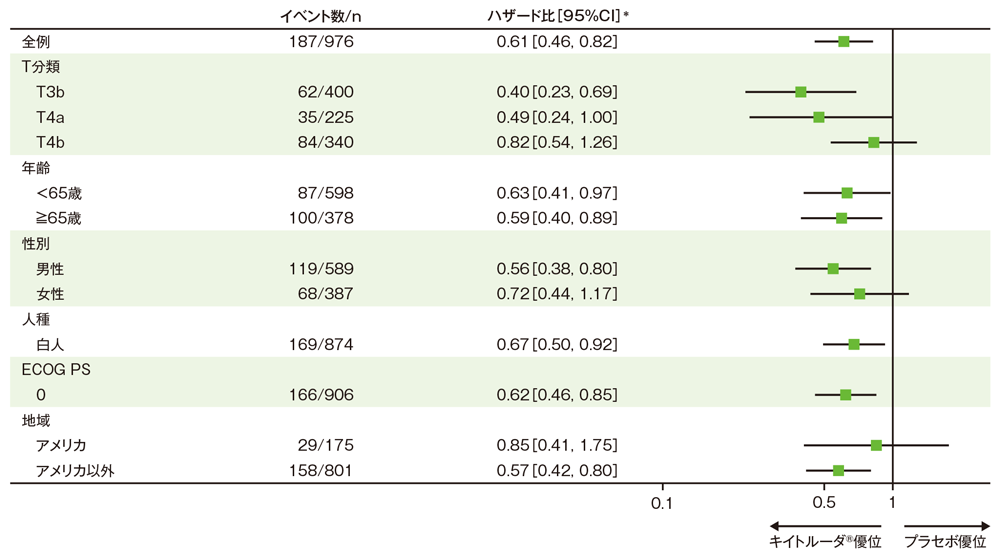
※患者数がITT集団の10%未満のサブグループは表示していない
*全例:投与群を共変量とし、T分類の腫瘍の厚さ及び潰瘍形成(T3b、T4a、T4b)を層別因子とした層別Cox比例ハザードモデルに基づく、全例以外: 投与群を共変量としたCox比例ハザードモデルに基づく
(追跡期間中央値:キイトルーダ®群20.8ヵ月[範囲: 8.0, 32.6]、プラセボ群20.5ヵ月[範囲: 4.6, 32.7]、データカットオフ日:2021年6月21日)
安全性

キイトルーダ®群
- 副作用は400/483例(82.8%)に認められ、主な副作用(発現率10%以上)はそう痒症117例(24.2%)、疲労102例(21.1%)、下痢90例(18.6%)、関節痛78例(16.1%)、発疹76例(15.7%)、甲状腺機能低下症75例(15.5%)でした。
- 重篤な副作用は46例(9.5%)に認められ、2例以上にみられた重篤な副作用は副腎機能不全、大腸炎各4例(0.8%)、自己免疫性肝炎3例(0.6%)、急性腎障害、自己免疫性大腸炎、自己免疫性腎炎、下痢、下垂体炎、下垂体機能低下症、免疫性肺疾患、重症筋無力症、筋炎、1型糖尿病各2例(0.4%)でした。
- 副作用による投与中止は79例(16.4%)に認められ、2例以上にみられた投与中止に至った副作用は自己免疫性肝炎6例(1.2%)、大腸炎5例(1.0%)、関節痛4例(0.8%)、副腎機能不全、アラニンアミノトランスフェラーゼ増加、発疹各3例(0.6%)、下垂体炎、下垂体機能低下症、甲状腺機能低下症、下痢、肝炎、肝毒性、関節炎、筋炎、多発性関節炎、自己免疫性腎炎、肺サルコイドーシス各2例(0.4%)でした。
- 副作用による死亡は認められませんでした。
プラセボ群
- 副作用は308/486例(63.4%)に認められ、主な副作用(発現率10%以上)は疲労88例(18.1%)、下痢54例(11.1%)、そう痒症51例(10.5%)でした。
- 重篤な副作用は9例(1.9%)に認められ、その内訳は自己免疫性肝炎、下痢、自己免疫性心筋炎、心不全、顔面麻痺、注入に伴う反応、注入部位蕁麻疹、神経痛性筋萎縮症、発熱各1例(0.2%)でした。
- 副作用による投与中止は12例(2.5%)に認められ、2例以上にみられた投与中止に至った副作用は下痢、自己免疫性肝炎各2例(0.4%)でした。
- 副作用による死亡は認められませんでした。
主な副作用(いずれかの投与群で発現率5%以上)(APaT集団)
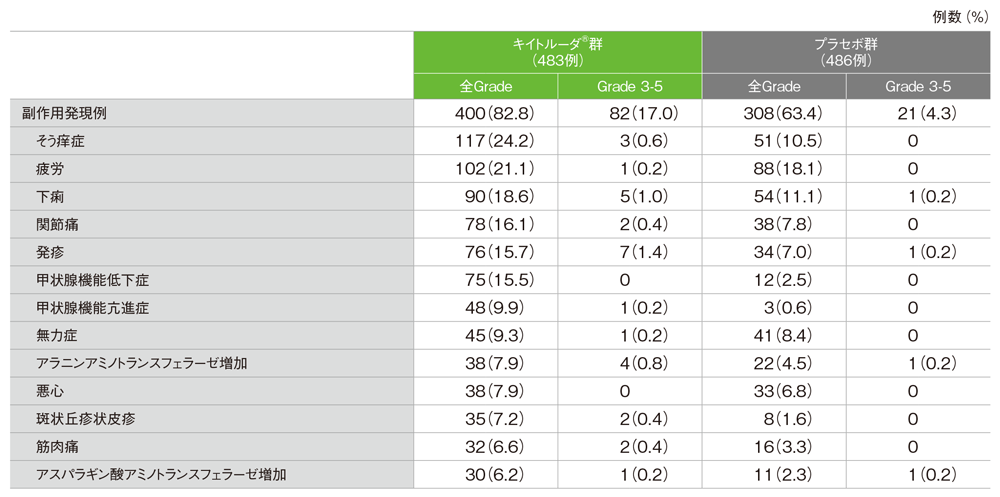
MedDRA/J v24.0、GradeはCTCAE v4.03
(追跡期間中央値:キイトルーダ®群20.8ヵ月[範囲: 8.0, 32.6]、プラセボ群20.5ヵ月[範囲: 4.6, 32.7]、データカットオフ日:2021年6月21日)