副反応
11. 副反応
次の副反応があらわれることがあるので、観察を十分に行い、異常が認められた場合には適切な処置を行うこと。
11.1 重大な副反応
11.1.1 ショック、アナフィラキシー(頻度不明注1))
ショック、アナフィラキシーを含む重度のアレルギー反応があらわれることがある。
注1)本剤との因果関係を示す症例が臨床試験では報告されていないため頻度不明とした。
11.1.2 痙攣(熱性痙攣を含む)(0.3%注2))
注2)発現頻度は小児を対象とした臨床試験に基づき算出した。
11.2 その他の副反応
〈高齢者又は肺炎球菌による疾患に罹患するリスクが高いと考えられる18歳以上の者における肺炎球菌による感染症の予防〉
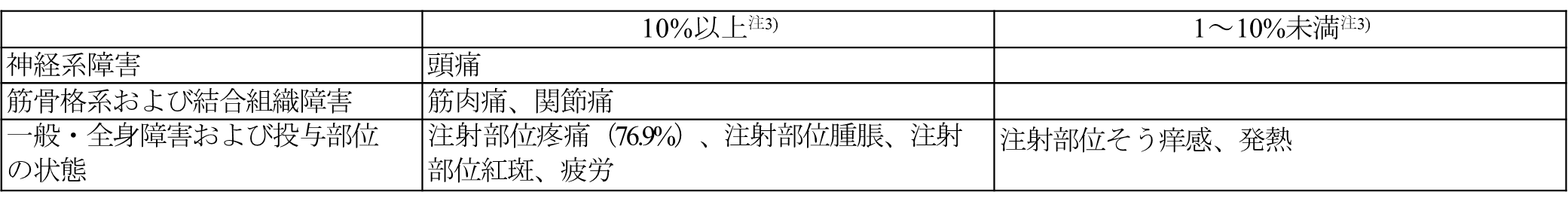
注3)発現頻度は、017試験(免疫能が正常な18~49歳の成人のうち、肺炎球菌感染症に対するリスク因子を1つ又は2つ以上持つ部分集団のデータ)、018試験(HIVに感染した18歳以上の成人を対象とした試験)及び019試験(肺炎球菌ワクチン接種歴がない成人のうち、65歳以上の部分集団のデータ)に基づき算出した。
〈小児における肺炎球菌による侵襲性感染症の予防又は肺炎球菌による疾患に罹患するリスクが高いと考えられる18歳未満の者における肺炎球菌による感染症の予防〉
2歳未満
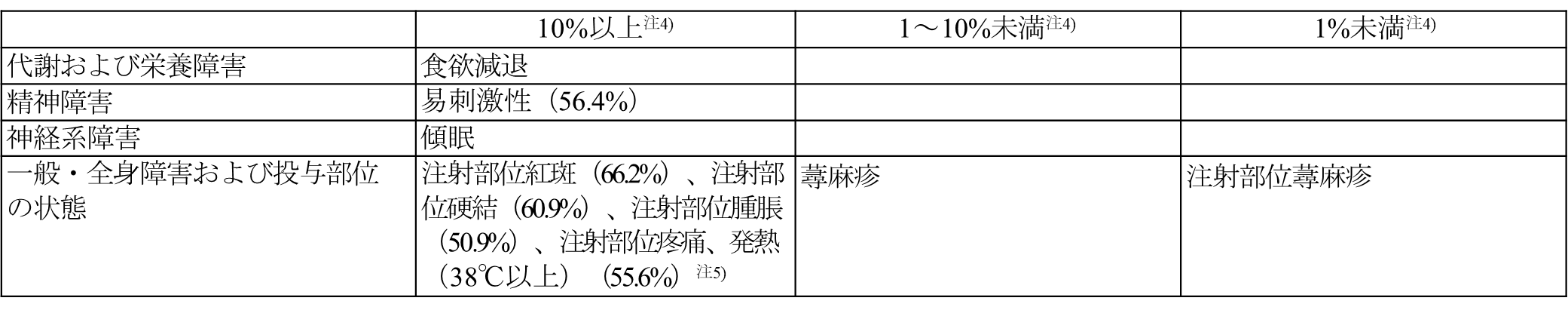
注4)発現頻度は、033試験、024試験(7~11か月齢、12~23か月齢の部分集団のデータ)及び統合解析[027試験(本剤4回接種の第5群の部分集団のデータ)、029試験及び031試験]に基づき算出した。
注5)40℃以上の発熱の発現頻度は3.2%である。
2歳以上

注6)発現頻度は、024試験(2~17歳の部分集団のデータ)、023試験(鎌状赤血球症を有する5~17歳の被験者を対象とした試験)及び030試験(HIVに感染した6~17歳の被験者を対象とした試験)に基づき算出した。
