1次治療:KEYNOTE-A39試験/EV-302試験(解析時点2)
主要評価項目 無増悪生存期間(PFS)

PFSのKaplan-Meier曲線(ITT集団)
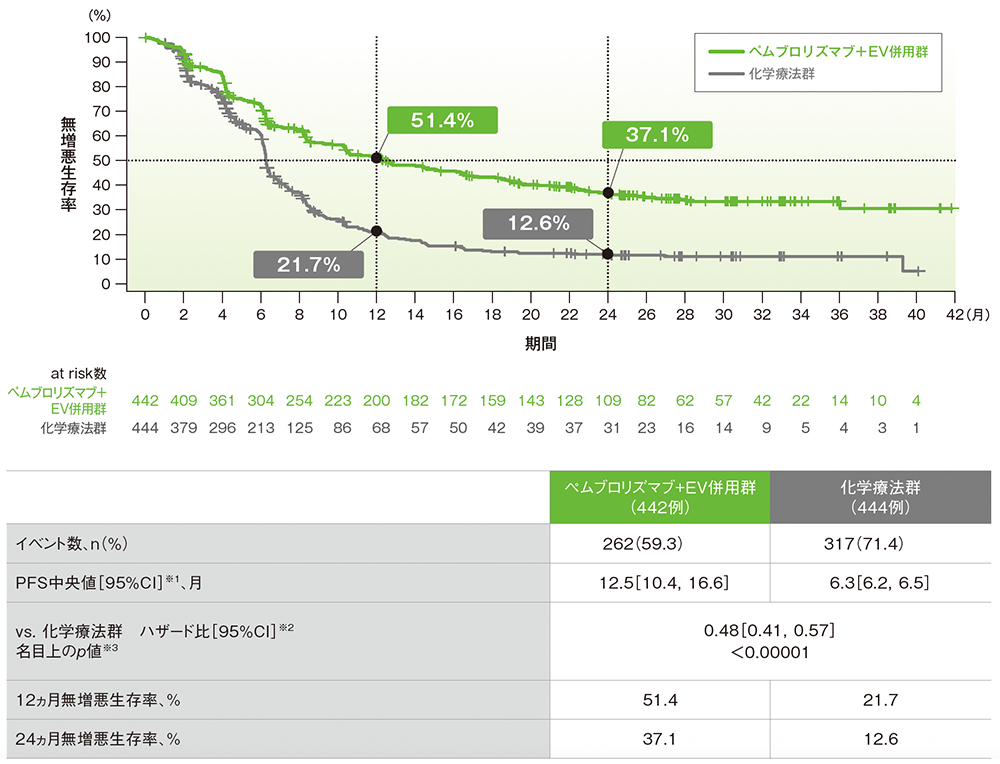
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2024年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別ログランク検定[両側]
- 追跡期間中央値29.1ヵ月において、キイトルーダ®+EV併用群の化学療法群に対する有意差が認められました(ハザード比:0.48[95%CI:0.41,0.57]、名目上のp<0.00001、層別ログランク検定)。
- PFS中央値は、キイトルーダ®+EV併用群で12.5ヵ月(95%CI:10.4,16.6)、化学療法群で6.3ヵ月(95%CI:6.2,6.5)でした。
サブグループ解析 無増悪生存期間(PFS)

PFSのハザード比のフォレストプロット(ITT集団)
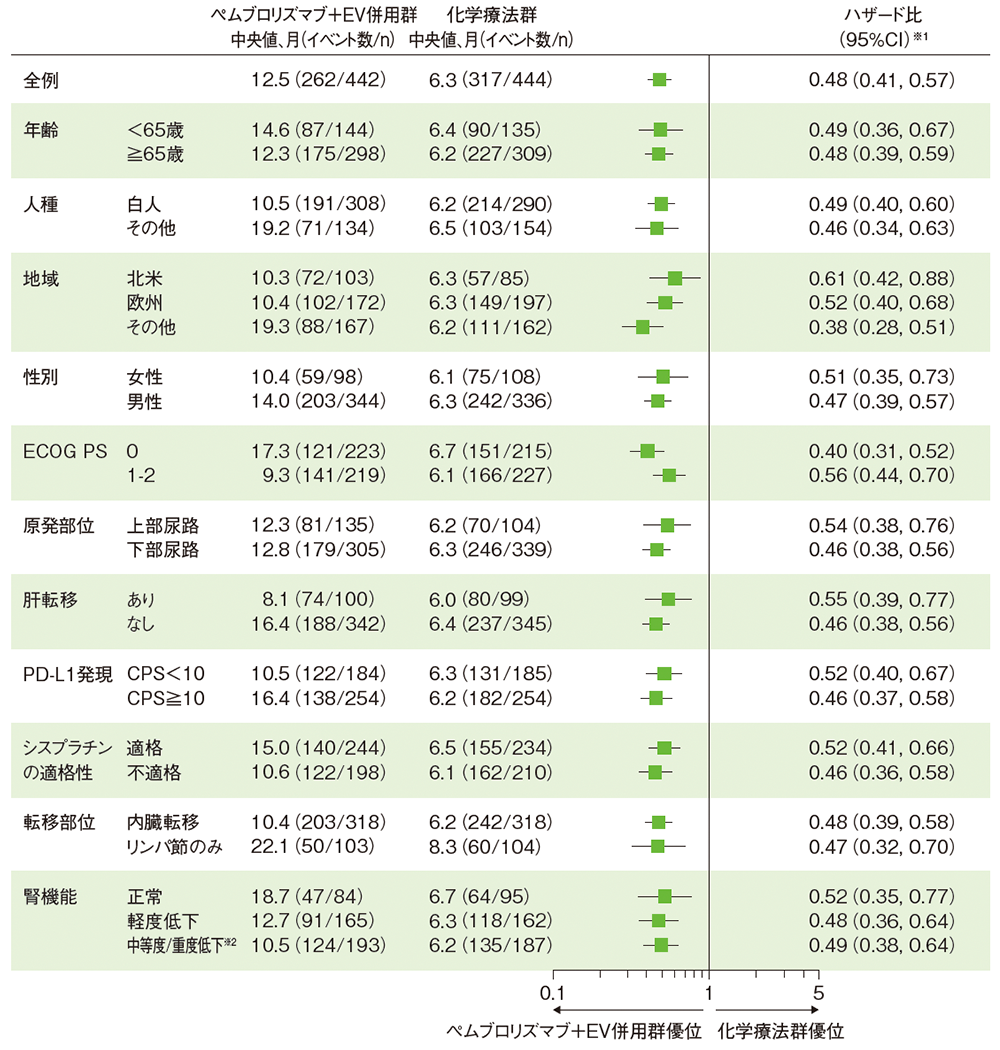
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2024年8月8日
シスプラチン適格性及び肝転移の有無のサブグループは、無作為化補正後のCRF(case report form)に基づく
PD-L1発現のサブグループは、QC(quality control)後の検査結果に基づく
※1 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
※2 十分な例数がいない場合、2つ以上のサブグループ変数を併合することが規定された
主要評価項目 全生存期間(OS)

OSのKaplan-Meier曲線(ITT集団)
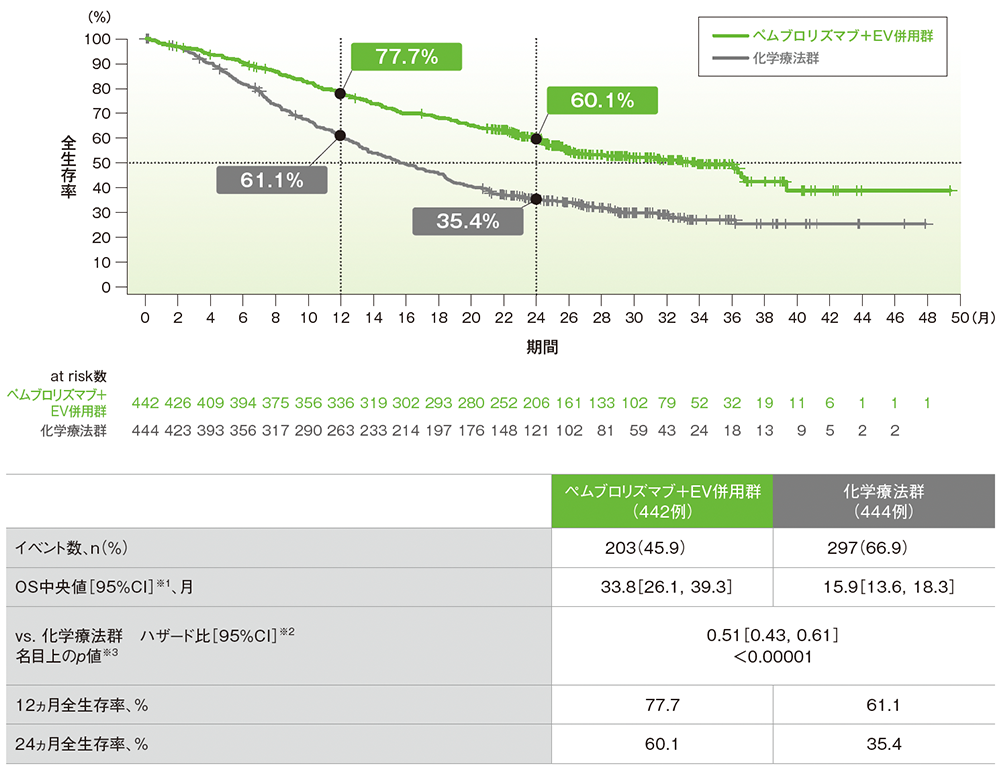
データカットオフ日:2024年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別ログランク検定[両側]
- 追跡期間中央値29.1ヵ月において、キイトルーダ®+EV併用群の化学療法群に対する有意差が認められました(ハザード比:0.51[95%CI:0.43,0.61]、名目上のp<0.00001、層別ログランク検定)。
- OS中央値は、キイトルーダ®+EV併用群で33.8ヵ月(95%CI:26.1,39.3)、化学療法群で15.9ヵ月(95%CI:13.6,18.3)でした。
サブグループ解析 全生存期間(OS)

OSのハザード比のフォレストプロット(ITT集団)
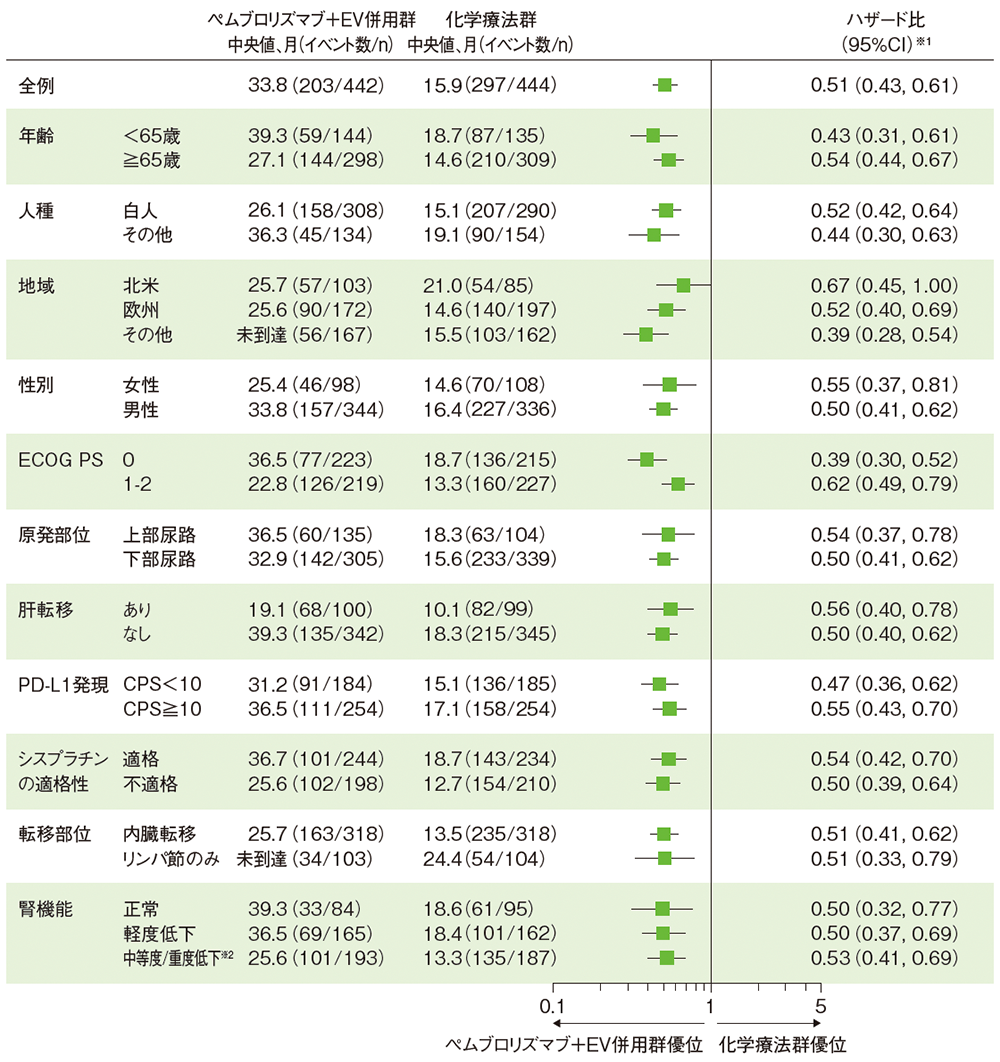
データカットオフ日:2024年8月8日
シスプラチン適格性及び肝転移の有無のサブグループは、無作為化補正後のCRF(case report form)に基づく
PD-L1発現のサブグループは、QC(quality control)後の検査結果に基づく
※1 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
※2 十分な例数がいない場合、2つ以上のサブグループ変数を併合することが規定された
サブグループ解析 シスプラチン適格性別の全生存期間(OS)

シスプラチン適格患者におけるOSのKaplan-Meier曲線
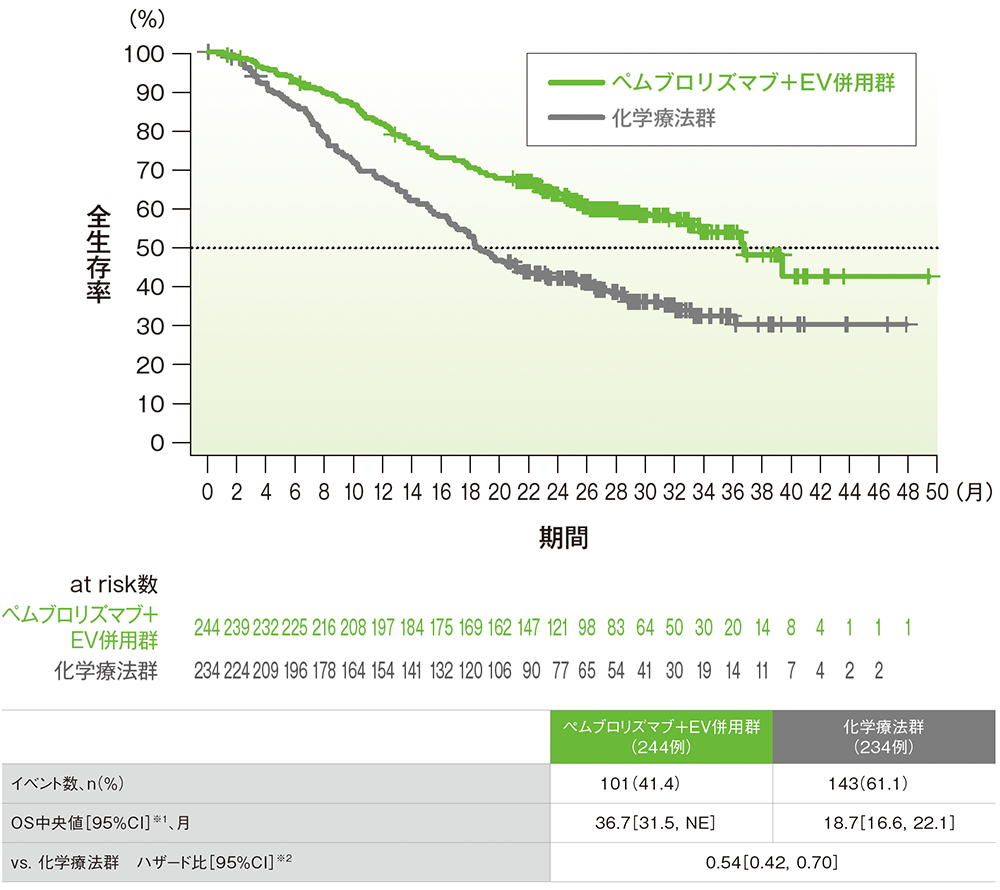
データカットオフ日:2024年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した

シスプラチン不適格患者におけるOSのKaplan-Meier曲線
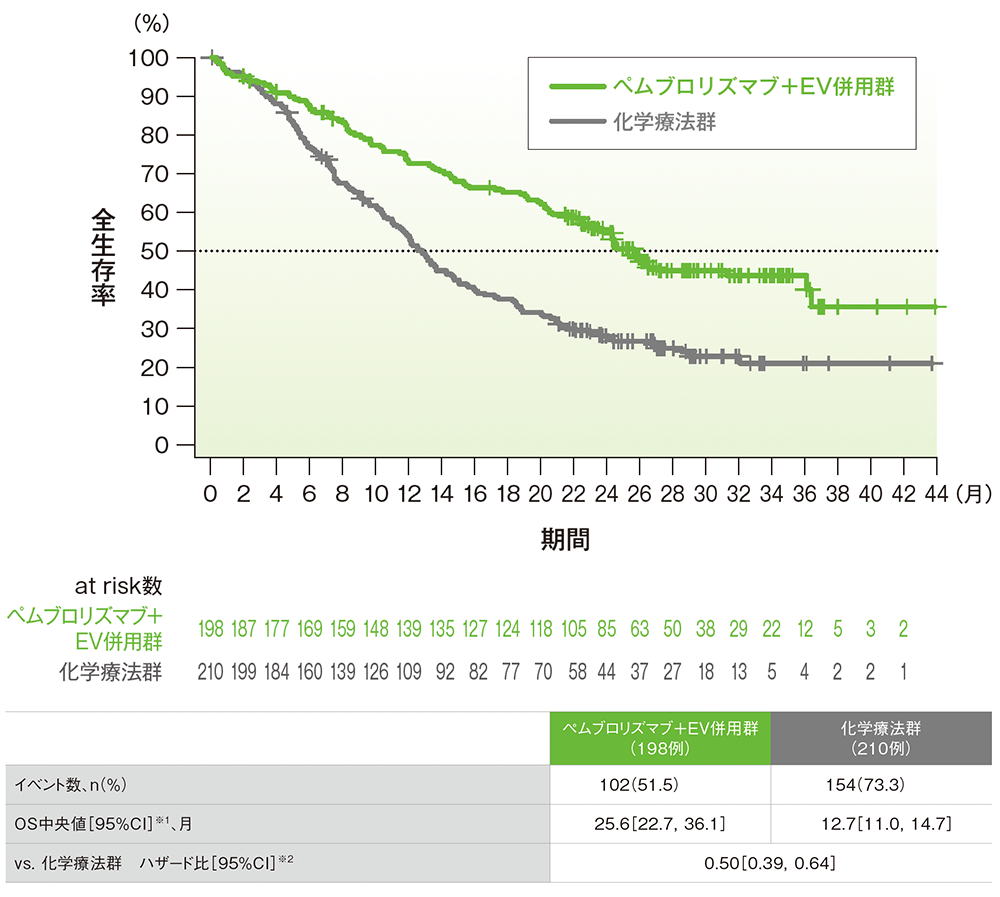
データカットオフ日:2024年8月8日
※1 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cox比例ハザードモデルに基づく。サブグループが層別因子である場合、層別モデルは残りの層別因子で調整した
副次評価項目 奏効率(ORR)

ORR:CR+PR(奏効評価対象集団)
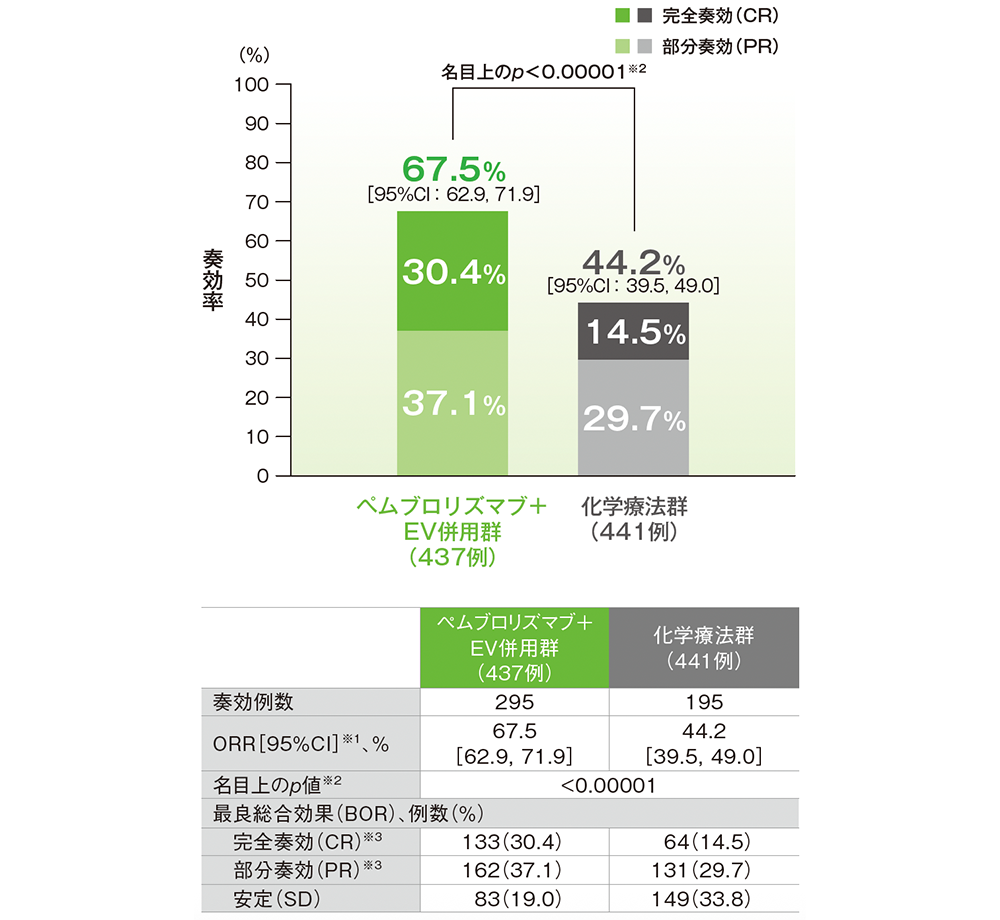
RECISTガイドライン1.1版に基づくBICRによる評価
PD、NE、NAは論文中に記載なし
データカットオフ日:2024年8月8日
※1 Clopper-Pearson法に基づく
※2 無作為化に用いた層別因子[シスプラチンの適格性(適格、不適格)、PD-L1発現(CPS≧10、CPS<10)、肝転移の有無(あり、なし)]を層別因子とした層別Cochran-Mantel-Haenszel(CMH)検定[両側]
※3 最初の奏効から28日以上あけて評価した
- 追跡期間中央値29.1ヵ月において、ORRは、キイトルーダ®+EV併用群で67.5%(95%CI:62.9,71.9)、化学療法群で44.2%(95%CI:39.5,49.0)であり、キイトルーダ®+EV併用群の化学療法群に対する有意差が認められました(名目上のp<0.00001、層別Cochran-Mantel-Haenszel[CMH]検定[両側])。
副次評価項目 奏効期間(DOR)

奏効が確定した患者におけるDORのKaplan-Meier曲線(奏効評価対象集団)
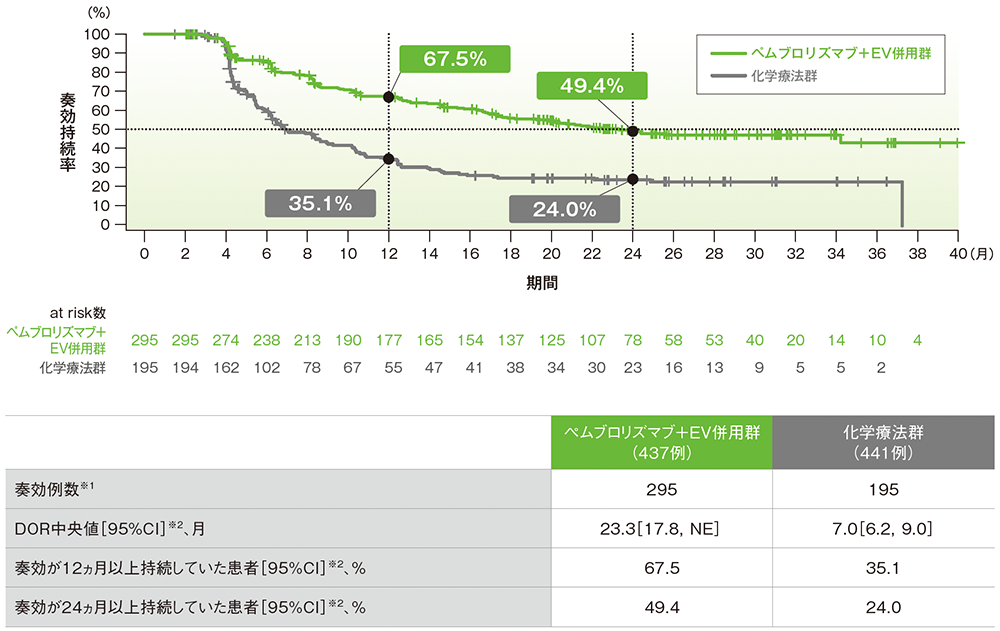
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2024年8月8日
※1 CR又はPRが認められた患者数
※2 打ち切りデータはKaplan-Meier法、95%CIは二重対数変換に基づく
- 追跡期間中央値29.1ヵ月において、DOR中央値はキイトルーダ®+EV併用群で23.3ヵ月(95%CI:17.8,NE)、化学療法群で7.0ヵ月(95%CI:6.2,9.0)でした。
-
奏効が24ヵ月以上持続した割合は、キイトルーダ®+EV併用群で49.4%、化学療法群で24.0%
でした。
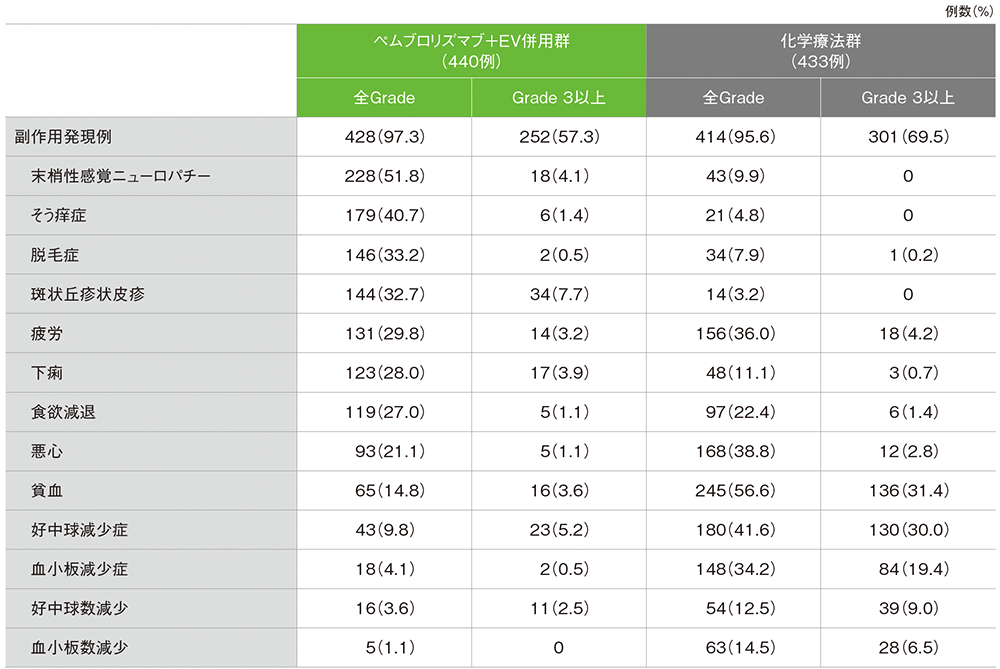
安全性 主な副作用(ASaT集団)

追跡期間29.1ヵ月における副作用は、キイトルーダ®+EV併用群440例中428例(97.3%)、化学療法群433例中414例(95.6%)に認められました。
Grade 3以上の副作用は、キイトルーダ®+EV併用群で252例(57.3%)、化学療法群301例(69.5%)に認められました。
発現割合20% 以上の主な副作用は、キイトルーダ®+EV併用群で末梢性感覚ニューロパチー228例(51.8%)、そう痒症179例(40.7%)、脱毛症146例(33.2%)、斑状丘疹状皮疹144例(32.7%)、疲労131例(29.8%)、下痢123例(28.0%)、食欲減退119例(27.0%)、悪心93例(21.1%)、化学療法群で貧血245例(56.6%)、好中球減少症180例(41.6%)、悪心168例(38.8%)、疲労156例(36.0%)、血小板減少症148例(34.2%)、食欲減退97例(22.4%)でした。
主な副作用(いずれかの投与群で発現割合20%以上の副作用、又はいずれかの投与群で発現割合5%以上のGrade 3以上の副作用)
治験担当医師による評価、データカットオフ日:2024年8月8日
キイトルーダ®+EV併用群において、重篤な副作用が129例(29.3%)、EVの投与中止に至った副作用が160例(36.4%)、キイトルーダ®の投与中止に至った副作用が109例(24.8%)、いずれかの薬剤の投与中止に至った副作用が188例(42.7%)に認められました。重篤な副作用、EVの投与中止に至った副作用、キイトルーダ®の投与中止に至った副作用及びいずれかの薬剤の投与中止に至った副作用の内訳については、文献中に記載なしでした。
死亡に至った副作用は5例(1.1%)に認められ、内訳は多臓器機能不全症候群、無力症、下痢、免疫性肺疾患、肺臓炎各1例でした。
化学療法群では、重篤な副作用が85例(19.6%)、いずれかの薬剤の投与中止に至った副作用が80例(18.5%)に認められました。重篤な副作用及びいずれかの薬剤の投与中止に至った副作用の内訳については、文献中に記載なしでした。
死亡に至った副作用は4例(0.9%)に認められ、内訳は敗血症、発熱性好中球減少症、心筋梗塞、好中球減少性敗血症各1例でした。
安全性 キイトルーダ®の免疫関連など特に注目すべき有害事象(ASaT集団)

追跡期間29.1ヵ月におけるキイトルーダ®の免疫関連など特に注目すべき有害事象です。
キイトルーダ®の免疫関連など特に注目すべき有害事象
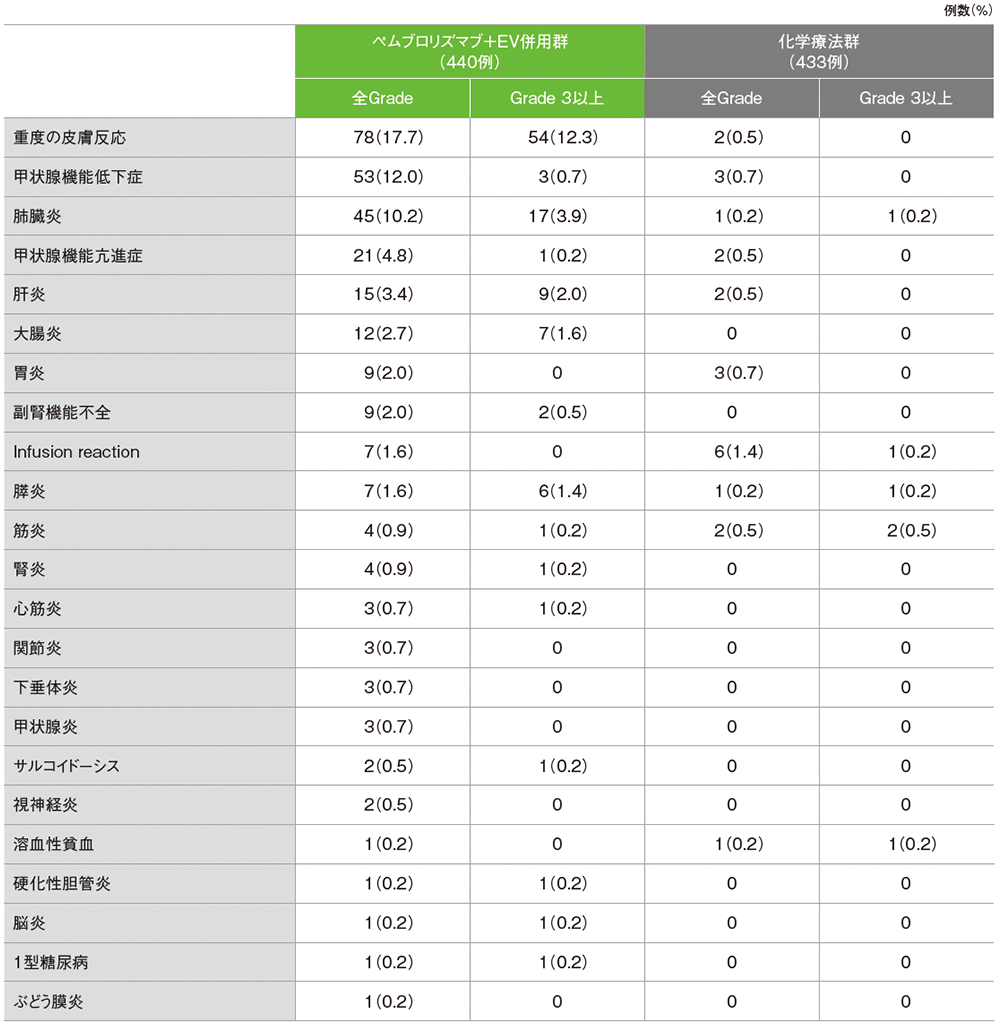
データカットオフ日:2024年8月8日
安全性 EVの特に注目すべき有害事象(ASaT集団)

EVの特に注目すべき有害事象
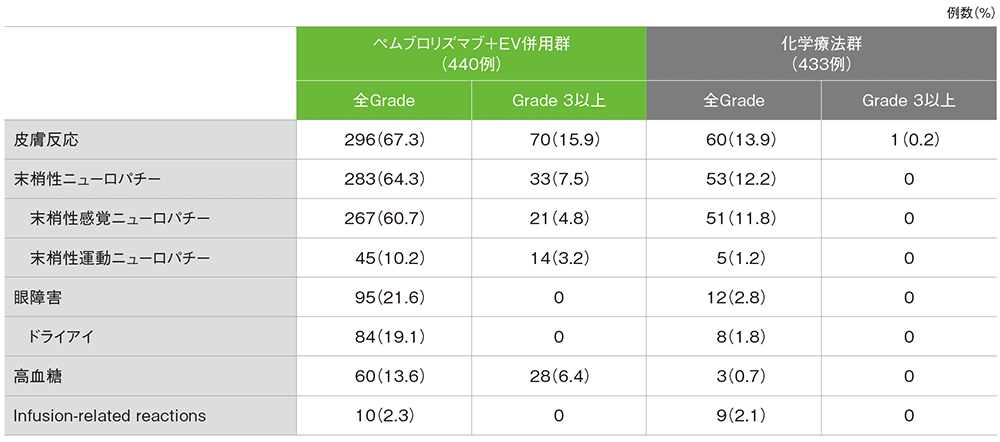
データカットオフ日:2024年8月8日
後治療(ITT集団)

後治療
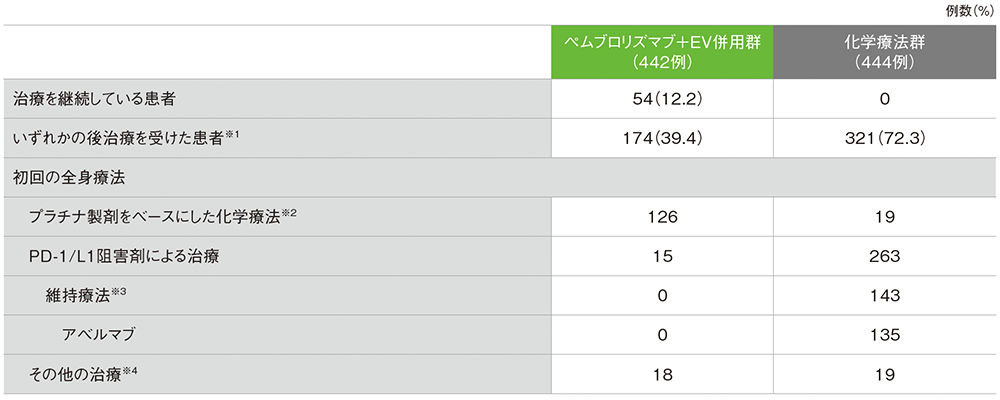
※1 治験薬の投与中止後の、プロトコールで規定されていない治療。緩和的放射線治療、根治的放射線治療、全身療法又は手術を含む
※2 プラチナ製剤をベースにした化学療法とPD-1/L1製剤を併用した場合は、プラチナ製剤をベースにした化学療法に分類された
※3 同一治療ラインで、複数のPD-1/L1製剤の投与を受けることが可能であった
※4 初回の全身療法としてのその他の治療は、ペムブロリズマブ+EV併用群ではEV及びサシツズマブ ゴビテカン、化学療法群ではタキサン系薬剤及びEVを含む。サシツズマブ ゴビテカンの尿路上皮癌への使用は国内適応外
カルボプラチンの効能又は効果は以下のとおりです。
4. 効能又は効果(抜粋)
○頭頸部癌、肺小細胞癌、睾丸腫瘍、卵巣癌、子宮頸癌、悪性リンパ腫、非小細胞肺癌、乳癌、子宮体癌
○以下の悪性腫瘍に対する他の抗悪性腫瘍剤との併用療法
小児悪性固形腫瘍(神経芽腫・網膜芽腫・肝芽腫・中枢神経系胚細胞腫瘍、再発又は難治性のユーイング肉腫ファミリー腫瘍・腎芽腫)
キイトルーダ®の電子添文は以下のとおりです。
4. 効能又は効果(抜粋)根治切除不能な尿路上皮癌
5. 効能又は効果に関連する注意(抜粋)
5.6 本剤の手術の補助療法としての有効性及び安全性は確立していない。
5.7 白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療患者への本剤単独投与については、他の治療の実施についても慎重に検討すること。
6. 用法及び用量(抜粋)
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7. 用法及び用量に関連する注意(抜粋)
7.3 エンホルツマブ ベドチン(遺伝子組換え)以外の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.4 白金系抗悪性腫瘍剤を含む化学療法の適応となる化学療法未治療患者に対する本剤単独投与の有効性及び安全性は確立していない。
サシツズマブ ゴビテカンの効能又は効果は以下のとおりです。
4. 効能又は効果
化学療法歴のあるホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
関連コンテンツ
キイトルーダ®・悪性腫瘍関連領域情報


キイトルーダ®治療日誌:<頭頸部癌>キイトルーダ®術後補助療法
KEYNOTE-689試験
国際共同第Ⅲ相試験(KEYNOTE-689試験) 承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-689試験) Uppaluri R, et al. N […]