KEYNOTE-087試験
古典的ホジキンリンパ腫:国際共同臨床試験成績:国際共同第Ⅱ相試験 <KEYNOTE-087試験>
承認時評価資料:国際共同第Ⅱ相試験(KEYNOTE-087試験)
Chen R et al. J Clin Oncol 2017; 35: 2125-2132
Chen R et al. Blood 2019; 134: 1144-1153
本試験はMSD社の支援を受け行われた。Robert ChenはMSD社から顧問料などを受領している。また、著者のうち、Yinghua Zhang、Alejandro D. Ricart、Arun BalakumaranはMSD社の社員である。その他の著者にMSD社より講演料、顧問料などを受領している者が含まれる。
試験概要
【目的】再発又は難治性の古典的ホジキンリンパ腫患者におけるキイトルーダ®の有効性及び安全性を検討する。
【デザイン】国際共同非無作為化第Ⅱ相試験
【対象】再発又は難治性の古典的ホジキンリンパ腫患者210例(日本人患者10例を含む)
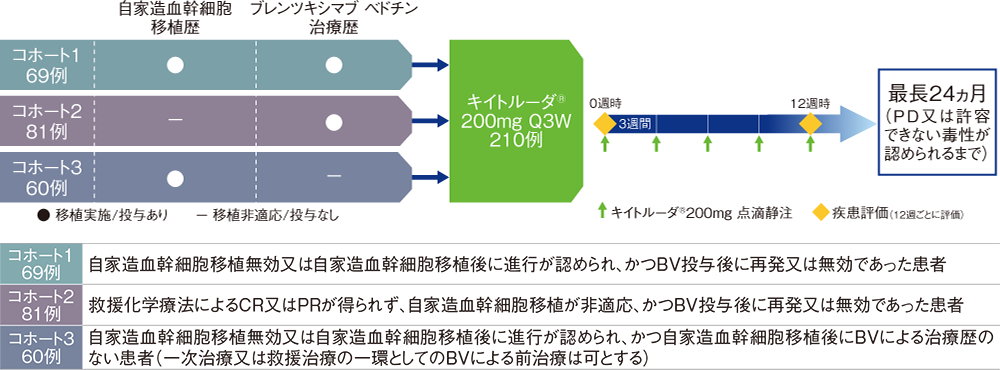
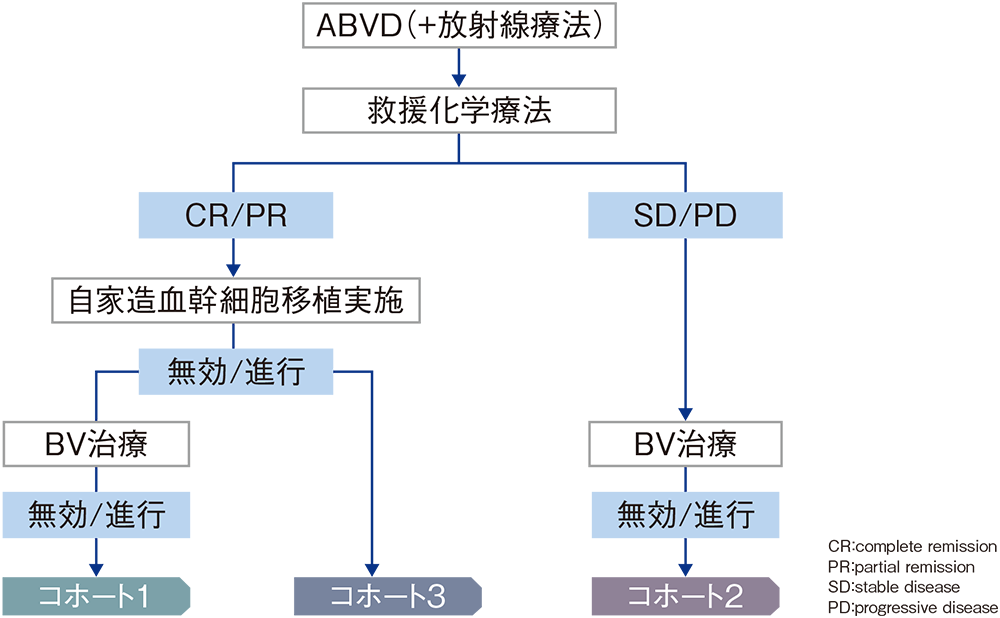
【方法】疾患の状態及び前治療歴により3つのコホートに組み入れ、キイトルーダ®200mgを3週間間隔(Q3W)で点滴静注した。キイトルーダ®の投与は疾患進行(PD)又は許容できない毒性が認められるまで、最長24ヵ月継続した。
BV:ブレンツキシマブ ベドチン CR:完全奏効 PR:部分奏効 Q3W:3週間間隔投与
■ KEYNOTE-087試験における治療アルゴリズム例
監修: 山形大学大学院医学系研究科内科学第三講座 血液・細胞治療内科学分野
教授 石澤 賢一 先生
【評価項目】主要評価項目: 奏効率(overall response rate; ORR)、安全性
副次評価項目: 完全奏効率(complete remission rate; CRR)、奏効期間(duration of response; DOR)、無増悪生存期間(progression free survival; PFS)、全生存期間(overall survival; OS)など
【判定基準】有効性評価は、盲検下独立中央判定によりIWGの効果判定基準(2007)に基づき評価した。
【解析計画】解析対象は有効性及び安全性ともにASaT集団*とし、各評価項目について全体集団及びコホート別での解析を実施した。また、有効性をさらに検討するため前治療数が異なる次のサブグループでORR及びCRRを検討した。サブグループは、「前治療数3以上の治療後に再発した患者」「少なくとも1つの前治療に抵抗性であった患者」「primary refractory患者[一次治療に抵抗性であった患者]」「いずれの前治療に対しても抵抗性であった患者」「BV未治療の患者」などとした。
ORR及びCRRについては点推定値及びClopper-Pearsonによる正確な両側95%信頼区間(CI)を算出し、DOR、PFS及びOSについてはKaplan-Meier法を用いて推定した。ORRはヒストリカルコントロールから設定した値(ORR: 20%)を用いて、有意水準片側2.5%で二項分布に基づく正確検定を実施した。
ORRの主要解析は、最後に投与した患者の12週の評価を実施した時点、もしくは、投与を中止した時点で解析を実施し、その時点で副次評価項目の解析も実施した。さらに24週の評価を実施した時点、1年後及び2年後にも解析を実施し、有効性評価項目の結果を更新することとした。
*ASaT集団(All Subjects as Treated):治験薬を1回以上投与されたすべての患者
4. 効能又は効果(抜粋)
〇再発又は難治性の古典的ホジキンリンパ腫
5. 効能又は効果に関連する注意(抜粋)
〈再発又は難治性の古典的ホジキンリンパ腫〉
5.5 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.11、17.1.12参照]
9. 特定の背景を有する患者に関する注意(抜粋)
9.1 合併症・既往歴等のある患者
9.1.3 臓器移植歴(造血幹細胞移植歴を含む)のある患者
本剤の投与により移植臓器に対する拒絶反応又は移植片対宿主病が発現するおそれがある。
15. その他の注意(抜粋)
15.1 臨床使用に基づく情報
15.1.2 臨床試験において、本剤による治療後に同種造血幹細胞移植が実施された症例で、重篤な移植片対宿主病等の移植関連合併症が認められた。
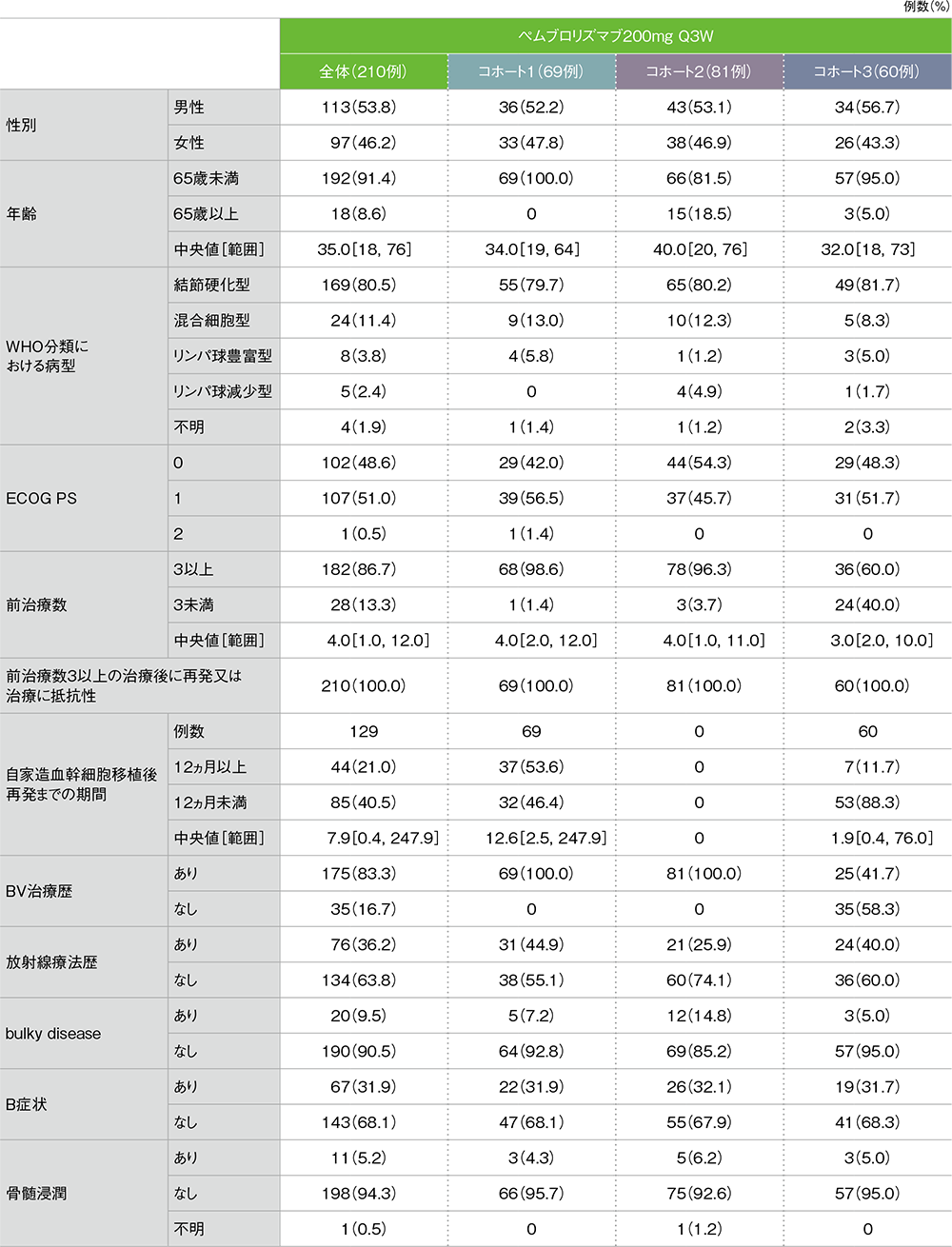
患者背景(ASaT集団)
ECOG:eastern cooperative oncology group PS:performance status BV:ブレンツキシマブ ベドチン
主要評価項目 奏効率:ORR
副次評価項目 完全奏効率:CRR
奏効率(ORR)(ASaT集団)
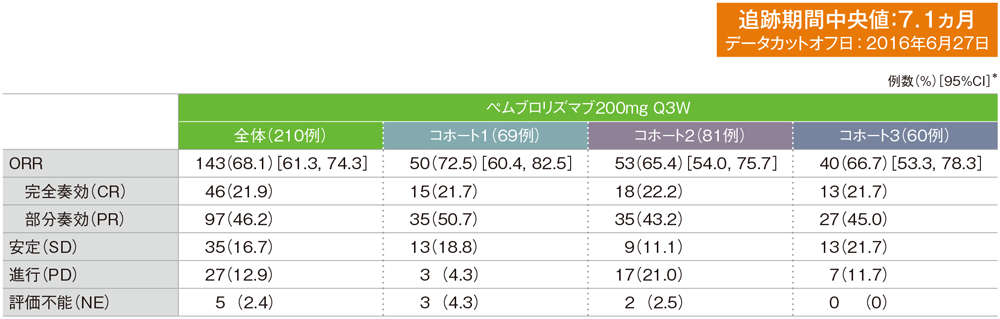
*二項分布の確率計算による正確法
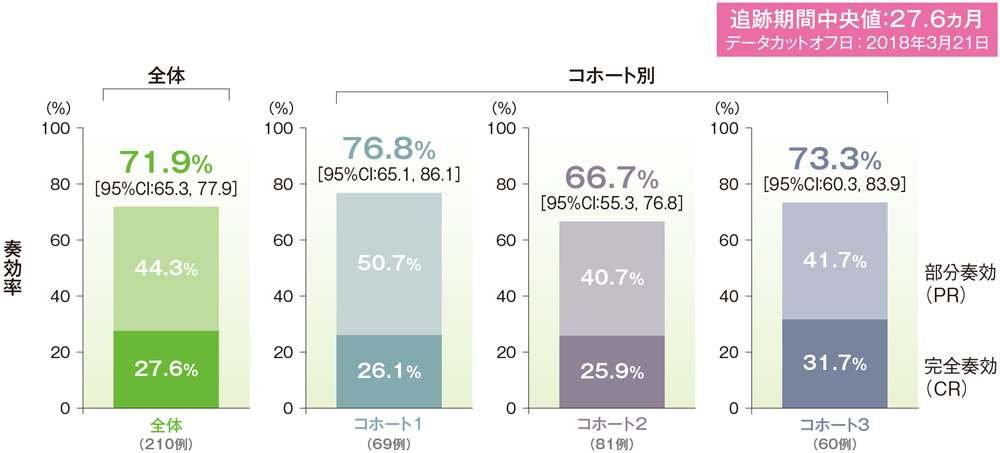

*二項分布の確率計算による正確法
副次評価項目
無増悪生存期間(PFS)
- PFS中央値は、全体13.7ヵ月(95%CI:11.1, 17.0)、コホート1 16.4ヵ月(95%CI:11.3, 27.6)、コホート2 11.1ヵ月(95%CI:7.6, 13.8)、コホート3 19.4ヵ月(95%CI:10.8, 22.1)でした。
無増悪生存期間(PFS)のKaplan-Meier曲線(ASaT集団)
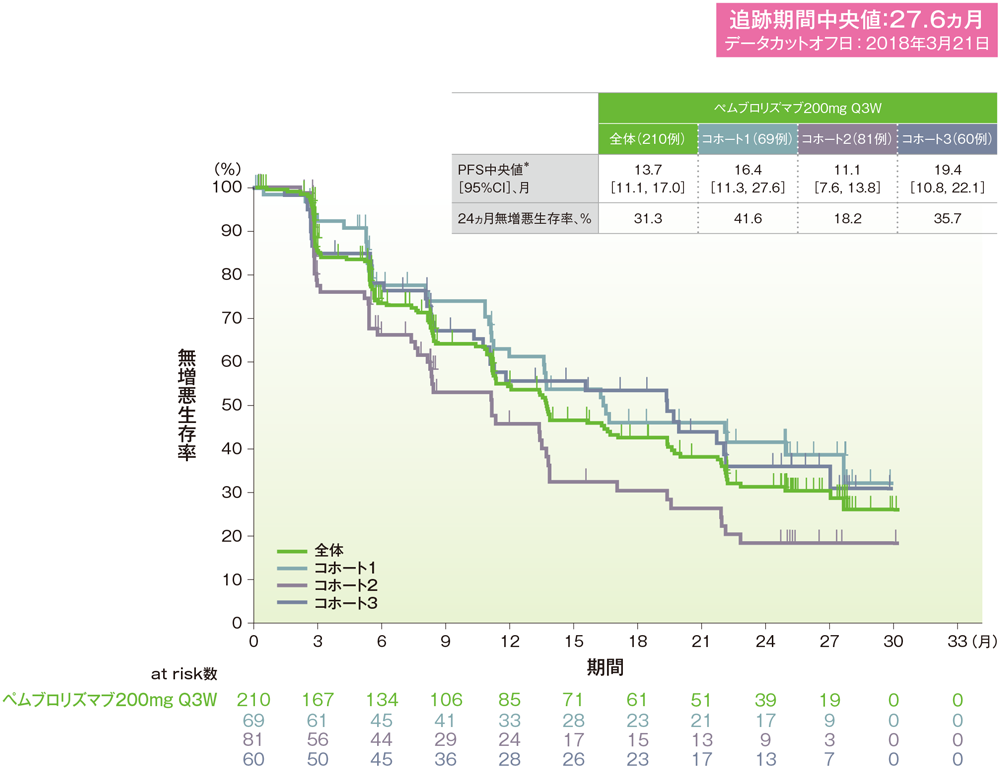
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
副次評価項目
全生存期間(OS)
- OS中央値は、全体、コホート1、コホート2及びコホート3のいずれも未到達(95%CI :未到達, 未到達)でした。
全生存期間(OS)のKaplan-Meier曲線(ASaT集団)
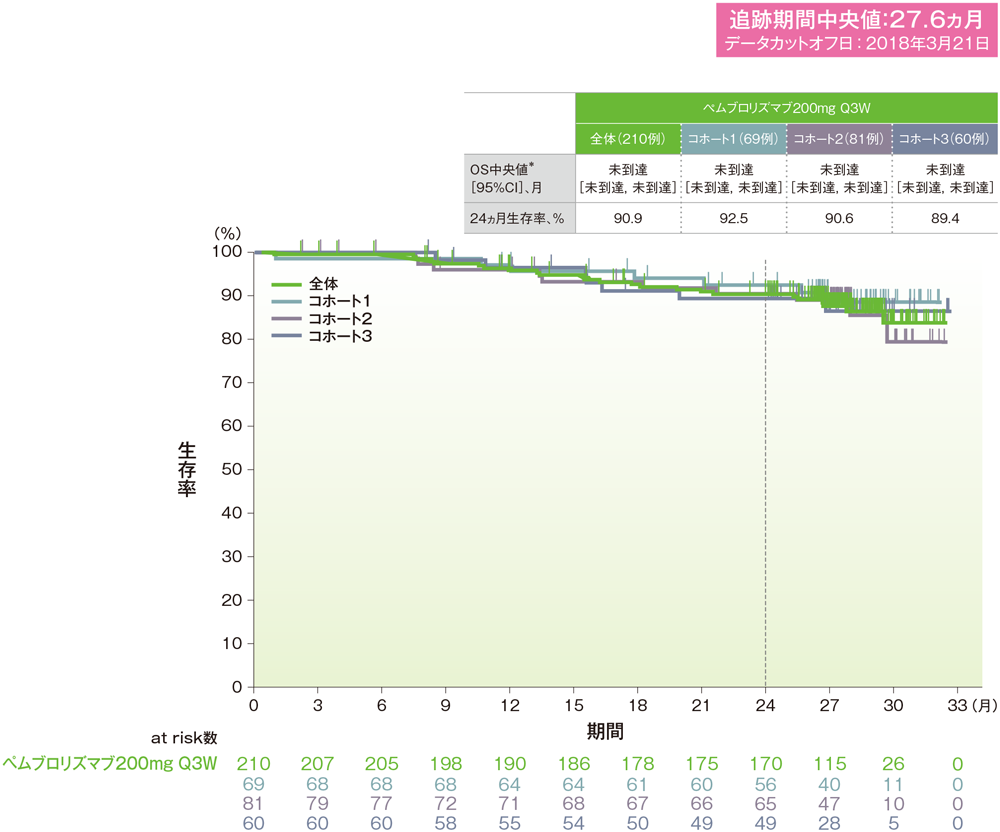
*打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
副次評価項目
奏効期間(DOR)
- 奏効までの期間中央値は全体2.8ヵ月(範囲:2.1, 16.5)、DOR中央値は全体で16.5ヵ月(範囲:0.0+,27.0+)でした。
- 全体で奏効が得られた151例のうち、37例(24.5%)が奏効を持続していました。
奏効期間(DOR)のKaplan-Meier曲線(ASaT集団)
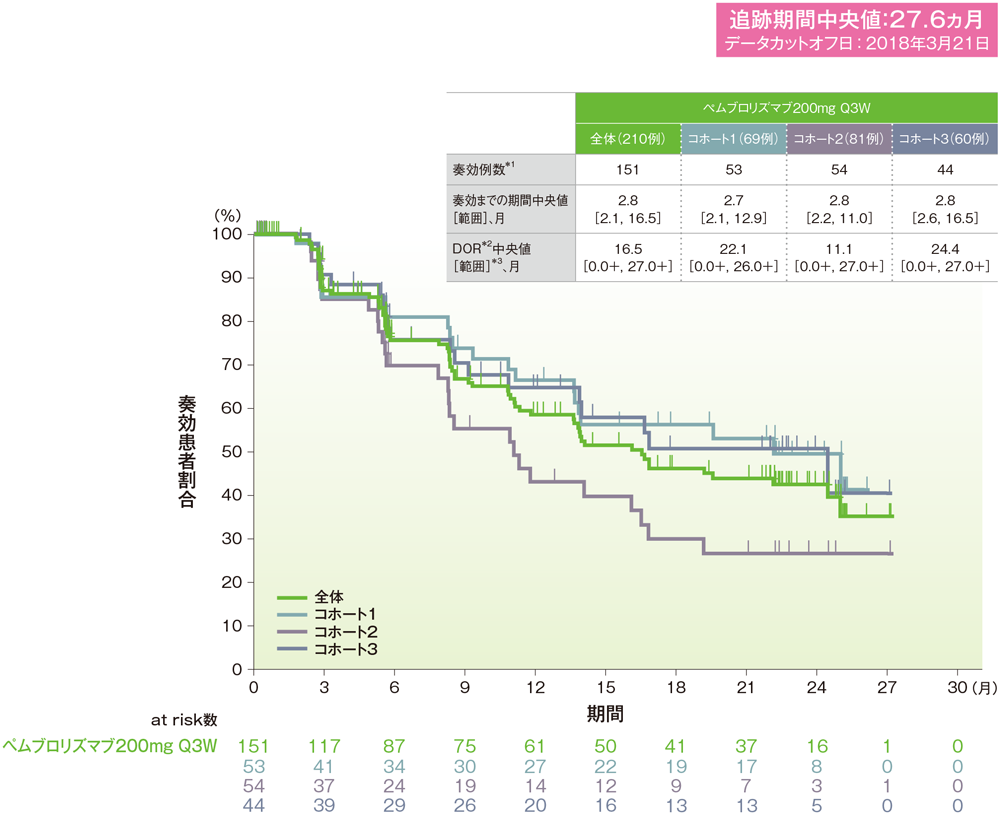
*1 CRあるいはPRが認められた患者
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価からPDがみられないことを示す

主要評価項目
主な副作用(ASaT集団)(追跡期間中央値:10.1ヵ月)
- 副作用は、安全性解析対象例210例中144例(68.6%)(日本人10例中8例を含む)に認められました。主な副作用(10%以上)は、甲状腺機能低下症26例(12.4%)及び発熱22例(10.5%)でした。
- 重篤な副作用は11例(5.2%)に認められ、2例以上に認められた重篤な副作用は、肺臓炎3例(1.4%)、呼吸困難2例(1.0%)でした。
- 副作用による中止は9例(4.3%)で、その内訳は肺臓炎4例(1.9%)、注入に伴う反応2例(1.0%)、心筋炎、サイトカイン放出症候群、脊髄炎、筋炎各1例(0.5%)でした。
- 副作用による死亡例は認められませんでした。
副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
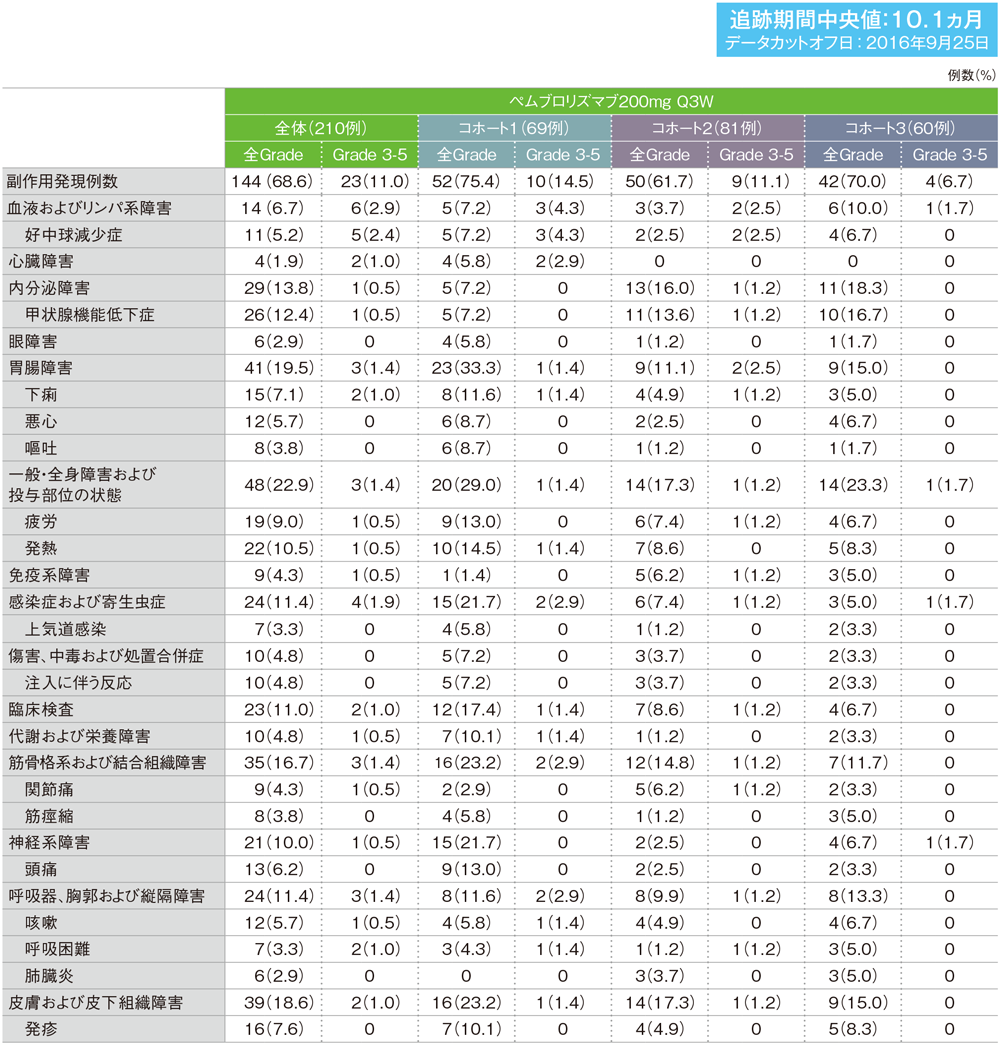
MedDRA/J version 19.0、GradeはCTCAE version 4.0
主要評価項目
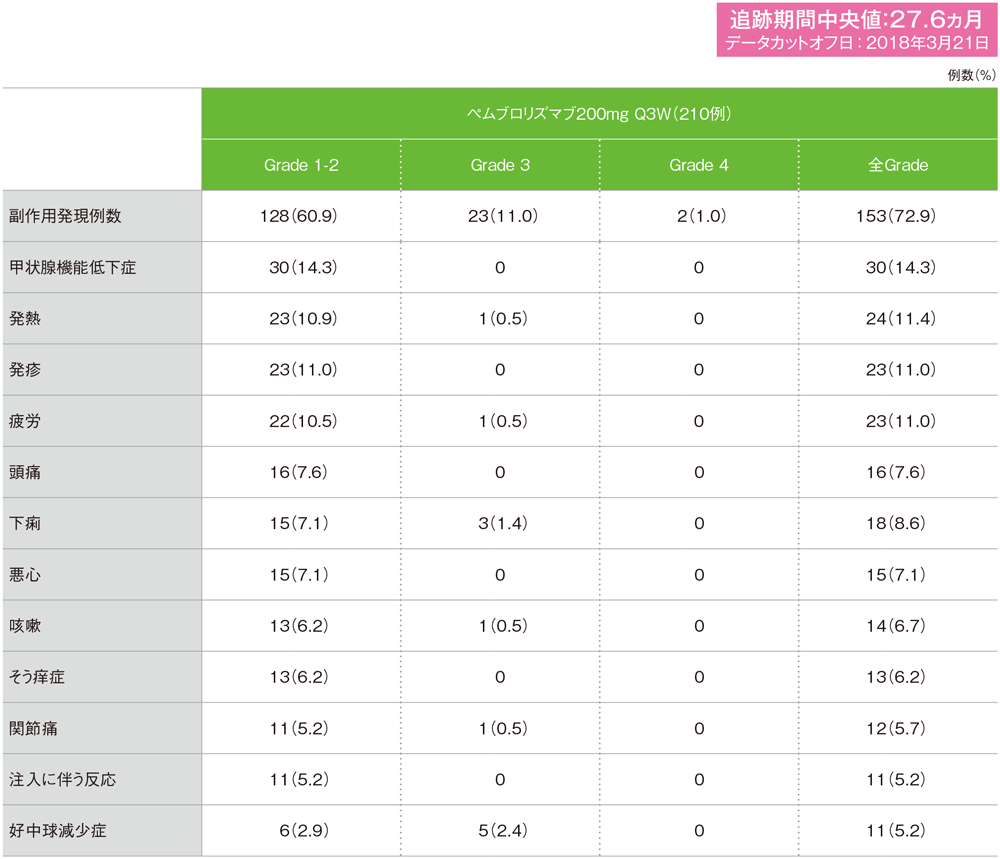
主な副作用(ASaT集団)(追跡期間中央値:27.6ヵ月)
- 副作用(2年フォローアップ)は、安全性解析対象例210例中153例(72.9%)に認められました。主な副作用(10%以上)は、甲状腺機能低下症30例(14.3%)、発熱24例(11.4%)、発疹23例(11.0%)及び疲労23例(11.0%)でした。
- 重篤な副作用に関する記載は認められませんでした。
- 副作用による中止は14人(6.7%)で、その内訳は肺臓炎7人(3.3%)、注入に伴う反応は2人(1.0%)、心筋炎、サイトカイン放出症候群、脊髄炎、筋炎、てんかん、および器質化肺炎がそれぞれ1人(0.5%)でした。
- 2年フォローアップデータにおいても、副作用による死亡例は認められませんでした。
副作用(いずれかの投与群で発現率5%以上)(ASaT集団)
安全性
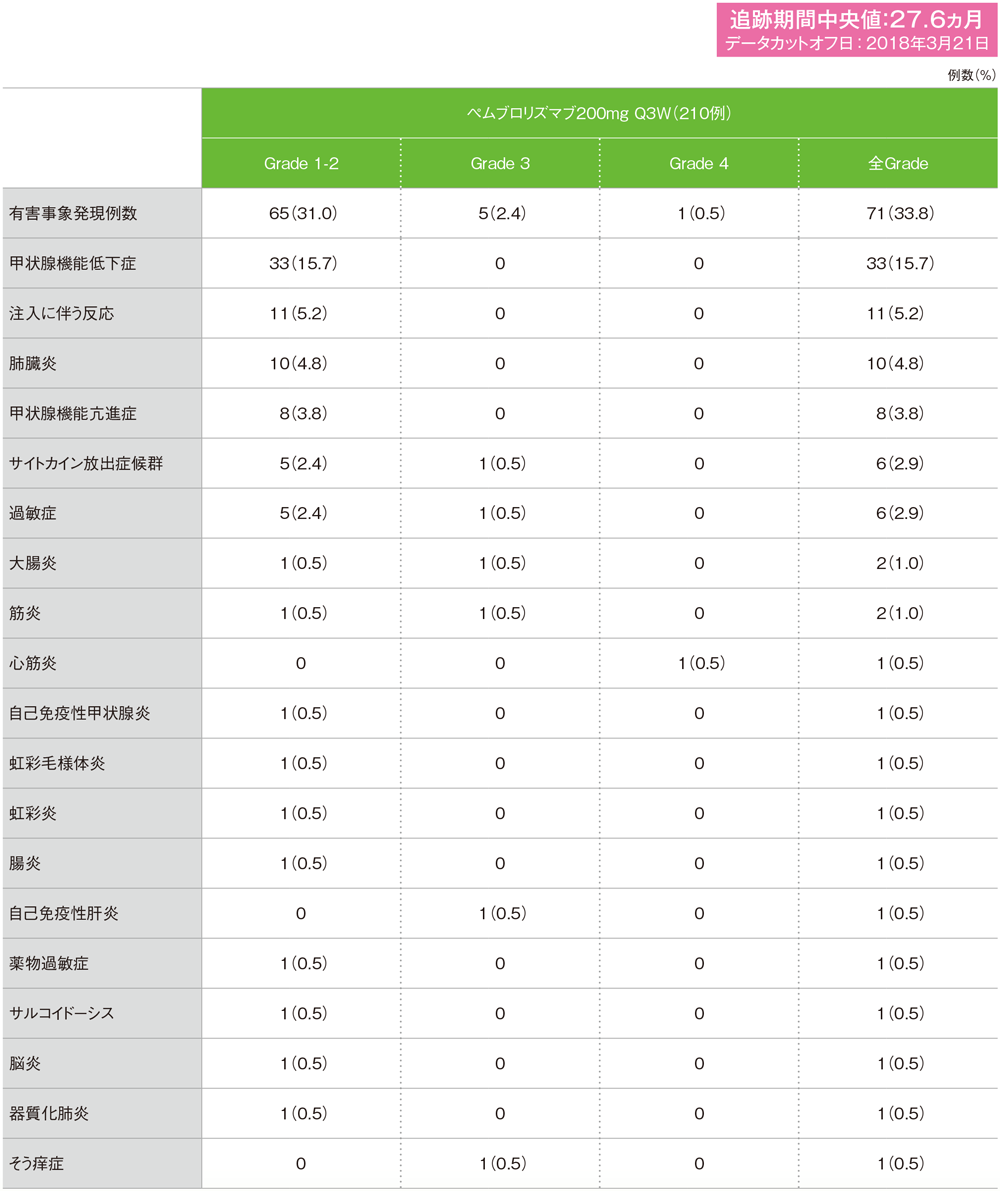
免疫関連など特に注目すべき有害事象(ASaT集団)
- 免疫関連の有害事象とInfusion reactionは210例中71例(33.8%)に認められました。免疫関連の有害事象による死亡例は認められませんでした。
- 最も多くみられた免疫関連の有害事象は甲状腺機能低下症であり、33例(15.7%)に認められました。
免疫関連の有害事象とInfusion reaction(ASaT集団)