キャップバックス®インフォームドコンセント用下敷き
キャップバックス®の接種を希望される方に、接種の対象者と接種間隔、また肺炎球菌性肺炎にかかるリスクが高い方を説明する際にご利用いただける資材です。
承認時評価資料:海外第Ⅲ相試験(003試験)
コホート1には承認外の50 ~64 歳の健康成人が含まれるが、承認時評価資料として評価されたため掲載する。
コホート2は、主に承認外の被験者で構成されるため掲載しない。
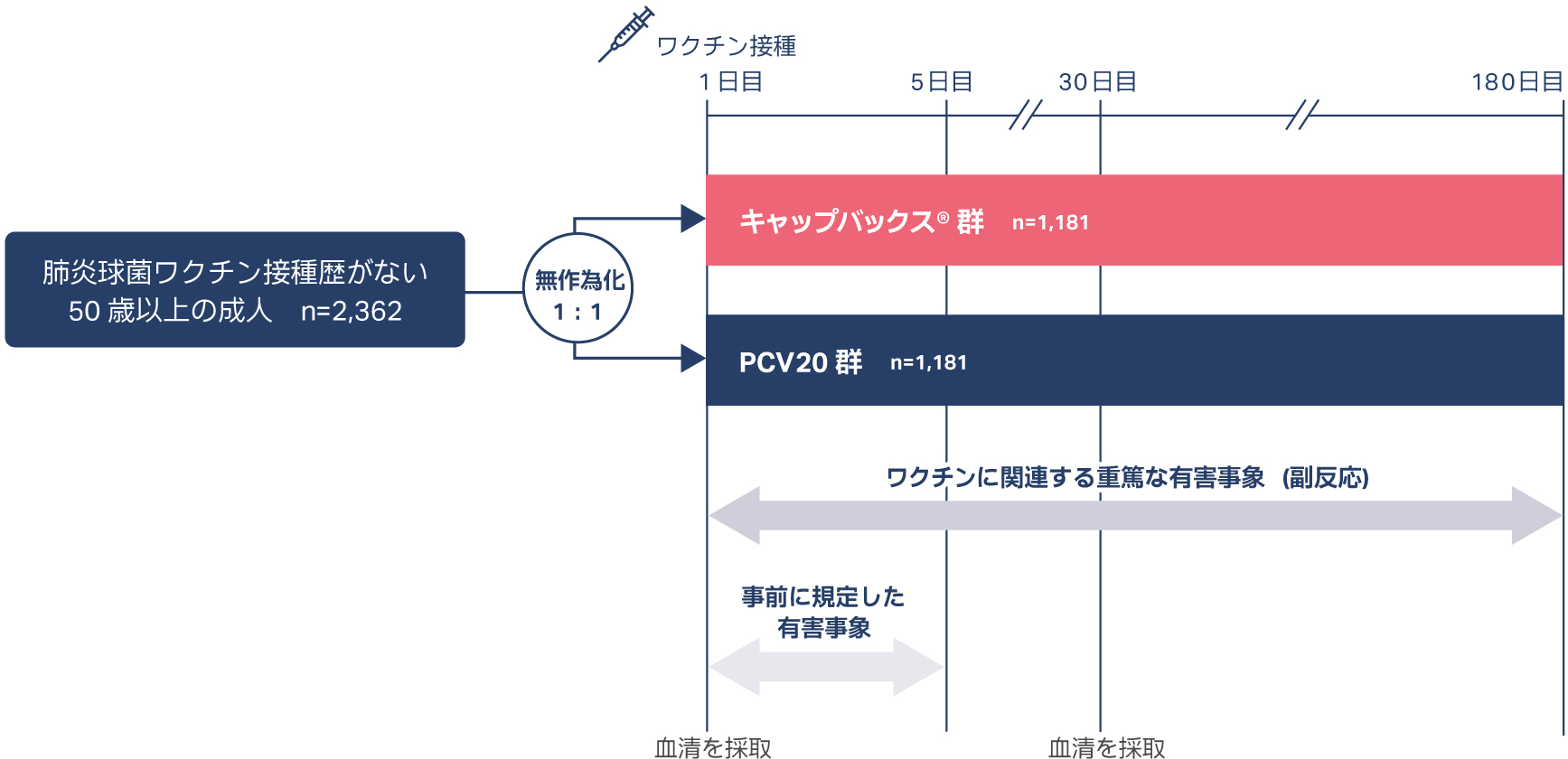
無作為化、実薬対照、並行群間、多施設共同、二重盲検比較試験
PCV20:沈降20価肺炎球菌結合型ワクチン
| 目的 | 肺炎球菌ワクチン接種歴がない18歳以上の成人を対象に、キャップバックス®の安全性、忍容性および免疫原性を検討する。 |
| 対象 | 侵襲性肺炎球菌感染症の既往歴および肺炎球菌ワクチン接種歴がない50歳以上の成人2,362例 |
| 方法 | キャップバックス®群またはPCV20群に1:1の比で無作為に割り付け、キャップバックス®またはPCV20 0.5mLを単回筋肉内接種した。 免疫原性は、ワクチン接種後30日目に検討した。安全性は、ワクチン接種後1~5日目までの事前に規定した有害事象、試験期間中の重篤な副反応を検討した。 |
| 評価項目 | 【免疫原性】 主要評価項目: ①キャップバックス®またはPCV20接種後30日目におけるキャップバックス® 固有の11 血清型(9N、15A、15C、16F、17F、20A、23A、23B、24F、31、35B)に対する血清型特異的OPA GMT比 ②キャップバックス®またはPCV20接種後30日目における共通の10血清型(3、6A、7F、8、10A、11A、12F、19A、22F、33F )に対する血清型特異的OPA GMT比 ③キャップバックス®またはPCV20 接種前から接種後30日目までのキャップバックス®固有の11 血清型(9N、15A、15C、16F、17F、20A、23A、23B、24F、31、35B)に対する血清型特異的OPA応答の上昇倍率が4 倍以上であった被験者割合 副次評価項目: ①キャップバックス®またはPCV20接種前から接種後30日目までの交差反応性血清型15Bに対する血清型特異的OPA応答の上昇倍率が4倍以上であった被験者割合 ②キャップバックス® またはPCV20接種前から接種後30日目における21血清型(3、6A、7F、8、9N、10A、11A、12F、15A、15C、16F、17F、19A、20A、22F、23A、23B、24F、31、33F、35B)に対する血清型特異的OPA応答の上昇倍率が4倍以上であった被験者割合 【安全性】 主要評価項目: キャップバックス®またはPCV20接種後1 〜5日目までの事前に規定した注射部位の有害事象(疼痛、腫脹、紅斑)、接種後1〜5日目までの事前に規定した全身性の有害事象( 疲労、頭痛、筋肉痛、発熱)、試験期間中の重篤な副反応 |
| 解析計画 | 【免疫原性】 免疫原性の解析には治験実施計画書を逸脱していない全ての被験者(PP 集団)を用いた。 主要評価項目: ①キャップバックス® 固有の11 血清型(9N、15A、15C、16F、17F、20A、23A、23B、24F、31、35B)の血清型特異的OPA GMT比を求め、PCV20群に対するキャップバックス®群の優越性を検証した。優越性基準は、OPA GMT比の両側95%CI の下限>2.0(片側p 値< 0.025)としたa。 ② PCV20 との共通の10 血清型(3、6A、7F、8、10A、11A、12F、19A、22F、33F)の血清型特異的OPA GMT比を求め、PCV20群に対するキャップバックス® 群の非劣性を検証した。非劣性基準は、OPA GMT比の両側95%CI の下限>0.5(片側p 値< 0.025)としたa。 ③キャップバックス® 固有の11 血清型(9N、15A、15C、16F、17F、20A、23A、23B、24F、31、35B)のOPA応答の上昇倍率が4倍以上であった被験者の割合を求め、PCV20群に対するキャップバックス®群の優越性を検証した。優越性基準は、被験者割合の群間差の両側95%CI の下限>10%(片側p 値< 0.025)としたb。 副次評価項目: ①交差反応性血清型15BのOPA応答の上昇倍率が4倍以上であった被験者の割合を求め、50歳以上の成人で許容可能な免疫応答の基準を満たすかを評価した。許容可能な免疫応答の基準は、血清型特異的OPA応答の上昇倍率が4 倍以上であった被験者の割合の両側95%Cl の下限> 50% としたc。 ② 21血清型(3、6A、7F、8、9N、10A、11A、12F、15A、15C、16F、17F、19A、20A、22F、23A、23B、24F、31、33F、35B)の血清型特異的 OPA応答の上昇倍率が4倍以上であった被験者の割合を評価したd。 a 制約付き経時データ解析(cLDA)法により算出。 b 層別Miettinen & Nurminen法(層別因子:無作為時の年齢区分)により算出。 c 二項分布に基づく正確な方法により算出。 d 記述統計量、点推定値および接種群内での95%CIを算出。 【安全性】 安全性の解析にはワクチンを接種した全ての被験者(APaT集団)を用いた。安全性および忍容性は、有害事象及びワクチン接種後の体温を含む全ての安全性評価項目を用いて、臨床的な観点から評価した。 |
安全性
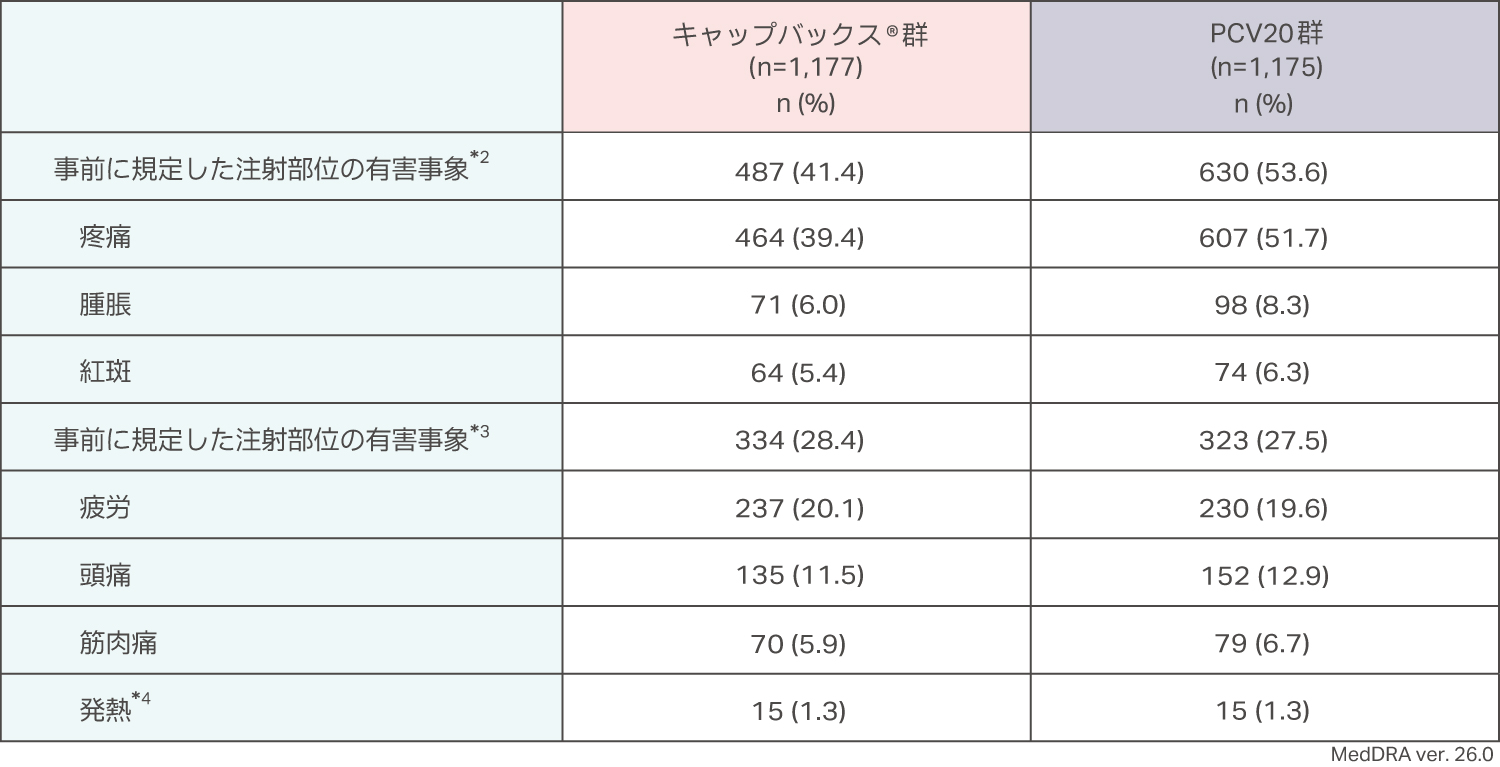
有害事象を1件以上発現した被験者の割合は、キャップバックス®群(APaT集団1,177例)で685例(58.2%)、PCV20群(APaT集団1,175例)で778例(66.2%)でした。
免疫原性【主要評価項目:検証的解析結果】
※1優越性基準:OPA GMT比(キャップバックス®群/PCV20群)の両側95%CIの下限>2.0(片側p値<0.025)
※2非劣性基準:OPA GMT比(キャップバックス®群/PCV20 群)の両側95%CI の下限>0.5(片側p 値<0.025)
*1 APaT(All Participants as Treated)集団:ワクチンを接種した全ての被験者
*2 接種後1〜5日までに疼痛、腫脹、紅斑のいずれかが1件以上発現した数
*3 接種後1〜5日までに疲労、頭痛、筋肉痛、発熱のいずれかが1件以上発現した数
*4 体温は接種後1〜5日目に測定され、38.0℃以上を発熱とみなした。
本試験期間中に、キャップバックス®群、PCV20群ともに重篤な副反応は認められませんでした。
有害事象を1件以上発現した被験者の割合は、キャップバックス®群(APaT集団1,177例)で685例(58.2%)、PCV20群(APaT集団1,175例)で778例(66.2%)でした。主な有害事象は、キャップバックス®群で、注射部位疼痛471例(40.0%)、疲労240例(20.4%)、頭痛162例(13.8%)、PCV20群で、注射部位疼痛608例(51.7%)、疲労235例(20.0%)、頭痛174例(14.8%)でした。重篤な有害事象はキャップバックス®群で19例(1.6%)、PCV20群で24例(2.0%)に認められました。2例以上に認められた重篤な有害事象は、キャップバックス®群で敗血症、脳血管障害各2例(0.2%)、PCV20群で心筋梗塞4例(0.3%)でした。死亡例は、キャップバックス®群で4例(敗血症、脳血管発作、心筋梗塞並びに肝硬変および肝性脳症)、PCV20群で2例(心停止および腹腔内膿瘍)認められました。重篤な有害事象および死亡はキャップバックス®群、PCV20群ともにワクチンと関連なしと判定されました。
キャップバックス® 固有の11血清型のうち10血清型に対して、接種後30日目OPA GMT比で、両側95%CIの下限が2.0を超え、PCV20群に対するキャップバックス® 群の優越性が検証されました(片側p値<0.001、cLDA法)。血清型15CはOPA GMT比の両側95%CIの下限が1.77で、PCV20群に対する優越性が検証されませんでした。
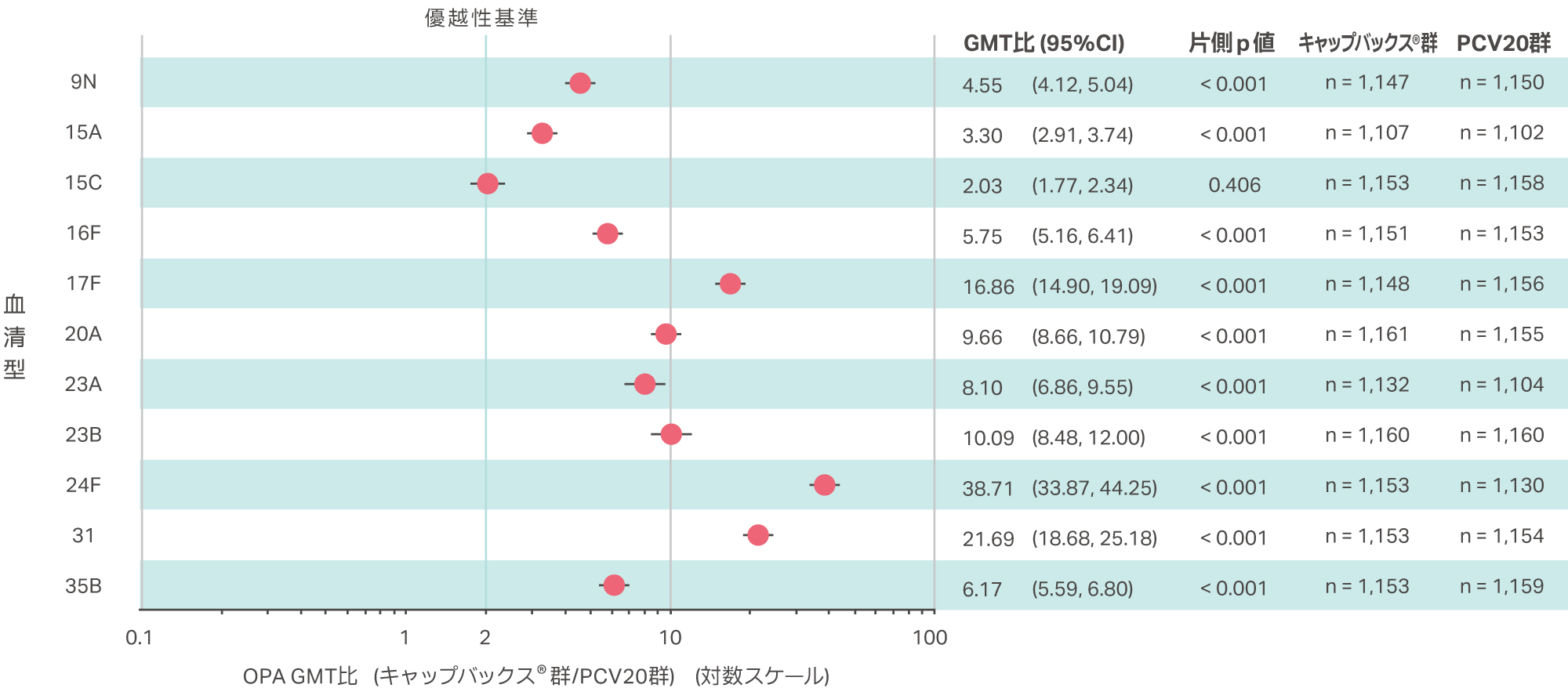
PP集団
GMT比、95%CIおよびp値は、cLDA法により算出した。
優越性基準:OPA GMT比(キャップバックス®群/PCV20群)の両側95%CIの下限>2.0(片側p値<0.025)
PCV20と共通の10血清型に対して、接種後30日目OPA GMT比は、全ての血清型において両側95%CIの下限が0.5を超え、PCV20群に対するキャップバックス® 群の非劣性が検証されました( いずれの血清型においても片側p値<0.001、cLDA法 )。
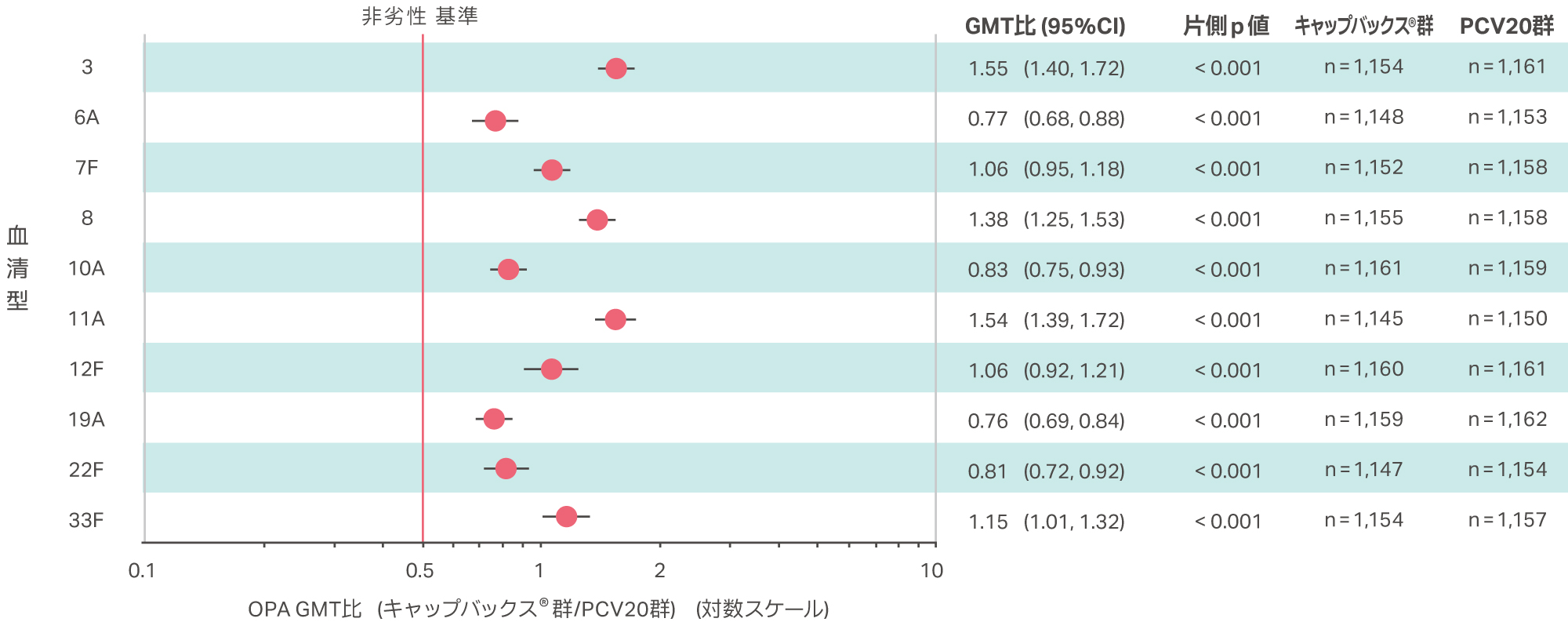
PP 集団
GMT 比、95%CI およびp 値は、cLDA 法により算出した。
非劣性基準:OPA GMT比(キャップバックス®群/PCV20 群)の両側95%CI の下限>0.5(片側p 値<0.025)
本剤における効能又は効果、効能又は効果に関連する注意(抜粋)は以下の通りです。
4. 効能又は効果
高齢者又は肺炎球菌による疾患に罹患するリスクが高いと考えられる成人における肺炎球菌による感染症の予防
5. 効能又は効果に関連する注意( 抜粋)
5.3 肺炎球菌による疾患に罹患するリスクが高いと考えられる成人とは、以下のような状態の者を指す。
・ 慢性的な心疾患、肺疾患、肝疾患又は腎疾患
・ 糖尿病
・ 基礎疾患若しくは治療により免疫不全状態である又はその状態が疑われる者
・ 先天的又は後天的無脾症
・ 鎌状赤血球症又はその他の異常ヘモグロビン症
・ 人工内耳の装用、慢性髄液漏等の解剖学的要因により生体防御能が低下した者
・ 上記以外で医師が本剤の接種を必要と認めた者
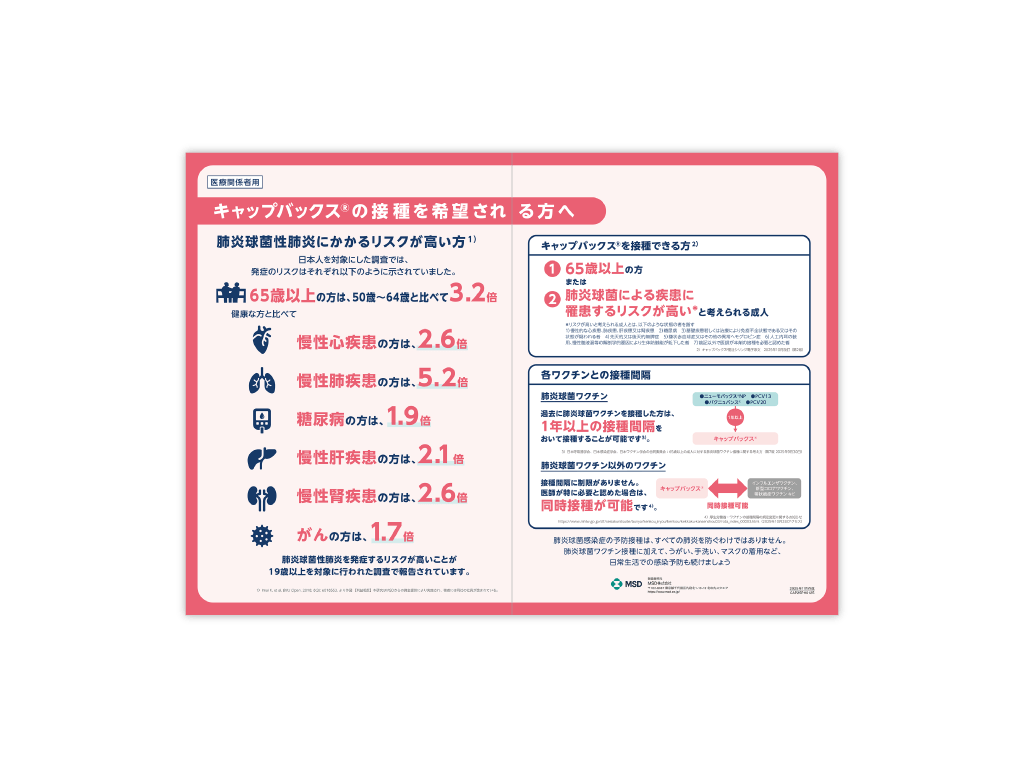
キャップバックス®の接種を希望される方に、接種の対象者と接種間隔、また肺炎球菌性肺炎にかかるリスクが高い方を説明する際にご利用いただける資材です。


2025年10月に、成人に特化して開発された肺炎球菌 結合型ワクチン「キャップバックス®」を発売しました。キャップバックス®は、小児への肺炎球菌ワクチン導入後に […]

マンガをベースに子宮頸がんについて分かりやすく学べる小冊子です

疾患や予防、ワクチン接種について学べる小冊子です

男女ともにHPVへの感染が原因になるHPV関連疾患、その予防法に ついて記載している小冊子です
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?