キャップバックス®インフォームドコンセント用下敷き
キャップバックス®の接種を希望される方に、接種の対象者と接種間隔、また肺炎球菌性肺炎にかかるリスクが高い方を説明する際にご利用いただける資材です。
本剤の電子添文では、以下のとおり記載されています。
4. 効能又は効果
高齢者又は肺炎球菌による疾患に罹患するリスクが高いと考えられる成人における肺炎球菌による感染症の予防
5. 効能又は効果に関連する注意
5.1 肺炎球菌血清型(3、6A、7F、8、9N、10A、11A、12F、15A、15B、15C、16F、17F、19A、20A、22F、23A、23B、24F、31、33F 及び35B)以外の肺炎球菌による感染症又は他の起炎菌による感染症を予防することはできない。
5.2 ジフテリアの予防接種に転用することはできない。
5.3 肺炎球菌による疾患に罹患するリスクが高いと考えられる成人とは、以下のような状態の者を指す。
・ 慢性的な心疾患、肺疾患、肝疾患又は腎疾患
・ 糖尿病
・ 基礎疾患若しくは治療により免疫不全状態である又はその状態が疑われる者
・ 先天的又は後天的無脾症
・ 鎌状赤血球症又はその他の異常ヘモグロビン症
・ 人工内耳の装用、慢性髄液漏等の解剖学的要因により生体防御能が低下した者
・ 上記以外で医師が本剤の接種を必要と認めた者
本剤の電子添文では、以下のとおり記載されています。
18. 薬効薬理
18.1 作用機序
本剤は、それぞれがキャリアタンパク質(CRM197)と結合した血清型特異的な肺炎球菌莢膜ポリサッカライドを含有しており、肺炎球菌のオプソニン化、貪食及び殺菌を促進する抗体を誘導して肺炎球菌による疾患を予防する。本剤はT細胞依存性免疫応答を誘導する。キャリアタンパク質特異的ヘルパーT細胞は、血清型特異的B 細胞の特異性、機能性及び成熟並びに記憶B細胞の誘導に寄与する。
<添付の有無>
注射針は添付されていません。年齢や体型を考慮し、適切な注射針を選んでください。
<推奨するメーカー>
針について特に推奨するメーカーはありません。
<針のゲージ>
使用可能な針のゲージについて特別な規定はありません。
筋肉内注射用の針であれば使用可能と考えられます。
成人の侵襲性肺炎球菌感染症から検出された肺炎球菌血清型の疫学に基づき、含有する血清型を選択したためです(1)。
<引用>
(1)申請資料概要 2.5 臨床に関する概括評価
血清型15Bを化学処理してO-アセチル基を除去することにより作製した抗原であり、15Cと構造的に類似しているため、血清型15Cの抗原として含有しています。
血清型15BのO-脱アセチル化体は、15Cに対する特異的抗体と、15Bに対する交差反応性抗体となるため、血清型15Cと15B両方の免疫原性を有し、両血清型をカバーします(1)。
<引用>
(1)申請資料概要 2.4.2.1.2 効力を裏付けるin vivo試験
本剤の電子添文には、以下のとおり記載されています。
6. 用法及び用量
1回0.5mLを筋肉内に注射する。
7. 用法及び用量に関連する注意
7.1 同時接種
医師が必要と認めた場合には、他のワクチンと同時に接種することができる。
本剤を含む肺炎球菌結合型ワクチン(PCV)において、成人に対し、同じワクチンを再接種する必要性が示された指針はありません。
また、本剤の再接種に関する臨床試験を行っておらず、再接種時の免疫原性や安全性の情報はありません。
[接種不適当者:本剤の成分又はジフテリアトキソイドに対する重度のアレルギー反応(アナフィラキシー等)を呈したことがあることが明らかな者]
[接種要注意者:予防接種で接種後2日以内に発熱のみられた者及び全身性発疹等のアレルギーを疑う症状を呈したことがある者]
[接種要注意者:本剤の成分又はジフテリアトキソイドに対してアレルギーを呈するおそれのある者]
接種不適当者に該当しなければ接種可能です。
なお、本剤に、鶏卵の成分やゼラチン、抗生物質(ペニシリン、カナマイシン、エリスロマイシン)は含まれていません。
具体的な期間を示すガイドラインや指針はありません。
個々の患者さんの健康状態に応じて接種タイミングをご判断いただくことをおすすめします。
免疫抑制的な治療を受けている場合、免疫機能が抑制されているため、本剤に対する免疫応答が低下する可能性があります。本剤の接種については、患者の状態や治療スケジュール、感染症リスクなどを考慮しご判断ください。
【承認外情報に関する注意】
本Q&Aでは、承認されている効能又は効果とは異なる臨床試験(承認時評価資料)の情報が含まれます。
本剤のご使用にあたっては最新の製品電子添文をご確認ください。
他の肺炎球菌ワクチンを接種した人に対しても、本剤を接種することは可能です。
他の肺炎球菌ワクチン接種歴のある50歳以上の成人を対象にした国際共同第Ⅲ相試験(006試験)において、接種歴(*)によらず、本剤は21種類全ての血清型に対して免疫応答を誘導しました。また、本剤の忍容性は良好で、安全性プロファイルはPCV15及びPPSV23と同様でした(1)。なお、接種歴別に免疫原性、安全性を評価したデータはありません。
(*)接種歴:組入れの1年以上前にPCV13、PCV15、PPSV23、PCV13+PPSV23、PPSV23+PCV13又はPCV15+PPSV23を接種
<引用>
(1)Scott P et al. Clin Infect Dis. 2024;79(6):1366-1374.
本剤の電子添文には、以下のとおり記載されています。
8.1 本剤は「予防接種実施規則」及び「定期接種実施要領」に準拠して使用すること。
8.2 被接種者について、接種前に必ず問診、検温及び診察(視診、聴診等)によって健康状態を調べること。
8.3 被接種者又はその介護者に、接種当日は過激な運動は避け、接種部位を清潔に保ち、また、接種後の健康監視に留意し、局所の異常反応や体調の変化、さらに高熱、痙攣等の異常な症状を呈した場合には速やかに医師の診察を受けるよう事前に知らせること。
8.4 本剤接種後にショック、アナフィラキシーを含む重度のアレルギー反応があらわれることがあるため、接種前に既往歴等に関する問診を十分に行うこと。重度のアレルギー反応が起こった場合に備えて、適切な医療処置を直ちに行えるようにしておくこと。
本剤の電子添文には、以下のとおり記載されています。
【頻度 10%以上】
・神経系障害:頭痛
・一般・全身障害および投与部位の状態:注射部位疼痛(36.0%)、疲労
【頻度 1~10%未満】
・筋骨格系及び結合組織障害:筋肉痛
・一般・全身障害および投与部位の状態:注射部位紅斑、注射部位腫脹、発熱(38℃以上)
(注)発現頻度は、国内第Ⅲ相試験[009試験(65歳以上の成人)]、海外第Ⅲ相試験[003試験(65歳以上の成人の部分集団のデータ)]及び国際共同第Ⅲ相試験[008試験(肺炎球菌感染症に罹患するリスクを有する18~64歳の成人)]の統合結果に基づき算出した。これらの試験の統合結果において18~64歳の成人では、65歳以上の成人よりも報告された副反応が多かった。
特別な対処法は無いため、通常考えられる対症療法を行ってください(1)(2)。
・注射部位の局所症状(発赤、腫脹、硬結)が強い際には冷湿布など。
・発熱には冷却、必要に応じてアセトアミノフェン等の解熱剤投与など。
・じんま疹には、抗ヒスタミン薬や抗アレルギー薬の投与など。
・発疹では経過観察など。
<引用>
(1)予防接種ガイドライン2025年度版. 発行:公益財団法人予防接種リサーチセンター, 2025:56-57.
(2)渡辺博 著. わかりやすい予防接種 改訂第7版. 診断と治療社, 2023:129-130.
適正でない状況下での安全性、有効性に関するデータはありません。
念のため、接種を受けた方の健康状態を十分に観察してください。
国立健康危機管理研究機構のウェブサイトに掲載されている「予防接種における間違いを防ぐために~接種前の確認がとても大切です~」の「予防接種で間違いがあった場合の対応(例)」もご参照ください(1)。
<引用>
(1)予防接種における間違いを防ぐために~接種前の確認がとても大切です~ 2025年4月改訂版 国立健康危機管理研究機構 国立感染症研究所予防接種研究部 p8
一般的にみられるワクチンの副反応としては、疼痛、発赤、腫脹などの局所反応や発熱、倦怠感などの全身症状がありますが、これらは免疫応答がおきる際の生体反応に伴うものとされています(1)。
予防接種ガイドラインでも局所の発赤、腫脹、硬結や発熱がワクチン接種後の「通常みられる反応」とされています(2)。
<引用>
(1)Causality assessment of an adverse event following immunization (AEFI): user manual for the revised WHO classification, 2nd ed., 2019 update
(2)予防接種ガイドライン2025年度版. 発行:公益財団法人予防接種リサーチセンター, 2025:59.
本剤の電子添文には、以下のとおり記載されています。
14.1 薬剤接種時の注意
14.1.1 接種時
(1) 本剤を他のワクチンと混合して接種しないこと。
(2) 冷蔵庫から取り出し常温になってから速やかに使用すること。
(3) 使用前には必ず、粒子状物質又は変色がないかを確認すること。粒子状物質や変色が認められた場合には、使用しないこと。
(4) 針を時計回りにシリンジにねじ込み、しっかり固定すること。
(5) 注射針の先端が血管内に入っていないことを確かめること。
14.1.2 接種部位
(1) 本剤は筋肉内注射のみに使用すること。
(2) 他のワクチンと同時に本剤を接種する場合、異なる部位に注射すること。
(3) 接種部位は、通常、上腕の三角筋中央部とし、接種前にアルコール等で消毒する。なお、臀部又は主要な神経幹及び血管が存在する可能性のある部位には注射しないこと。
(4) 筋肉内注射にあたっては、組織・神経等の損傷を避けるため下記の点に注意すること。
・針長は筋肉内接種に足る長さで、神経、血管、骨等の筋肉下組織に到達しないよう、各被接種者に対して適切な針長を決定すること。
・神経走行部位に接種しないこと。
・注射針を刺入したとき、激痛の訴えや血液の逆流をみた場合は直ちに針を抜き、部位をかえて注射すること。
本剤の電子添文には、以下のとおり記載されています。
貯法:2~8℃、凍結を避けること
20. 取り扱い上の注意
外箱開封後は遮光して保存すること。
[室温放置は貯法の範囲外]
室温放置された製品の使用はおすすめできません。
本剤の貯法は「2~8℃、凍結を避けること」と規定されております。
なお、安定性試験のデータに関してはインタビューフォーム掲載データ以上のものはありません。
また、一旦室温に持ち出したものをまた冷蔵に戻すなどの温度変化に関するデータもありません。
<インタビューフォーム記載 安定性試験データ>
保存容器:シリンジ
[長期保存試験]
保存条件:2~8℃、保存期間 36ヵ月
試験項目:性状、定量法(ポリサッカライド含量)、pH、採取容量、不溶性異物、不溶性微粒子、エンドトキシン、無菌
→30ヵ月まで規格内(試験継続中)
[安定性試験]
保存条件:0~2℃、保存期間 30日間
試験項目:性状、定量法(ポリサッカライド含量)、pH、採取容量、不溶性微粒子、エンドトキシン、無菌
→規格内
保存条件:23~27℃、保存期間 14週間
試験項目:性状、定量法(ポリサッカライド含量)、pH、採取容量、不溶性微粒子、エンドトキシン、無菌
→規格内
国内で商業的に測定を行っている検査機関はありませんが、一部の研究機関で実施されています(1)。
<引用>
(1)国立感染症研究所 IASR 34:66-67, 2013
定期接種の対象ではありません(1)。
<引用>
(1)厚生労働省 定期接種実施要領
どのくらい予防効果が持続するかは明確になっていません。
<他のワクチンとの接種間隔>
本剤には特に制限はありません。
<同時接種の可否>
医師が必要と認めた場合には、他のワクチンを同時に接種することができます(1)。
なお、本剤を他のワクチンと混合して接種しないでください。
同時接種できるワクチンの種類・数は規定されていません。
電子添文
7. 用法及び用量に関連する注意
7.1 同時接種
医師が必要と認めた場合には、他のワクチンと同時に接種することができる。
14. 適用上の注意
14.1.1 接種時
(1) 本剤を他のワクチンと混合して接種しないこと。

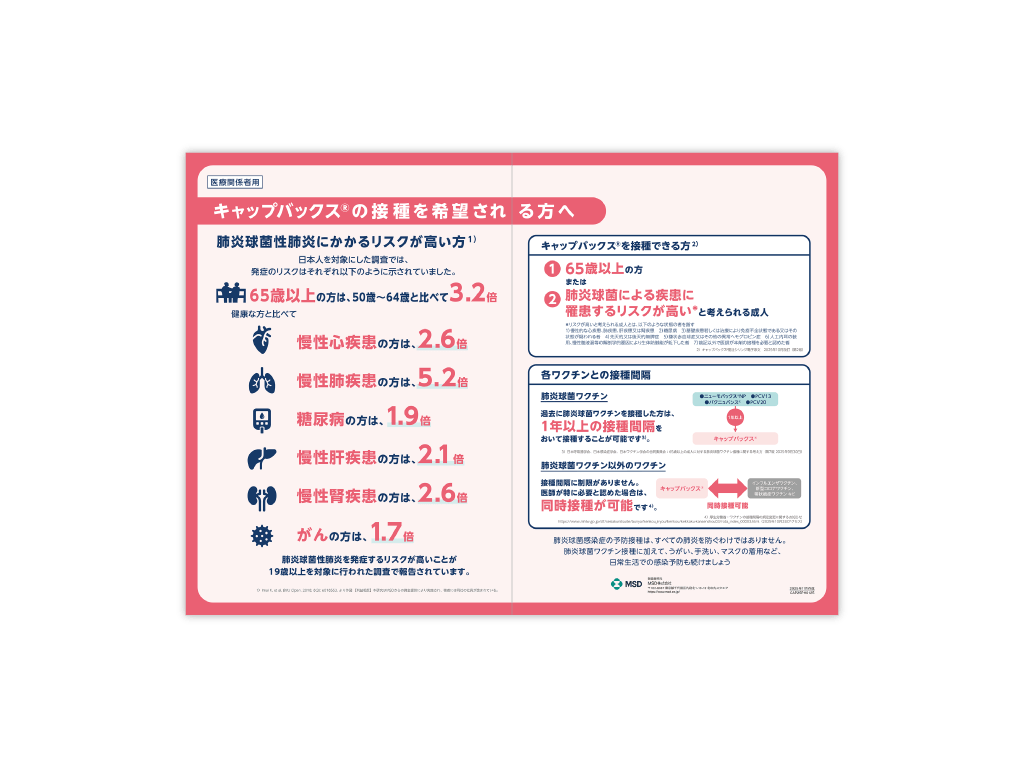
キャップバックス®の接種を希望される方に、接種の対象者と接種間隔、また肺炎球菌性肺炎にかかるリスクが高い方を説明する際にご利用いただける資材です。


2025年10月に、成人に特化して開発された肺炎球菌 結合型ワクチン「キャップバックス®」を発売しました。キャップバックス®は、小児への肺炎球菌ワクチン導入後に […]

マンガをベースに子宮頸がんについて分かりやすく学べる小冊子です

疾患や予防、ワクチン接種について学べる小冊子です

男女ともにHPVへの感染が原因になるHPV関連疾患、その予防法に ついて記載している小冊子です
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?