キャップバックス®インフォームドコンセント用下敷き
キャップバックス®の接種を希望される方に、接種の対象者と接種間隔、また肺炎球菌性肺炎にかかるリスクが高い方を説明する際にご利用いただける資材です。
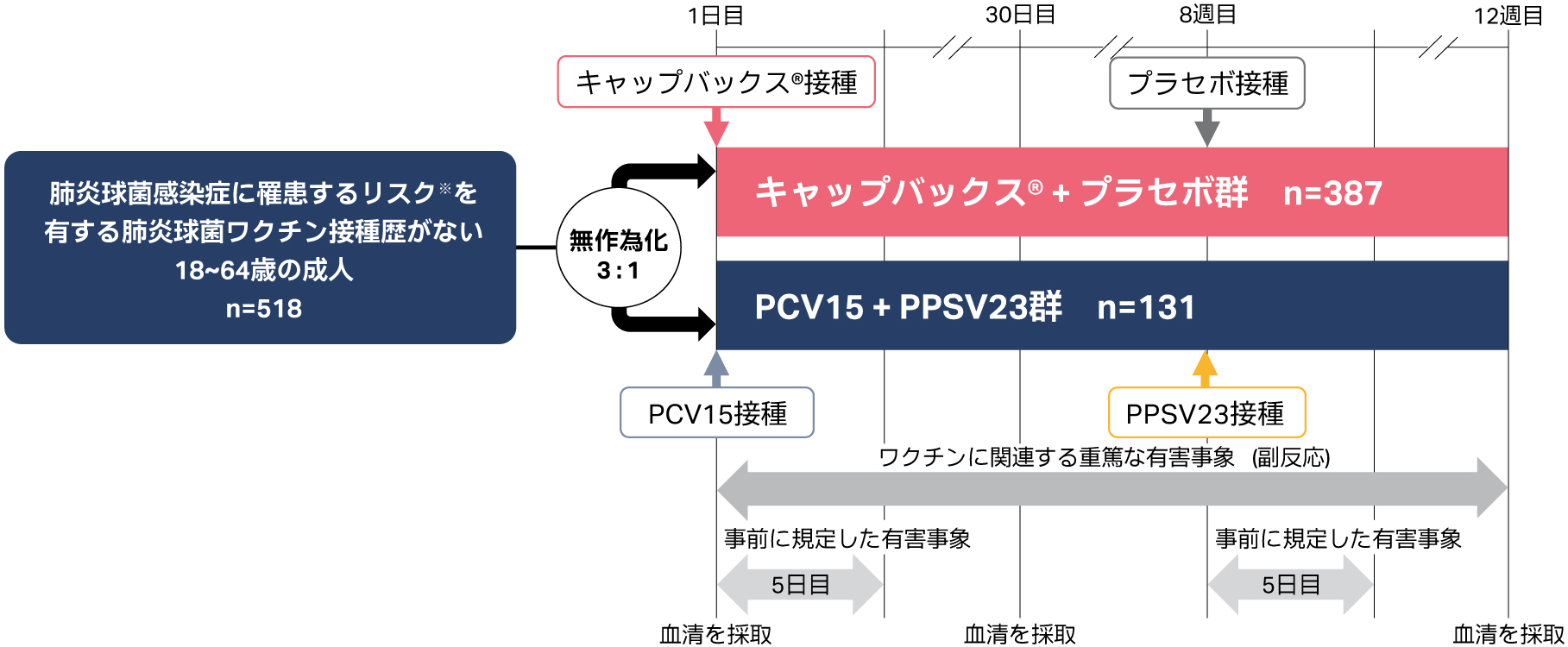
承認時評価資料:国際共同第Ⅲ相試験(008試験)
無作為化、実薬対照、並行群間、多施設共同、二重盲検比較試験
PCV15:沈降15価肺炎球菌結合型ワクチン
PPSV23:23価肺炎球菌莢膜ポリサッカライドワクチン
※リスク因子は、糖尿病、慢性心疾患、慢性腎臓病、慢性肝疾患又は慢性肺疾患のいずれか1つ以上に罹患していることとした。
| 目的 | 肺炎球菌感染症に罹患するリスクを有する肺炎球菌ワクチン接種歴がない18~64歳の成人を対象に、キャップバックス®の安全性、忍容性及び免疫原性を検討する。 |
| 対象 | 糖尿病、慢性心疾患、慢性腎臓病、慢性肝疾患または慢性肺疾患により肺炎球菌感染症に罹患するリスクを有する肺炎球菌ワクチン接種歴がない18~64歳の成人518例 |
| 方法 | キャップバックス®+プラセボ群またはPCV15+PPSV23群に年齢(18~49歳または50~64歳)並びに肺炎球菌感染症のリスク因子の種類および数(糖尿病のみ、慢性心疾患のみ、慢性腎臓病のみ、慢性肝疾患のみ、慢性肺疾患のみまたはリスク因子2つ以上)で層別し、3:1の比で無作為に割り付け、それぞれ0.5mLを単回筋肉内接種した。免疫原性は、ワクチン接種後30日目に検討した。安全性は、ワクチン接種後1~5日目までの事前に規定した有害事象、試験期間中の重篤な副反応を検討した。 |
| 評価項目 | 【免疫原性】 主要評価項目: キャップバックス®またはPCV15+PPSV23接種後30日目*における共通の13血清型(3、6A、7F、8、9N、10A、11A、12F、17F、19A、20A、22F、33F)、キャップバックス®固有の8血清型(15A、15C、16F、23A、23B、24F、31、35B)に対する血清型特異的OPA GMT 主な探索的評価項目: キャップバックス®またはPCV15接種前から接種後30日目**までの共通の6血清型(3、6A、7F、19A、22F、33F)、キャップバックス®固有の15血清型(8、9N、10A、11A、12F、15A、15C、16F、17F、20A、23A、23B、24F、31、35B)の血清型特異的OPA応答の上昇倍率が4倍以上であった被験者割合 【安全性】 主要評価項目: キャップバックス®、PCV15、PPSV23接種後1~5日目までの事前に規定した注射部位の有害事象(疼痛、腫脹、紅斑)、接種後1~5日目までの事前に規定した全身性の有害事象(疲労、頭痛、筋肉痛、発熱)、試験期間中の重篤な副反応 |
| 解析計画 | 【免疫原性】 免疫原性の解析には治験実施計画書を逸脱していない全ての被験者(PP集団)を用いた。 主要評価項目: PCV15+PPSV23と共通の13血清型(3、6A、7F、8、9N、10A、11A、12F、17F、19A、20A、22F、33F)、キャップバックス®固有の8血清型(15A、15C、16F、23A、23B、24F、31、35B)の血清型特異的OPA GMTを求め、評価したa。 主な探索的評価項目: キャップバックス®またはPCV15との共通の6血清型(3、6A、7F、19A、22F、33F)、キャップバックス®固有の15血清型(8、9N、10A、11A、12F、15A、15C、16F、17F、20A、23A、23B、24F、31、35B)の血清型特異的OPA応答の上昇倍率が4倍以上であった被験者割合を評価したb。 a 接種群内95%CIは、t分布に基づく自然対数尺度上の平均値のCIを逆変換して算出。 b ClopperとPearsonによる正確法に基づき算出。 【安全性】 安全性の解析には無作為化され、少なくとも1回ワクチンを接種した全ての被験者(APaT集団)を用いた。 安全性および忍容性は、有害事象及びワクチン接種後の体温を含む全ての安全性評価項目を用いて、臨床的な観点から評価した。 |
*キャップバックス®+プラセボ群はキャップバックス®接種後30日目(30日目)、PCV15+PPSV23群はPPSV23接種後30日目(12週目)。
**キャップバックス®+プラセボ群、PCV15+PPSV23群ともにワクチン接種前(1日目)からキャップバックス®+プラセボ群はキャップバックス®、PCV15+PPSV23群はPCV15接種から30日後(30日目)。
本剤の国内における効能又は効果に関する注意(抜粋)
5. 効能又は効果に関連する注意(抜粋)
5.3 肺炎球菌による疾患に罹患するリスクが高いと考えられる成人とは、以下のような状態の者を指す。
・ 慢性的な心疾患、肺疾患、肝疾患又は腎疾患
・ 糖尿病
・ 基礎疾患若しくは治療により免疫不全状態である又はその状態が疑われる者
・ 先天的又は後天的無脾症
・ 鎌状赤血球症又はその他の異常ヘモグロビン症
・ 人工内耳の装用、慢性髄液漏等の解剖学的要因により生体防御能が低下した者
・ 上記以外で医師が本剤の接種を必要と認めた者
安全性
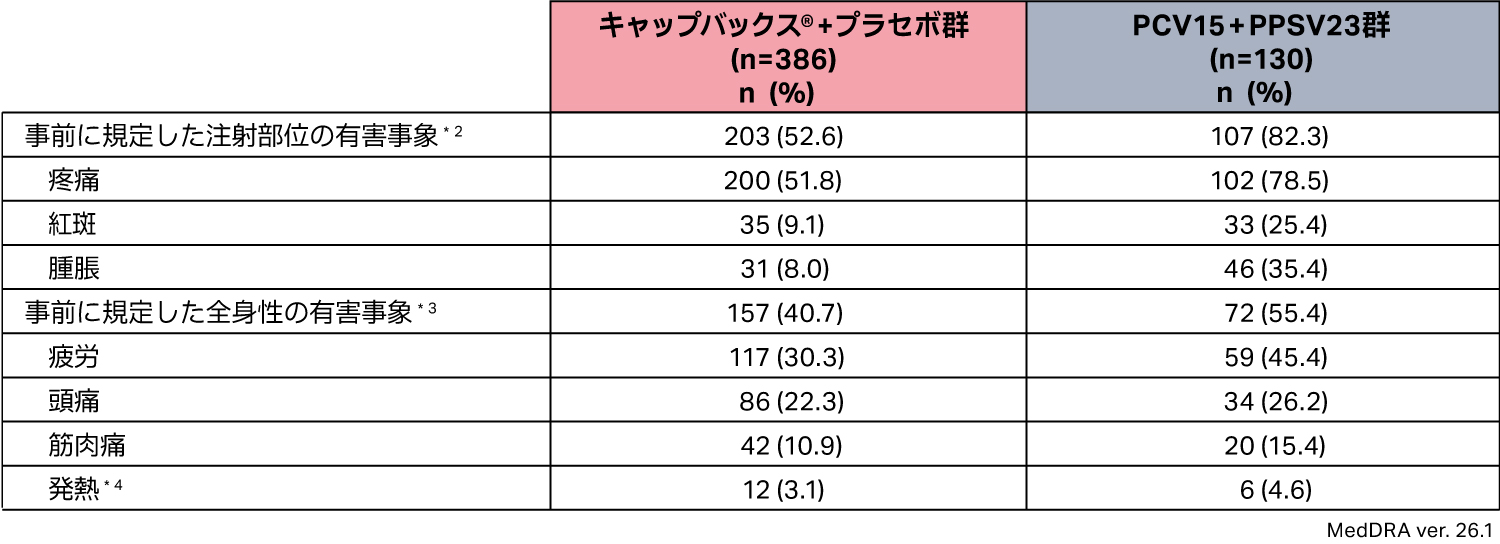
有害事象を1件以上発現した被験者の割合は、キャップバックス® +プラセボ群(APaT集団386例)で265例(68.7%)、PCV15+PPSV23群(APaT集団130例)で118例(90.8%)でした。
免疫原性
*1 APaT(All Participants as Treated)集団:少なくとも1回ワクチンを接種した全ての被験者
*2 接種後1~5日までに疼痛、腫脹、紅斑のいずれかが1件以上発現した数
*3 接種後1~5日までに疲労、頭痛、筋肉痛、発熱のいずれかが1件以上発現した数
*4 体温は接種後1~5日目に測定され、38.0℃以上を発熱とみなした。
本試験期間中に、キャップバックス®+プラセボ群、PCV15+PPSV23群ともに、重篤な副反応は認められませんでした。
有害事象を1件以上発現した被験者の割合は、キャップバックス®+プラセボ群(APaT集団386例)で265例(68.7%)、PCV15+PPSV23群(APaT集団130例)で118例(90.8%)でした。主な有害事象は、キャップバックス®+プラセボ群で注射部位疼痛200例(51.8%)、疲労118例(30.6%)、頭痛94例(24.4%)、筋肉痛42例(10.9%)注射部位紅斑39例(10.1%)、注射部位腫脹33例(8.5%)、PCV15+PPSV23群では注射部位疼痛102例(78.5%)、疲労59例(45.4%)、注射部位腫脹46例(35.4%)、頭痛36例(27.7%)、注射部位紅斑33例(25.4%)、筋肉痛20例(15.4%)でした。
投与中止に至った有害事象は両群ともに認められませんでした。重篤な有害事象はキャップバックス®+プラセボ群で10例(2.6%)に認められ、逆流性食道炎、閉塞性膵炎、急性腎盂腎炎、尿路性敗血症、四肢損傷、低血糖症、悪性黒色腫、喘息、肺疾患、肺水腫、睡眠時無呼吸症候群、大動脈弁狭窄症、各1件でした。PCV15+PPSV23群では7例(5.4%)に認められ、冠動脈狭窄症、心室頻拍、急性膵炎、細菌性肺炎、痙攣発作、失神、急性腎障害、深部静脈血栓症、各1件でした。死亡例は両群ともに認められませんでした。
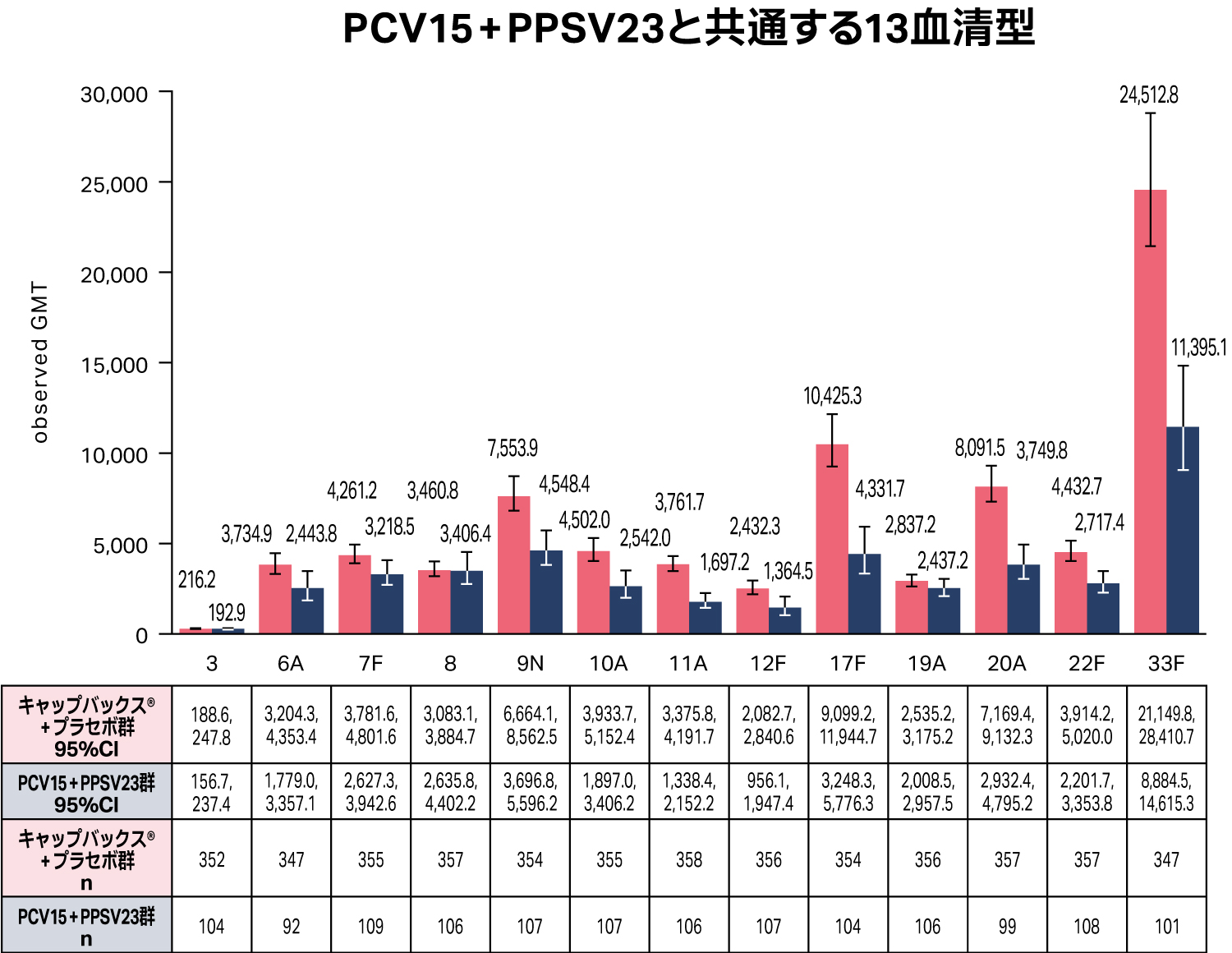
PCV15+PPSV23と共通する13血清型
接種後30日目の血清型特異的OPA GMT について、キャップバックス®はPCV15+PPSV23と共通する13血清型全てに対して免疫応答を誘導しました。
キャップバックス®固有の8血清型
接種後30日目の血清型特異的OPA GMTについて、キャップバックス®はキャップバックス®固有の8血清型全てに対して免疫応答を誘導しました。
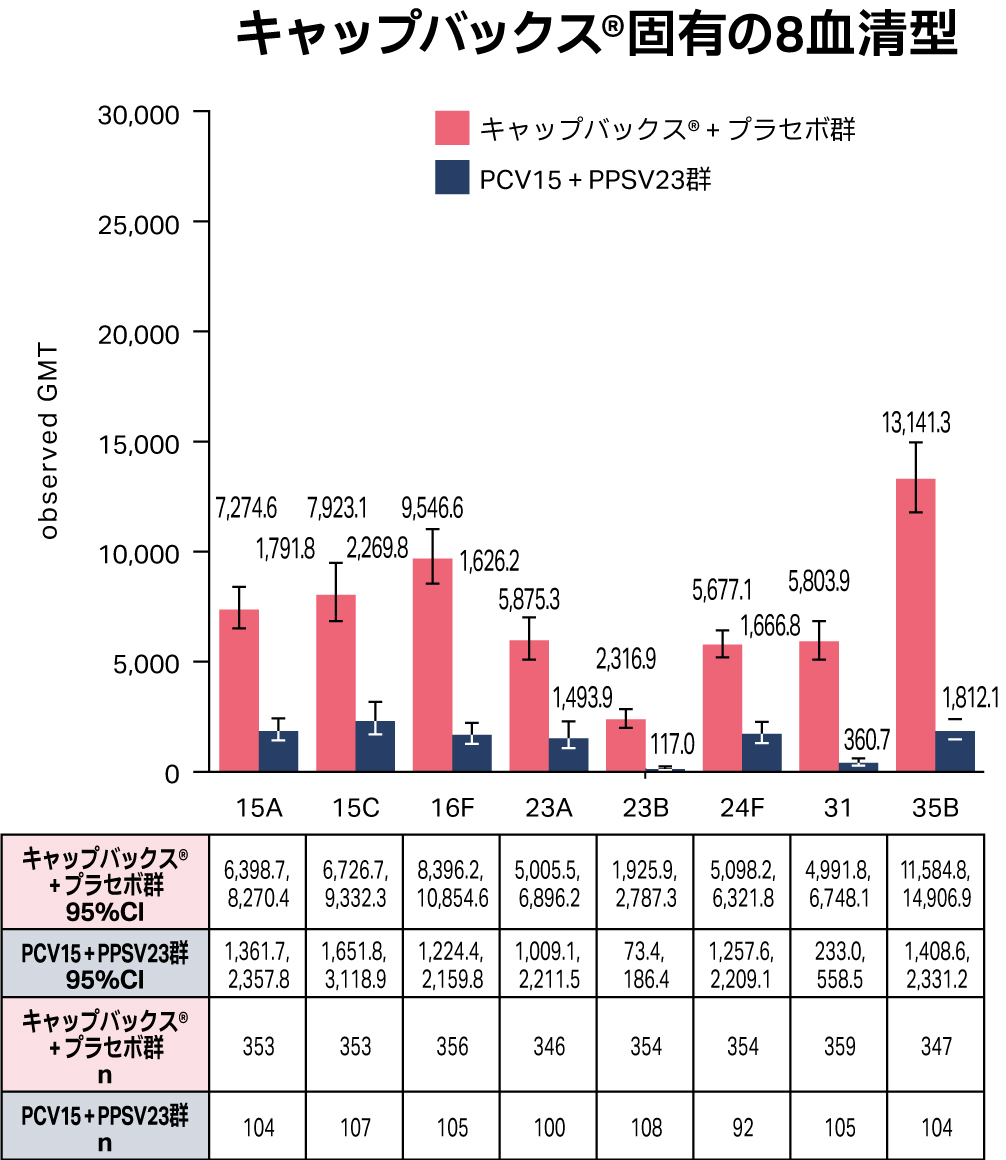
PP集団
接種群内95%CIは、t分布に基づく自然対数尺度上の平均値のCIを逆変換して算出した。
* キャップバックス®+プラセボ群はキャップバックス®接種後30日目(30日目)、PCV15+PPSV23群はPPSV23接種後30日目(12週目)。
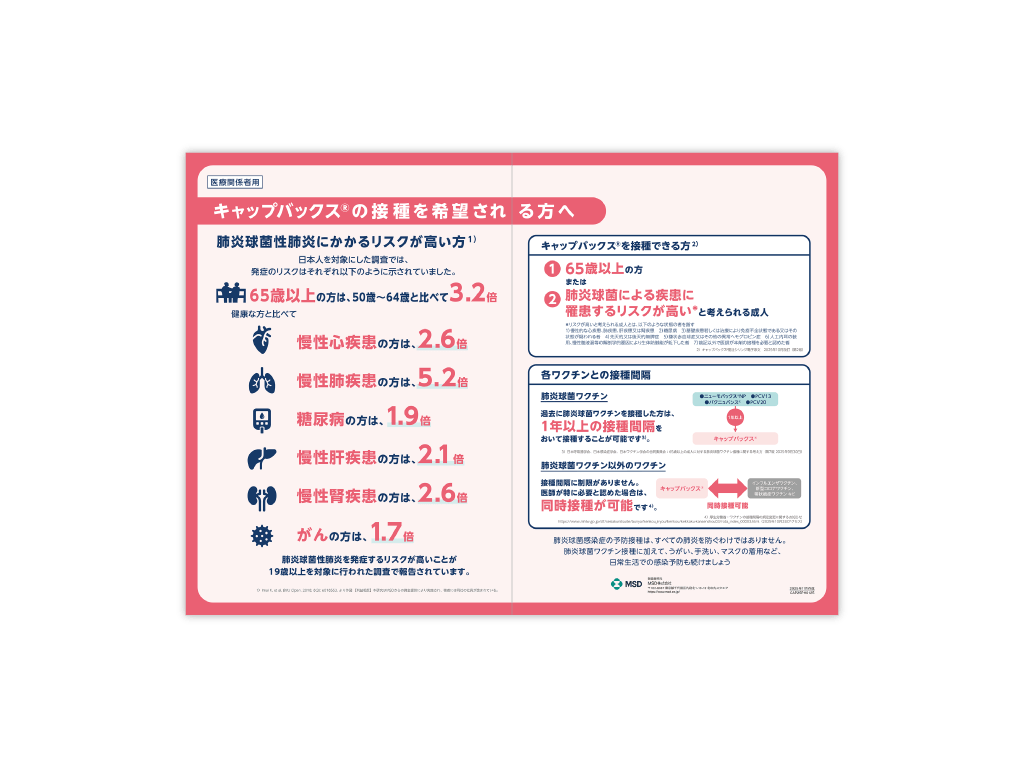
キャップバックス®の接種を希望される方に、接種の対象者と接種間隔、また肺炎球菌性肺炎にかかるリスクが高い方を説明する際にご利用いただける資材です。


2025年10月に、成人に特化して開発された肺炎球菌 結合型ワクチン「キャップバックス®」を発売しました。キャップバックス®は、小児への肺炎球菌ワクチン導入後に […]

接種を希望されている方に、接種前にHPVワクチンをよりよく知っていただくよう、HPVワクチンの安全性・有効性や、日本・世界の接種状況などを理解いただける資材です […]

マンガをベースに子宮頸がんについて分かりやすく学べる小冊子です

疾患や予防、ワクチン接種について学べる小冊子です
WEB講演会にアクセスし「このページは閲覧を制限しています」と表示された方は こちら>>
このサイトでは、医療用医薬品を適正にご使用いただくため、医師、歯科医師及び薬剤師などの医療関係者の方を対象に、主としてMSD株式会社の医療用医薬品に関する情報を提供しています。
下記の「はい」をクリックした場合、「MSD Connect ご利用規約」及び「ウェブサイトのご利用条件」を理解したうえで、内容に同意したものとみなします。
2024年11月にご利用規約を改訂致しました。上記リンクよりご確認ください。
あなたは医療関係者ですか?