製品基本Q&A
製品基本Q&A
ウェリレグ®
製品情報
本剤の電子添文では、以下の通り記載されています。
4. 効能又は効果
○フォン・ヒッペル・リンドウ病関連腫瘍
○がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌
5. 効能又は効果に関連する注意
<フォン・ヒッペル・リンドウ病関連腫瘍>
5.1 フォン・ヒッペル・リンドウ病と診断された患者に投与すること。
5.2 臨床試験に組み入れられた患者の腫瘍の状態等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.3 本剤の術後補助療法における有効性及び安全性は確立していない。
<がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌>
5.4 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.5 本剤の術後補助療法における有効性及び安全性は確立していない。
5.6 PD-1/PD-L1阻害剤及びVEGF 受容体チロシンキナーゼ阻害剤による治療歴のない患者に対する本剤の有効性及び安全性は確立していない。
<引用>
ウェリレグ® 電子添文
本剤は低酸素誘導因子2α(HIF-2α)に対する阻害作用を有する低分子化合物です。本剤は、HIF-2α とアリール炭化水素受容体核内輸送体(ARNT)の結合を阻害し、HIF-2α 標的遺伝子の転写を阻害することにより、細胞周期の停止、血管新生の阻害を引きおこし、腫瘍増殖抑制作用を示すと考えられています。
<引用>
ウェリレグ® 電子添文
使用方法
本剤の電子添文では、以下のとおり記載されています。
6. 用法及び用量
通常、成人には、ベルズチファンとして、1日1回120 mg を経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 本剤投与により副作用が発現した場合には、製品電子添文に記載されている表を参考に、本剤を休薬、減量又は中止すること。減量する場合には、用量を40 mg(1段階)ずつ減量すること。
<引用>
ウェリレグ® 電子添文
次の患者には投与しないでください。
本剤の成分に対し過敏症の既往歴のある患者
<引用>
ウェリレグ® 電子添文
次の患者に投与する場合には注意してください。
呼吸器疾患のある患者又はその既往歴のある患者〔低酸素症が発現又は増悪する可能性があります。〕
<引用>
ウェリレグ® 電子添文
中等度以上の肝機能障害(Child-Pugh 分類B 又はC)のある患者に対しては、本剤の減量を考慮するとともに、患者の状態をより慎重に観察し、副作用の発現に十分注意してください。本剤の血中濃度が上昇することがあり、副作用の発現割合や重症度が高くなるおそれがあります。なお、重度肝機能障害患者を対象とした臨床試験は実施していません。
母集団薬物動態解析に基づき、肝機能が正常な患者(752例)に対する軽度肝機能障害患者*1)(51例)における、定常状態時のベルズチファンのCmax及びAUC0-24の幾何平均比は、それぞれ0.94及び0.95でした。
ベルズチファン80 mgを単回経口投与した際、健康成人(8例)に対する中等度肝機能障害(Child-Pugh分類B)被験者(9例)におけるベルズチファンのCmax及びAUC0-∞の幾何平均比は、それぞれ0.98及び1.52でした(外国人データ)。
*1) NCI-ODWG(National Cancer Institute-Organ Dysfunction Working Group)基準による分類
【ウェリレグ®錠40mgの国内承認用法及び用量】
6. 用法及び用量
通常、成人には、ベルズチファンとして、1日1回120 mgを経口投与する。なお、患者の状態により適宜減量する。
<引用>
ウェリレグ® 電子添文
妊娠する可能性のある女性には、本剤投与中及び最終投与後1週間において避妊する必要性及び適切な避妊法について説明してください。経口避妊薬による避妊法の場合には、経口避妊薬以外の方法をあわせて使用するよう指導してください。
<引用>
ウェリレグ® 電子添文
男性には、本剤投与中及び最終投与後1週間においてバリア法(コンドーム)を用いて避妊する必要性について説明してください。
生殖可能な男性に投与する場合には、造精機能の低下により男性の生殖機能に影響を及ぼす可能性があることを考慮してください。ラットを用いた反復投与毒性試験において、臨床曝露量(AUC)を下回る曝露量で精巣の非可逆的な萎縮及び変性並びに精子減少が認められています。
<引用>
ウェリレグ® 電子添文
妊婦又は妊娠している可能性のある女性には、投与しないことが望ましいです。ラットを用いた胚・胎児発生試験において、臨床曝露量(AUC)を下回る曝露量で胚・胎児死亡、胎児体重の減少及び胎児の骨格異常が認められています。
<引用>
ウェリレグ® 電子添文
授乳しないことが望ましいです。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがあります。
<引用>
ウェリレグ® 電子添文
小児等を対象とした臨床試験は実施していません。
<引用>
ウェリレグ® 電子添文
ベルズチファン120mgを単回経口投与した際、健康成人に対する末期腎不全被験者におけるベルズチファンのCmax及びAUC0-∞の幾何平均比は、血液透析の実施2時間前にベルズチファンを投与された被験者で0.85及び0.94、血液透析の実施直後にベルズチファンを投与された被験者で0.70及び1.14でした(外国人データ)。
透析患者に対しては、本剤の投与の可否を慎重に判断してください。また、本剤を投与した際は、症状の発現や変化、臨床検査値の推移などに十分注意してください。
<引用>
ウェリレグ® 電子添文
電子添文上、過量投与時の対応に関する記載はありません。
米国添付文書の過量投与の項には、「本剤の過量投与に対する特別な処置はない。過量投与が疑われる場合には、本剤を休薬し、支持療法を行う」と記載されています。
過量投与後の投与再開時期については医療判断となります。患者ごとに状況も異なることから、実際の治療に際しては個別にご判断ください。
<引用>
ウェリレグ® 電子添文
ウェリレグ 米国添付文書
その日のうちに思い出したとき
服用を忘れた場合は、その日のうちにできるだけ早く服用してください。次の日からは通常どおりに服用してください。
翌日に思い出したとき
1日分だけを通常どおりに服用してください。絶対に2日分を 1度に服用しないでください。
本剤の分包、一包化はおすすめできません。
電子添文上、「湿気を避けるため、服用直前にPTPシートから取り出すよう指導すること。」と記載されています。
本剤を分包、又は他剤と一包化した際の安定性については検討していません。
<引用>
ウェリレグ® 電子添文
本剤を簡易懸濁して投与することは、承認外の用法となります。
簡易懸濁にて投与した際の薬物動態、有効性、安全性は検討していませんので、おすすめしていません。
簡易懸濁後の安定性データはありません。
本剤を粉砕して投与することは、承認外の用法となります。
以下の理由から、分割または粉砕することはおすすめしません。
・分割及び粉砕後の安定性は検討していません。
・分割または粉砕して投与した際の薬物動態、有効性及び安全性については検討していません。
・本剤はフィルムコーティング錠であり、割線はありません。
・本剤ではラットにおいて胚胎児毒性及び精巣毒性が認められています。
<引用>
ウェリレグ®電子添文
健康成人(14例)にベルズチファン120 mg を単回経口投与した際、空腹時投与に対する高脂肪食摂取後投与におけるベルズチファンのCmax及びAUC0-∞の幾何平均比は、それぞれ0.76及び1.00でした(外国人データ)。高脂肪食摂取後に投与した際のベルズチファンのCmaxは24%低下したことから、食事がベルズチファンの吸収速度に影響を及ぼす可能性が示唆されたものの、AUC0-∞は食事の有無にかかわらず同様であったことから、高脂肪食摂取後に認められたCmaxの低下は臨床的に意味があるものではないと考えられました。したがって、本剤は食事とは関係なく投与可能です。
<引用>
ウェリレグ® 電子添文
ウェリレグ® インタビューフォーム
安全性
エリスロポエチン(EPO)減少に伴う貧血があらわれることがあるので、本剤投与開始前及び投与期間中は血液検査(ヘモグロビン値測定等)を定期的に行い、患者の状態を十分観察してください。
低酸素症があらわれることがあるので、本剤投与開始前及び投与期間中は動脈血酸素飽和度(SpO2)を定期的に測定してください。
<引用>
ウェリレグ® 電子添文
<フォン・ヒッペル・リンドウ病関連腫瘍>
海外第Ⅱ相試験(LITESPARK-004試験)で、本剤120 mg 1日1回で投与された安全性解析対象例61例中61例(100.0%)に副作用が認められました。主な副作用(10%以上)は、貧血54例(88.5%)、疲労39例(63.9%)、悪心15例(24.6%)、浮動性めまい15例(24.6%)、呼吸困難11例(18.0%)、頭痛11例(18.0%)、筋肉痛8例(13.1%)及びALT 増加7例(11.5%)でした。
<がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌>
国際共同第Ⅲ相試験(LITESPARK-005試験)で、本剤120 mg 1日1回で投与された安全性解析対象例372例中331例(89.0%)に副作用が認められました。主な副作用(10%以上)は、貧血267例(71.8%)、疲労79例(21.2%)、低酸素症44例(11.8%)及び悪心39例(10.5%)でした。
<引用>
ウェリレグ® 電子添文
投与の手引きの「注意を要する有害事象」にて、各事象の対処法をご確認ください。
その他
薬剤交付時
PTP 包装の薬剤はPTP シートから取り出して服用するよう指導してください。PTP シートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがあります。
湿気を避けるため、服用直前にPTP シートから取り出すよう指導してください。
<引用>
ウェリレグ® 電子添文
室温で保存してください。
湿気を避けるため、服用直前にPTP シートから取り出すようにしてください。
<引用>
ウェリレグ® 電子添文
関連コンテンツ

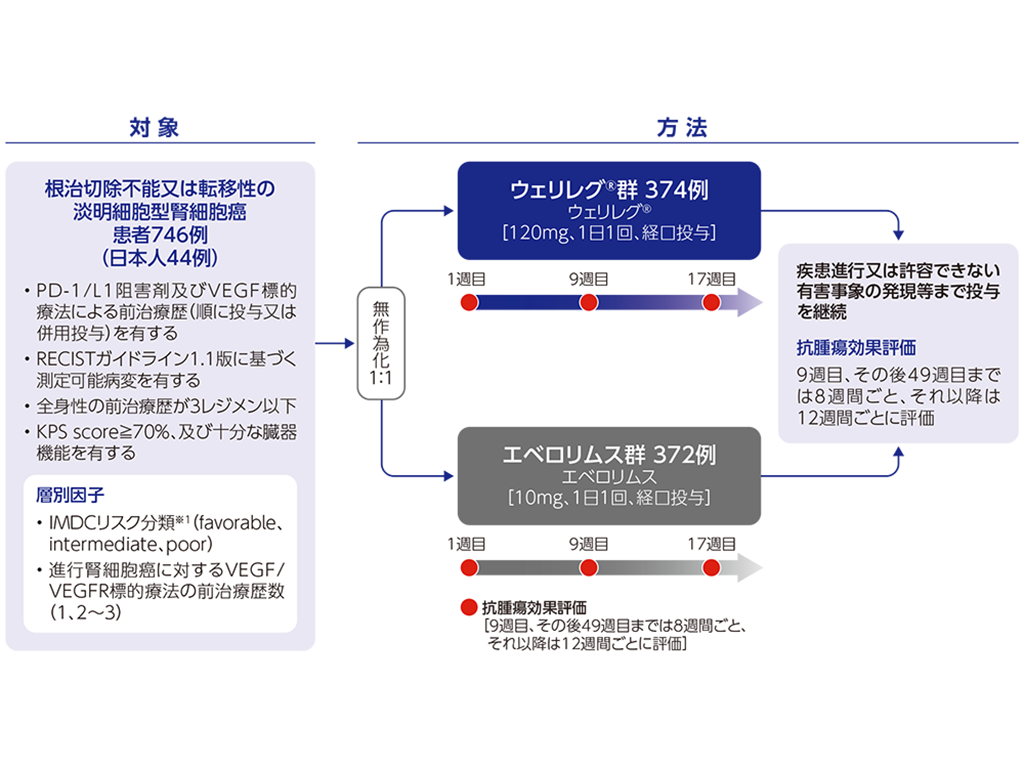
国際共同第Ⅲ相試験<LITESPARK-005試験>
国際共同第Ⅲ相試験<LITESPARK-005試験>承認時評価資料:国際共同第Ⅲ相試験(LITESPARK-005試験) […]
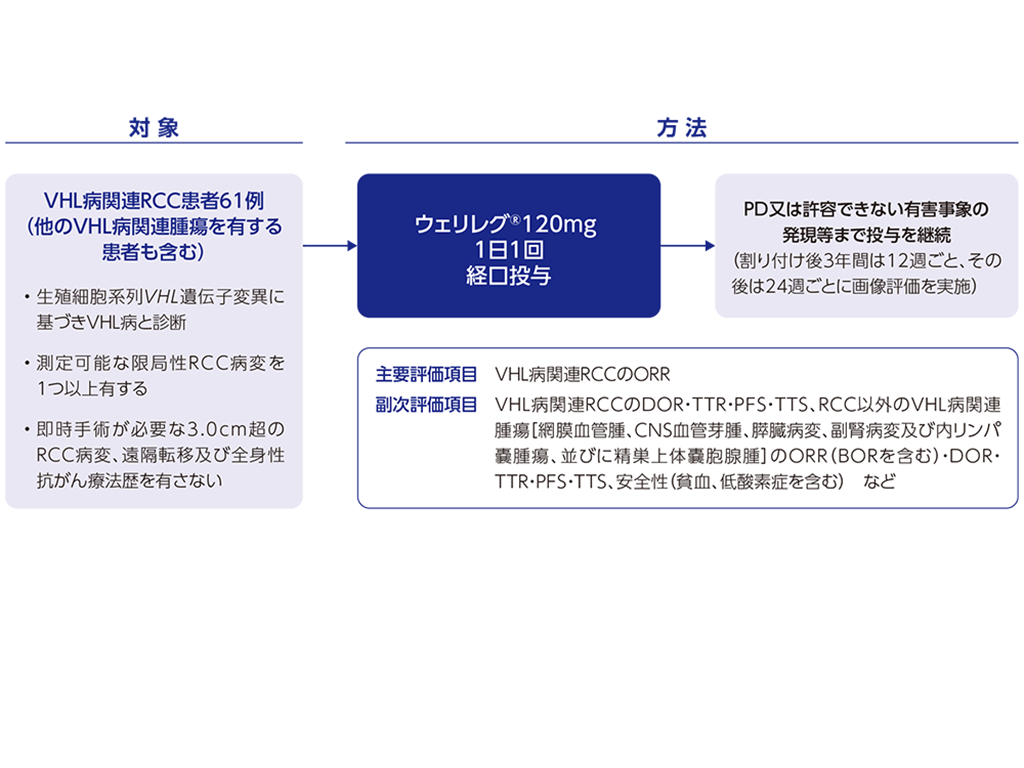
海外第Ⅱ相試験<LITESPARK-004試験>
海外第Ⅱ相試験<LITESPARK-004試験;海外データ>承認時評価資料:海外第Ⅱ相試験(LITESPARK-004試験) […]