開発の経緯
開発の経緯
ウェリレグ®錠40mg(一般名:ベルズチファン)は、米国Peloton Therapeutics社で開発が開始され、2019年にMerck & Co., Inc., Rahway, NJ, USAに導入された経口投与可能な世界初の低分子低酸素誘導因子(HIF)-2α阻害剤です。
正常な状態では、HIF-2αに対する酸素依存的な翻訳後修飾により、フォン・ヒッペル・リンドウ(VHL)蛋白質はHIF-2αを認識し、標的として速やかに分解します。低酸素状態及びVHL蛋白質の機能が喪失している状態では、HIF-2αが過度に安定化され、HIF-2αがアリール炭化水素受容体核内輸送体(ARNT、別名HIF-1β)と結合し、活性化された転写因子が核内に異常蓄積します。その結果、血管新生、増殖及び腫瘍代謝に関連する低酸素下で誘導される遺伝子が過剰発現します。VHL病患者では、VHL遺伝子の生殖細胞系列変異又は欠失がVHL蛋白質の機能喪失につながります。また、散発性淡明細胞型腎細胞癌(RCC)の90%超は、VHL遺伝子の体細胞変異又はエピジェネティックなサイレンシングのいずれかを有し、その結果VHL蛋白質の機能が喪失します1)。
ウェリレグ®は、HIF-2αとHIF-1βのヘテロ二量体形成を選択的に阻害し、VHL蛋白質の機能が喪失している状態において、血管新生、増殖及び腫瘍代謝に関連する低酸素下で誘導される遺伝子の 転写を阻害すると考えられます。
これらの知見からウェリレグ®の臨床開発が行われ、米国で最初の承認を取得しました。2025年2月現在、47の国又は地域で承認されています。
【フォン・ヒッペル・リンドウ病関連腫瘍】
ウェリレグ®のヒト初回投与試験として、進行固形がん患者注)を対象とした海外第Ⅰ相試験(LITESPARK-001試験)を実施し、ウェリレグ®の安全性、薬物動態、薬力学及び有効性が検討されました。臨床推奨用法・用量として120mg 1日1回が選択されました。
VHL病関連腫瘍に対しては、即時手術を必要としないVHL病関連腎細胞癌患者を対象とした海外第Ⅱ相試験(LITESPARK-004試験)が実施されました。米国では、LITESPARK-004試験に基づきFDAより「Breakthrough therapy」の指定を受け、2021年8月に「治療を必要とするが即時手術を必要としないVHL病関連のRCC、中枢神経系(CNS)血管芽腫及び膵神経内分泌腫瘍(pNET)」を効能又は効果として承認を取得しました。EUでは、2025年2月に「治療を必要とするが局所療法不適応のVHL病関連の限局性RCC、CNS血管芽腫又はpNET」を効能又は効果として承認を取得しました。
本邦では、LITESPARK-004試験及びLITESPARK-005試験を主要な評価資料として製造販売承認申請を行い、2025年6月に「フォン・ヒッペル・リンドウ病関連腫瘍」を効能又は効果として承認されました。
なお、ウェリレグ®は2024年2月9日に「フォン・ヒッペル・リンドウ(VHL)病関連の腫瘍性病変」を予定される効能又は効果として希少疾病用医薬品に指定されました[指定番号:(R5薬)第596号]。
【がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌】
がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌に対しては、PD-1/PD-L1阻害剤及び血管内皮細胞増殖因子(VEGF)標的療法による前治療歴を有する進行腎細胞癌患者を対象とした国際共同第Ⅲ相試験(LITESPARK-005試験)が実施されました。米国ではLITESPARK-005試験に基づき、2023年12月に「PD-1/PD-L1阻害剤及びVEGF標的療法による治療歴を有する進行淡明細胞型RCC」を効能又は効果として承認を取得しました。EUでは、2025年2月に「PD-1/PD-L1阻害剤及び少なくとも2種類のVEGF標的療法を含む2つ以上の治療歴を有する進行淡明細胞型RCC」を効能又は効果として承認を取得しました。
本邦では、LITESPARK-005試験を主要な評価資料として製造販売承認申請を行い、2025年6月に 「がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌」を効能又は効果として承認されました。
注)ウェリレグ®の承認された効能又は効果は次のとおりです。
効能又は効果:フォン・ヒッペル・リンドウ病関連腫瘍、がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌
関連コンテンツ

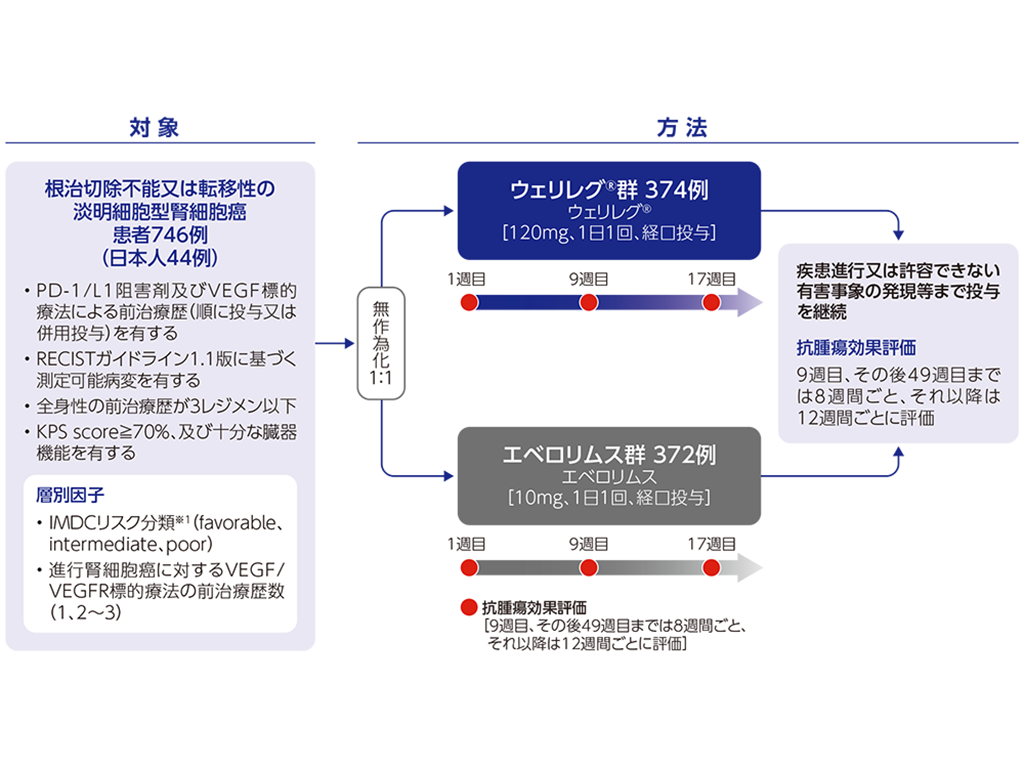
国際共同第Ⅲ相試験<LITESPARK-005試験>
国際共同第Ⅲ相試験<LITESPARK-005試験>承認時評価資料:国際共同第Ⅲ相試験(LITESPARK-005試験) […]
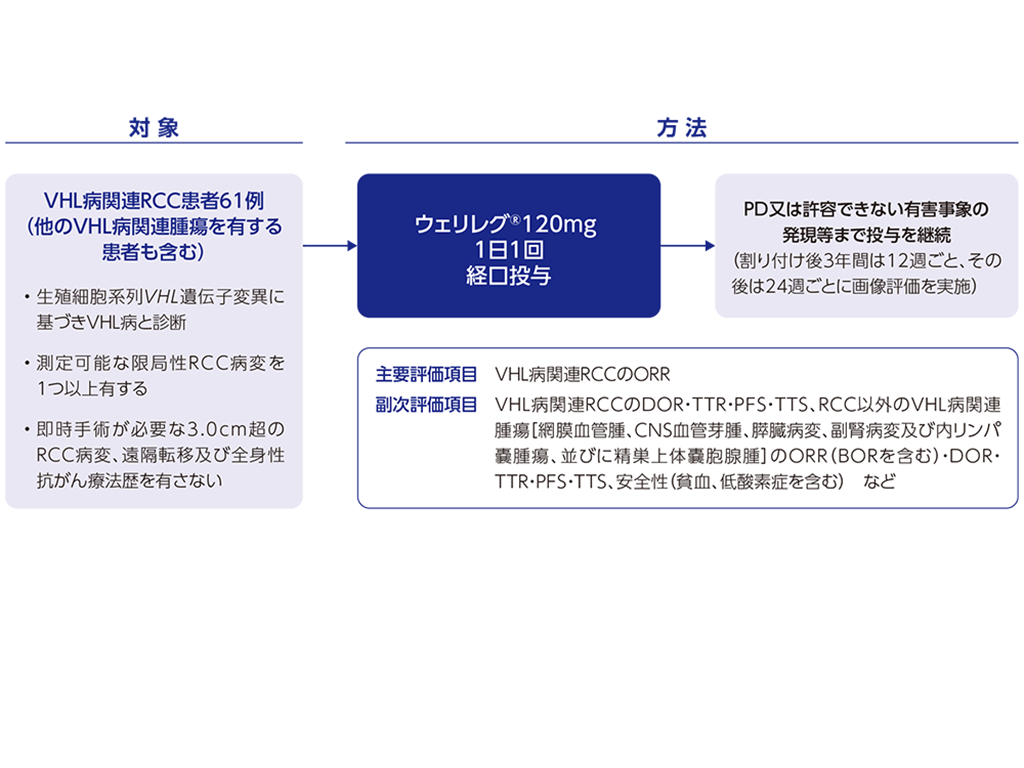
海外第Ⅱ相試験<LITESPARK-004試験>
海外第Ⅱ相試験<LITESPARK-004試験;海外データ>承認時評価資料:海外第Ⅱ相試験(LITESPARK-004試験) […]