製品特性
腎細胞癌*:製品特性
*がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌
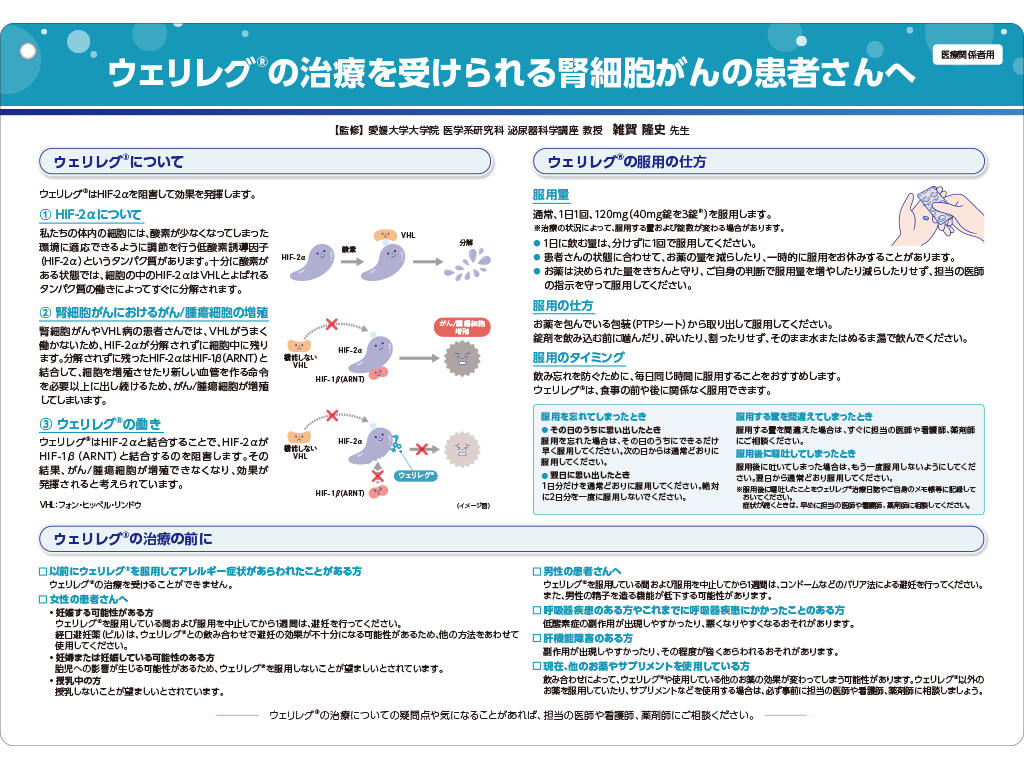
- ウェリレグ®はがん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌に対する治療薬として承認された新規作用機序HIF-2α阻害剤です。
-
ウェリレグ®は、根治切除不能又は転移性の腎細胞癌患者を対象とした国際共同第Ⅲ相試験(LITESPARK-005試験)において、mTOR阻害剤エベロリムスに対してPFS†を有意に延長し、ORR‡を有意に改善しました(優越性試験、検証的解析結果)。
エベロリムス群に対するウェリレグ®群のPFSのハザード比は、0.75(95%CI:0.63,0.90)でした(p=0.00077、層別ログランク検定[片側]、有意水準α=0.0021; 検証的解析結果)。
エベロリムス群に対するウェリレグ®群のORRの差の推定値は、18.4%(95%CI:14.0, 23.2)でした(p<0.00001、層別Miettinen and Nurminen法[片側]、有意水準α=0.001;検証的解析結果)。なお、OS§に関しては優越性が検証されませんでした。
† PFS(progression-free survival):無増悪生存期間。RECISTガイドライン1.1版に基づき盲検下の独立判定委員会(blinded independent central review:BICR)の判定により評価した。
‡ ORR(objective response rate):奏効率。RECISTガイドライン1.1版に基づきBICRの判定により評価した。
§ OS(overall survival):全生存期間
-
ウェリレグ®は1日1回の経口投与製剤です。
ウェリレグ®の用法及び用量は以下のとおりです。
「通常、成人には、ベルズチファンとして、1日1回120mgを経口投与する。なお、患者の状態により適宜減量する。」
-
安全性
重大な副作用として、貧血、低酸素症が報告されています。
主な副作用として、悪心、疲労等が報告されています。
詳細につきましては電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
関連コンテンツ

がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌における新規作用機序 HIF-2α阻害剤ウェリレグ®―LITESPARK-005試験―
本動画では、腎細胞癌の病態及びウェリレグ®の作用機序に加えて、腎細胞癌におけるウェリレグ®のエビデンスである「LITESPARK-005試験」の結果について、わ […]
ウェリレグ®・悪性腫瘍関連領域情報

がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌における新規作用機序 HIF-2α阻害剤ウェリレグ®―LITESPARK-005試験―
本動画では、腎細胞癌の病態及びウェリレグ®の作用機序に加えて、腎細胞癌におけるウェリレグ®のエビデンスである「LITESPARK-005試験」の結果について、わ […]
