KEYNOTE-A17試験(日本人集団)
KEYNOTE-A17試験
承認時評価資料:国内第Ⅰb相試験(KEYNOTE-A17試験)
試験概要
【目的】
化学療法歴のない切除不能な進行・再発の悪性胸膜中皮腫患者における、キイトルーダ®+化学療法の忍容性、安全性及び有効性を検討する。
【デザイン】
国内非盲検単群第Ⅰb相試験
[主要解析(データカットオフ日:2021年6月22日)]
[試験終了(データカットオフ日:2022年9月21日)]
【対象】
化学療法歴のない切除不能な進行・再発の悪性胸膜中皮腫の日本人患者19例
【方法】
キイトルーダ®200mg+シスプラチン75mg/m2+ペメトレキセド500mg/m2を3週間間隔で点滴静注した。DLT*1の評価期間は1コース目(最初の3週間)とした。最初の24週は6週間ごと、その後60週までは9週間ごと、それ以降は12週間ごとに画像診断により評価した。疾患進行又は許容できない毒性発現等による投与中止、又は投与完了まで投与を継続した。キイトルーダ®の投与は最大で35サイクルまで、シスプラチン及びペメトレキセドの投与は最大4~6サイクルとした。
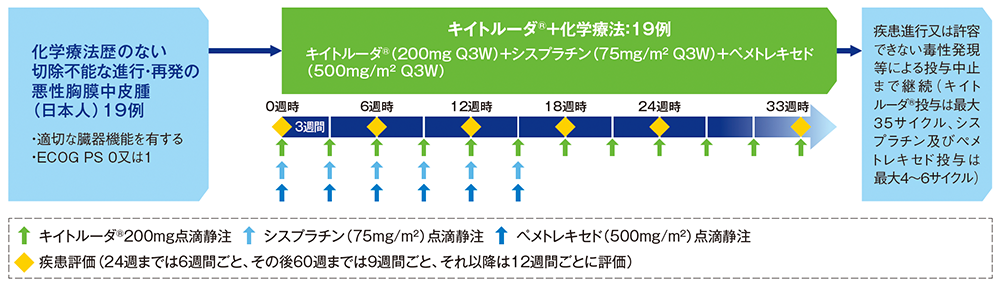
【評価項目】
主要評価項目:用量制限毒性(dose limiting toxicity; DLT)、安全性
副次評価項目:奏効率(objective response rate; ORR)、病勢コントロール率(disease control rate; DCR)、奏効期間(duration of response; DOR)
探索的評価項目:全生存期間(overall survival; OS)、無増悪生存期間(progression free survival; PFS)
【判定基準】
DLTの発現が18例中8例以下であった場合、キイトルーダ®+化学療法を忍容と判断した。DLTの妥当性については、必要に応じて外部の効果安全性委員の助言を受け、最終的に治験依頼者と治験責任医師が決定した。
ORR、DCR、DOR及びPFSは、治験担当医師がmRECIST*2に基づき評価した。
【解析計画】
解析対象集団:安全性及び有効性はAPaT集団*3を解析対象とした。ただし、DLTの評価はDLT評価可能集団*4を対象とした。
DLTの統計解析:DLTの発現割合及びBeta(1,1)を事前分布とした際のDLTの発現割合のベイズ流90%信用区間を算出した。
有効性解析の統計手法:ORR及びDCRは、点推定値及び二項分布に基づく正確法による95%信頼区間(CI)を算出した。DORはKaplan-Meier法を用いて推定した。OS及びPFSはKaplan-Meier法を用いて推定した。
*1 DLT評価期間である1コース目に、以下に定義する血液毒性、非血液毒性及び全般のうち、いずれかが認められ、治験担当医師がキイトルーダ®及び/又は併用する化学療法と因果関係があると判定した場合をDLTとする
血液毒性:
- Grade 4の血液毒性(発現期間を問わない。ただし、好中球減少症及び発熱性好中球減少症は下記の通りとする。)
- Grade 4の好中球減少症(適切な支持療法にもかかわらず7日間を超えて持続する場合。)
- Grade 4の発熱性好中球減少症(発現期間を問わない。ただし、治験担当医師及び治験依頼者が臨床的に重大な事象であると判断した場合のみ。)
非血液毒性:
- Grade 4の非血液毒性(一過性の電解質異常を含む臨床検査値異常を除く)
- 適切な支持療法にもかかわらず72時間を超えて持続する、Grade 3の非血液毒性(臨床検査値異常を除く)
- Grade 4の臨床検査値異常(血小板数減少と好中球数減少は、「血液毒性」の定義に従う)
- 7日間を超えて持続するGrade 3以上の臨床検査値異常
全般:
- キイトルーダ®及び/又は併用する化学療法と因果関係のある毒性により2コース目の投与開始が2週間を超えて遅延(初回投与日から36日以上)した場合
- Grade 5
*2 mRECIST(modified RECIST 1.1 for mesothelioma):悪性胸膜中皮腫患者向けに改編したRECISTガイドライン1.1版の改訂版
*3 APaT(all participants as treated)集団:治験薬を1回以上投与されたすべての患者
*4 APaT集団から、DLT評価期間終了前に治験薬投与を中止した1例が除外された
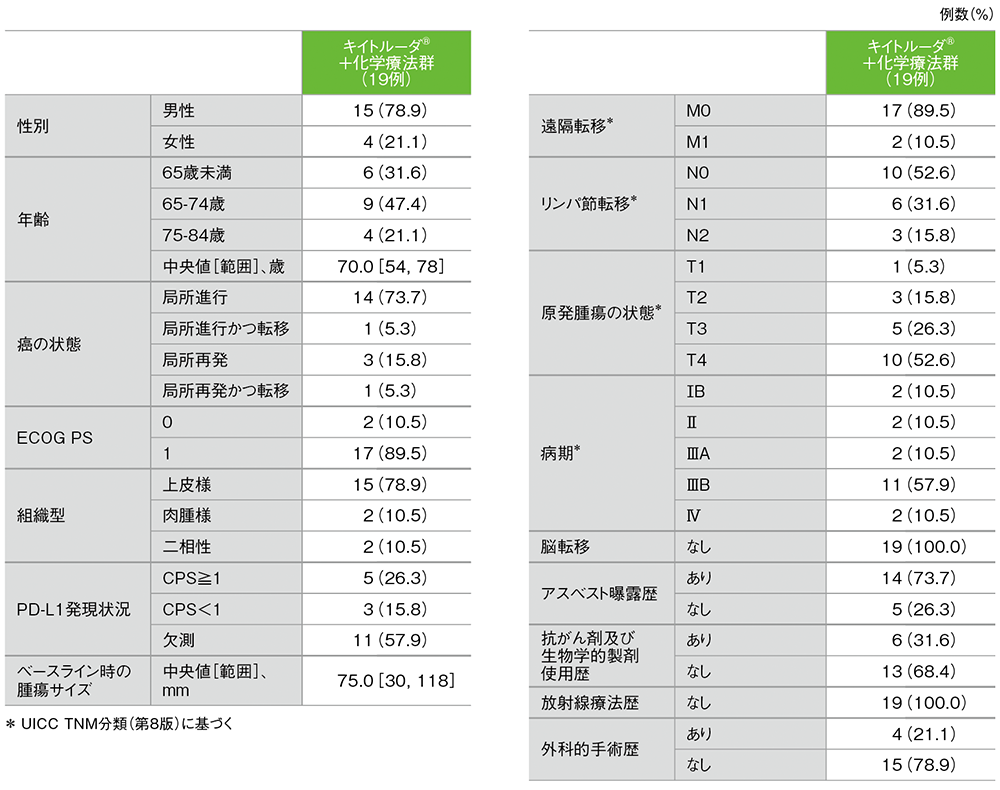
患者背景
■患者背景(APaT集団)
■投与状況(APaT集団)
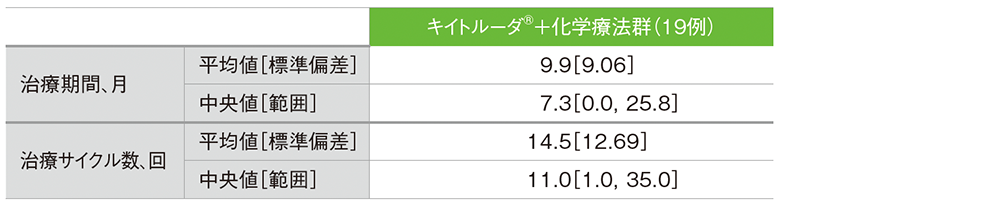
データカットオフ日:2022年9月21日
主要評価項目 用量制限毒性(DLT)
用量制限毒性(DLT)(DLT評価可能集団*)

- キイトルーダ®+化学療法の投与1コース目のDLT発現割合は事前に規定した忍容性の基準を下回り、忍容性が認められました。
- キイトルーダ®+化学療法を投与した18例中2例(11.1%)に1件以上のDLTが認められ、1例はGrade 3のぶどう膜炎を発現し、別の1例ではGrade 3の倦怠感、Grade 2の発熱及びGrade 3の低アルブミン血症を発現しました。いずれの事象も治験担当医師により治験薬との関連ありと判定されました。
* APaT集団から、DLT評価期間終了前に治験薬投与を中止した1例が除外された
データカットオフ日:2021年6月22日
主要評価項目 安全性
副作用の詳細(APaT集団)

■副作用

■重篤な副作用

■投与中止に至った副作用

- 本試験において、死亡に至った有害事象は1例(細菌性肺炎)に認められましたが、治験担当医師により治験薬との関連なしと判定されました。
MedDRA v25.0
データカットオフ日:2022年9月21日
■副作用一覧(APaT集団)
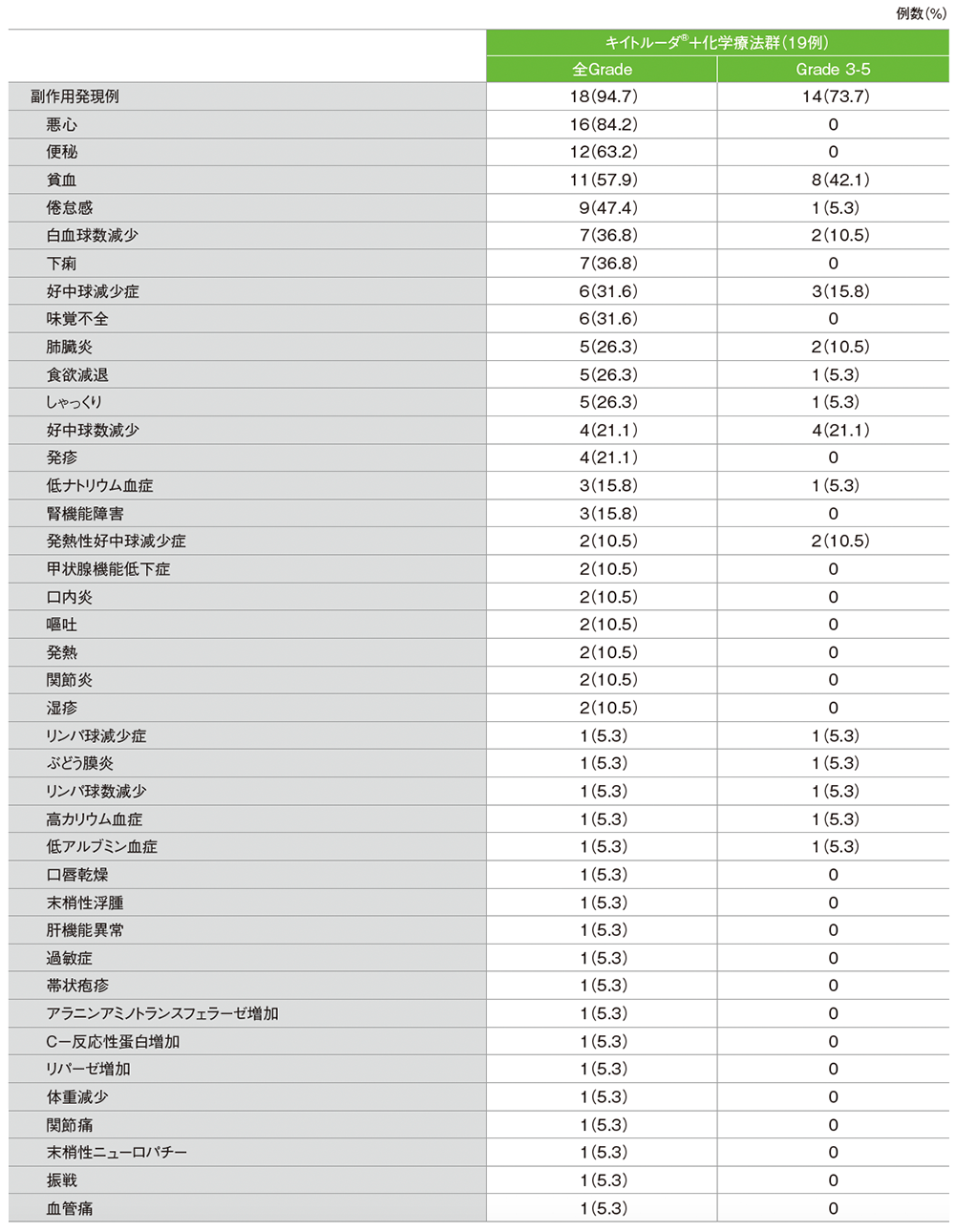
MedDRA v25.0、GradeはCTCAE v5.0
データカットオフ日:2022年9月21日
免疫関連など特に注目すべき有害事象の詳細(APaT集団)

■免疫関連など特に注目すべき有害事象

MedDRA v25.0
データカットオフ日:2022年9月21日
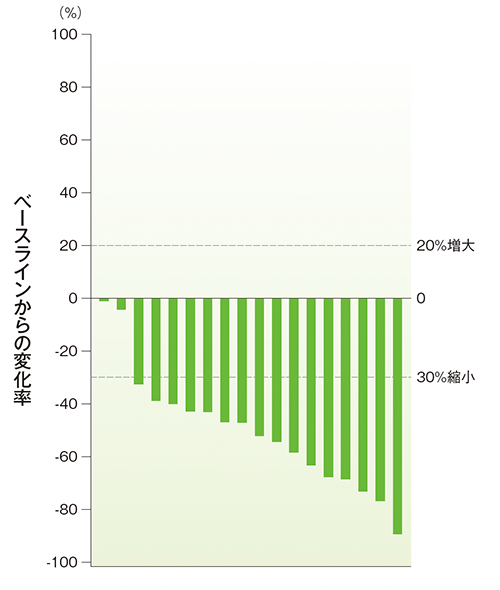
副次評価項目 奏効率(ORR)、病勢コントロール率(DCR)
奏効率(ORR)(APaT集団)、病勢コントロール率(DCR)(APaT集団)

- ORRは73.7%(95%CI: 48.8, 90.9)、DCRは94.7%(95%CI: 74.0, 99.9)でした。
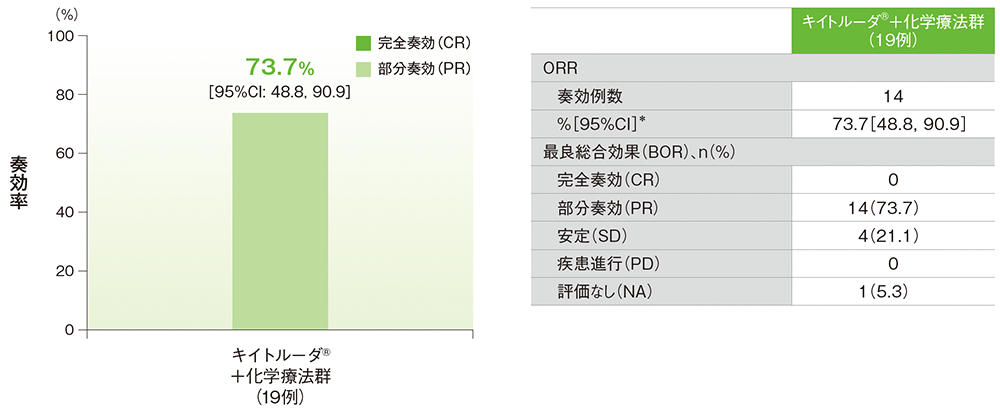
mRECISTに基づく治験担当医師による評価
* 二項分布による正確法に基づく
データカットオフ日:2022年9月21日
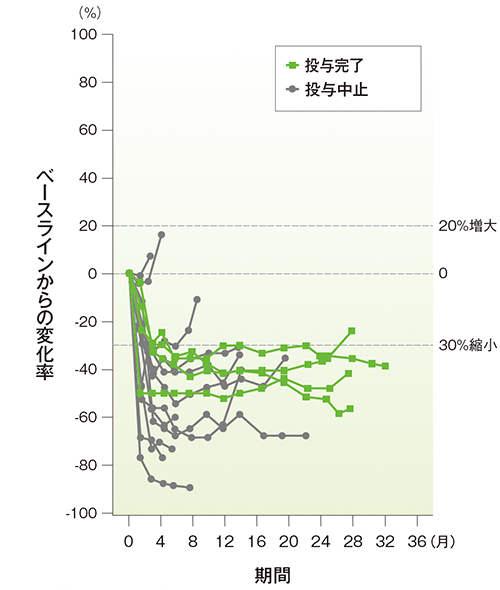
副次評価項目 奏効期間(DOR)
奏効期間(DOR)(APaT集団)

- DOR中央値は16.8ヵ月(範囲: 3.0, 26.3+)でした。
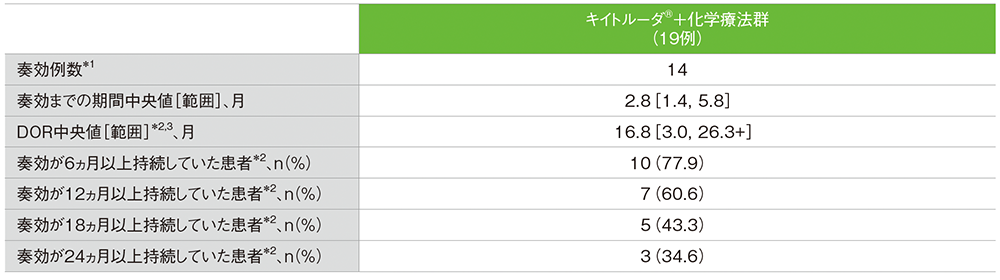
mRECISTに基づく治験担当医師による評価
*1 CR又はPRが認められた患者数
*2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*3 「+」は最後の疾患評価までにPDがみられなかったことを示す
データカットオフ日:2022年9月21日
関連コンテンツ


キイトルーダ®患者さんやご家族、一般の方向け疾患説明用資料:〈胸膜中皮腫編〉

【悪性胸膜中皮腫】悪性胸膜中皮腫における化学療法併用治療としてのキイトルーダ®の臨床成績 KEYNOTE-483 KEYNOTE-A17
キイトルーダ®は2025年5月、「切除不能な進行・再発の悪性胸膜中皮腫」の1次治療に対して承認を取得いたしました。本動画では、悪性胸膜中皮腫の治療としてキイトル […]
キイトルーダ®・悪性腫瘍関連領域情報

キイトルーダ®治療日誌:<頭頸部癌>キイトルーダ®術前補助療法