KEYNOTE-483試験
KEYNOTE-483試験
承認時評価資料:海外第Ⅱ/Ⅲ相試験(KEYNOTE-483試験)
Chu Q et al. Lancet 2023; 402: 2295-2306
本試験はMSD社の資金提供により行われた。著者にMSD社より顧問料などを受領している者が含まれる。また、著者にMSD社の社員が含まれる。
※ 本試験は開始時点では第Ⅱ相試験として計画され、キイトルーダ®+化学療法群、化学療法群、キイトルーダ®単独群に無作為に割り付けたが、中間解析でキイトルーダ®単独群における病勢コントロール率が他群と比較して低かったことから、キイトルーダ®単独群への登録を中止し 、キイトルーダ®+化学療法群、化学療法群を比較する第Ⅲ相試験として継続されました。
試験概要
【目的】
化学療法歴のない切除不能な進行・再発の悪性胸膜中皮腫患者における、キイトルーダ®+化学療法群と化学療法群の有効性及び安全性を比較検討する。
【デザイン】
海外無作為化非盲検第Ⅱ/Ⅲ相試験 [優越性試験]
[中間解析(データカットオフ日:2021年7月30日)]
[最終解析(データカットオフ日:2022年9月16日)]
【対象】
化学療法歴のない切除不能な進行・再発の悪性胸膜中皮腫患者480例*1
【方法】
キイトルーダ®+化学療法群[キイトルーダ®200mg+シスプラチン75mg/m2(又はカルボプラチン*2AUC5又は6mg・min/mL相当量)+ペメトレキセド500mg/m2を3週間間隔で点滴静注]、化学療法群[シスプラチン75mg/m2(又はカルボプラチン*2AUC5又は6mg・min/mL相当量)+ペメトレキセド500mg/m2を3週間間隔で点滴静注]に1:1の割合で無作為に割り付けた。最初の18週は、6週間ごと、その後は12週間ごとに画像診断により評価した。疾患進行又は再発、許容できない毒性発現等による投与中止、又は投与完了まで投与を継続した。キイトルーダ®の投与は最大で35サイクルまで、シスプラチン、カルボプラチン及びペメトレキセドの投与は最大で6サイクルまでとした。
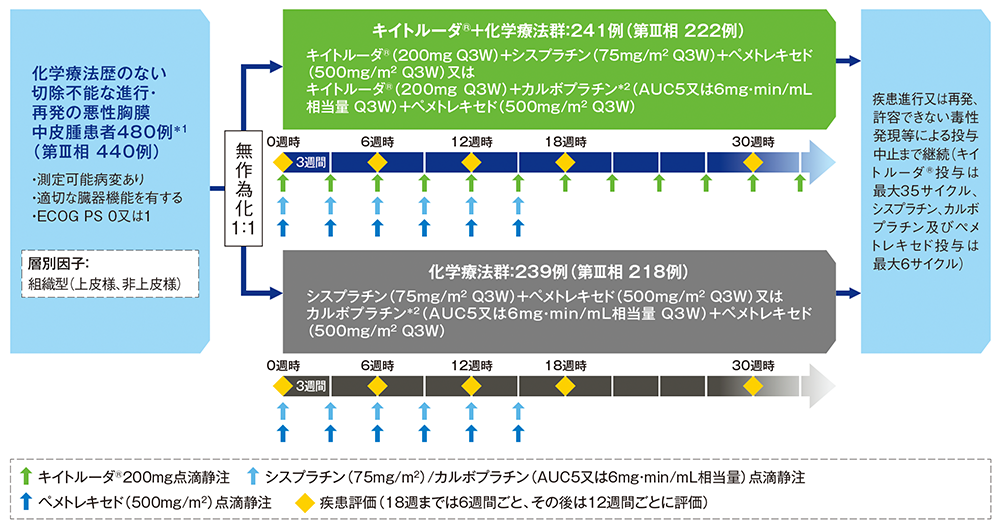
【評価項目】
主要評価項目:全生存期間(overall survival; OS)#
副次評価項目:無増悪生存期間(progression free survival; PFS)#、奏効率(objective response rate; ORR)#、健康関連QOLのベースラインから最初に10ポイント以上悪化するまでの期間(time to true deterioration; TTD)(QOLの項目:咳嗽、胸痛、呼吸困難、全般的な健康状態/QOLスコア、身体機能スコア)、安全性
# 検証的解析項目
【判定基準】
PFS及びORRは、BICR*3がmRECIST*4に基づき評価した。健康関連QOLに関するPRO*5はEORTC QLQ-LC13(咳嗽、胸痛)、EORTC QLQ-C30(呼吸困難、全般的な健康状態/QOLスコア、身体機能スコア)を用いて評価した。
【解析計画】
解析対象集団:有効性は第Ⅲ相パート ITT集団*6、健康関連QOLはPRO FAS集団*7、安全性はAPaT集団*8を解析対象とした。
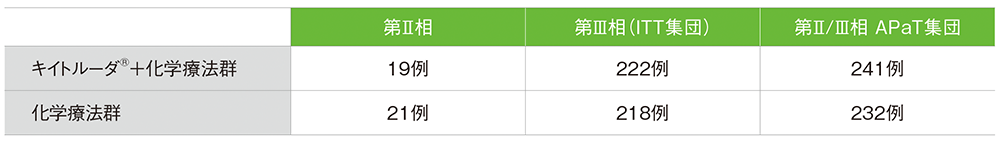
第Ⅱ相及び第Ⅲ相に組み入れられた患者数
有効性解析の統計手法:OS及びPFSはKaplan-Meier法を用いて生存曲線を推定し、層別ログランク検定を用いて群間を比較した。OS及びPFSは投与群を共変量とした層別Cox比例ハザードモデル(タイデータにはEfron法で対応する)を用いてハザード比及び95%信頼区間(CI)を算出した。ORRの群間比較は各層の症例数に基づき重み付けした層別Miettinen and Nurminen法を用いて評価し、ORRの差及びその95%CIを算出した。また、ORRの点推定値及びその95%CIはClopper-Pearson法(二項分布による正確法)を用いて算出した。OS、PFS及びORRのサブグループ解析を、層別因子[組織型(上皮様、非上皮様)]及び地域(EU、EU以外)、ECOG PS(0、1)、初回化学療法(シスプラチン、カルボプラチン)、PD-L1 CPS*9発現状況(陽性、陰性)、年齢(65歳未満、65歳以上)(65歳未満、65-74歳、75-84歳、85歳以上)、性別(男性、女性)、人種(白人、その他)、喫煙歴(現喫煙者/喫煙歴あり、喫煙歴なし)について、OS及びPFSは非層別Cox比例ハザードモデル、ORRは非層別Miettinen and Nurminen法を用いて実施した。
健康関連QOLのTTDの統計手法:悪性胸膜中皮腫の一般的な症状[咳嗽、胸痛(EORTC QLQ-LC13 項目1、10)、呼吸困難(EORTC QLQ-C30 項目8)]及び全般的な健康状態/QOLスコア、身体機能スコア(EORTC QLQ-C30項目29、30、1-5)について、ベースラインから最初に10ポイント以上悪化が確認されるまでの期間をKaplan-Meier法を用いて推定し、層別ログランク検定を用いて群間を比較した。投与群を共変量とした層別Cox比例ハザードモデル(タイデータにはEfron法で対応する)によりハザード比及び95%CIを算出した。
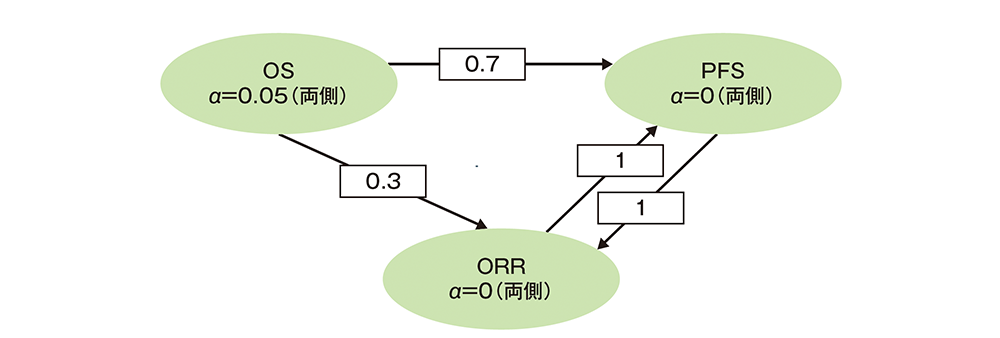
多重性の調整:本試験は1回の中間解析及び最終解析を事前に計画し、中間解析ではOS、PFS及びORR、最終解析ではOS及びPFSを解析した。多重性については、Maurer and Bretzによるグラフィカルアプローチを用いて試験全体の有意水準を片側2.5%として厳密に制御した。中間解析及び最終解析のいずれかの時点でOSの仮説が棄却された場合に、PFSを検定することとした。PFSではLan-DeMetsによるO’Brien-Fleming型の境界値を用いて、第1種の過誤の確率を制御した。また、OSの仮説が棄却された場合は、ORRはα=0.0075(片側)にて中間解析時点のデータを用いて検定することとした。PFSの仮説が棄却された場合、有意水準をORRに再配分し、ORRの仮説が棄却された場合、有意水準をPFSに再配分した。
*1 第Ⅱ相パートのキイトルーダ®+化学療法群19例、化学療法群21例を含む
*2 シスプラチンが禁忌であった場合、カルボプラチンの投与を可能とし、シスプラチンに対する忍容性がないと判断された場合、カルボプラチンに変更可能とした
*3 BICR(blinded independent central review):盲検下独立判定委員会
*4 mRECIST(modified RECIST 1.1 for mesothelioma):悪性胸膜中皮腫患者向けに改編したRECISTガイドライン1.1版の改訂版
*5 PRO(patient-reported outcome):患者報告アウトカム
*6 ITT(intention-to-treat)集団:無作為化したすべての患者
*7 PRO FAS(PRO full analysis set)集団:第Ⅲ相パートで無作為化したすべての患者のうち、治験薬を1回以上投与され、かつ、PROの評価を1回以上実施した患者
*8 APaT(all participants as treated)集団:第Ⅱ相パート及び第Ⅲ相パートで治験薬を1回以上投与されたすべての患者
*9 CPS(combined positive score):PD-L1陽性細胞数(腫瘍細胞、リンパ球及びマクロファージ)を総腫瘍細胞数で除し、100を乗じた値
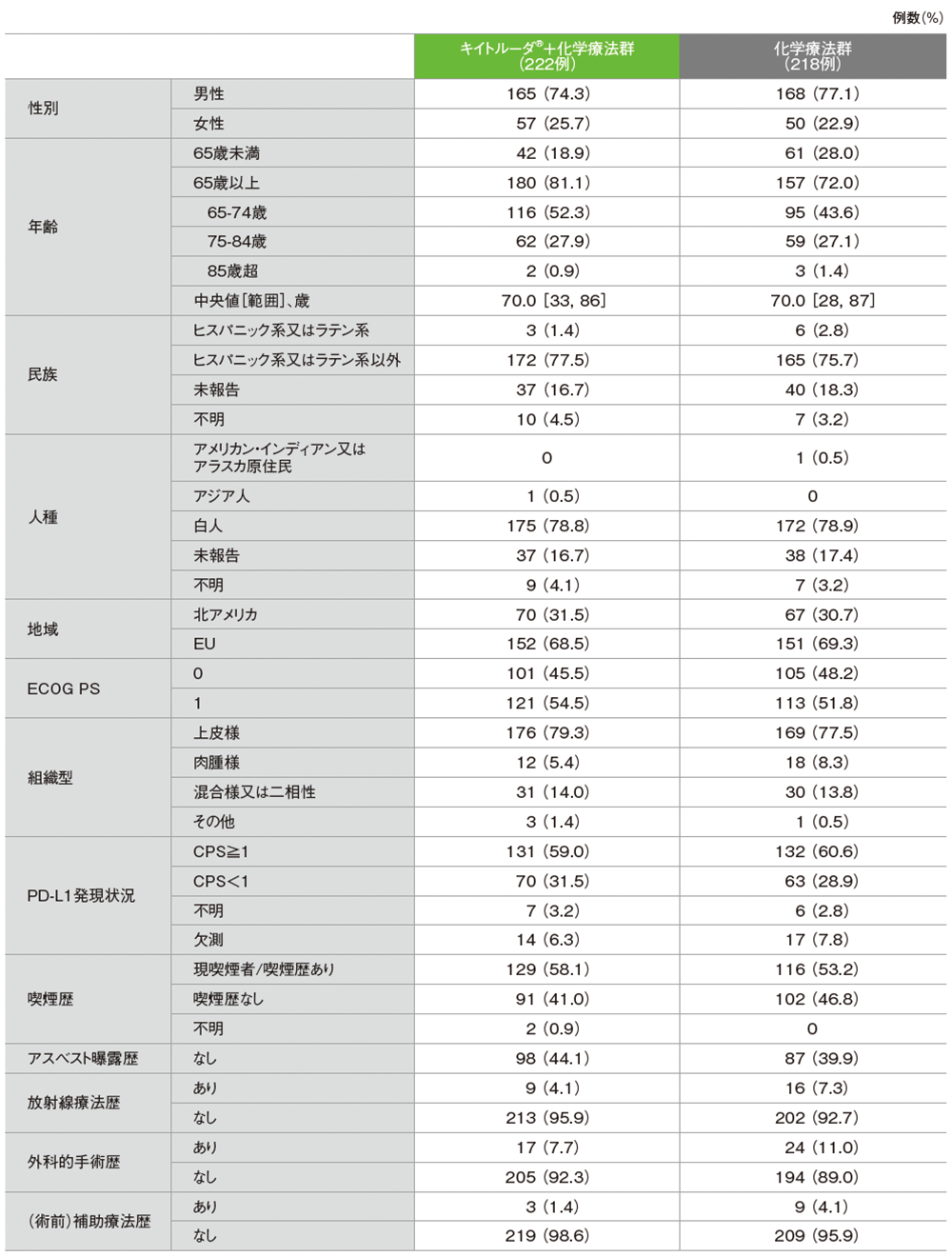
患者背景
■患者背景(第Ⅲ相パート ITT集団)
■プラチナ製剤投与状況(第Ⅲ相パート ITT集団)
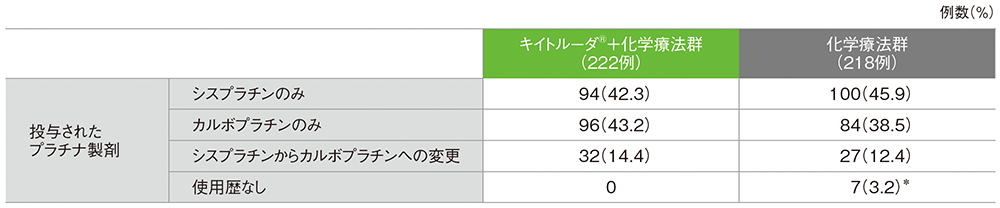
*ペメトレキセドを含む治験薬を一度も投与しなかった
■投与状況(APaT集団*)
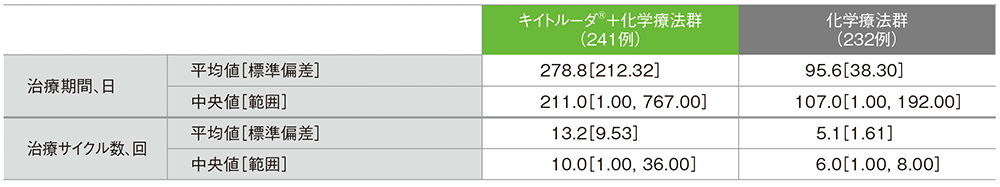
* 第Ⅱ相パート及び第Ⅲ相パートで治験薬を1回以上投与されたすべての患者
データカットオフ日:2022年9月16日
主要評価項目 全生存期間(OS)
全生存期間(OS)(第Ⅲ相パート ITT集団)(検証的解析結果*)
*p=0.0162

- 最終解析時点で、キイトルーダ®+化学療法群は化学療法群に対してOSを有意に延長し、ハザード比は0.79(95%CI: 0.64, 0.98)でした(p=0.0162、層別ログランク検定[片側]、有意水準α=0.0204; 検証的解析結果)。OS中央値はキイトルーダ®+化学療法群で17.3ヵ月(95%CI:14.4, 21.3)、化学療法群で16.1ヵ月(95%CI: 13.1, 18.2)でした。
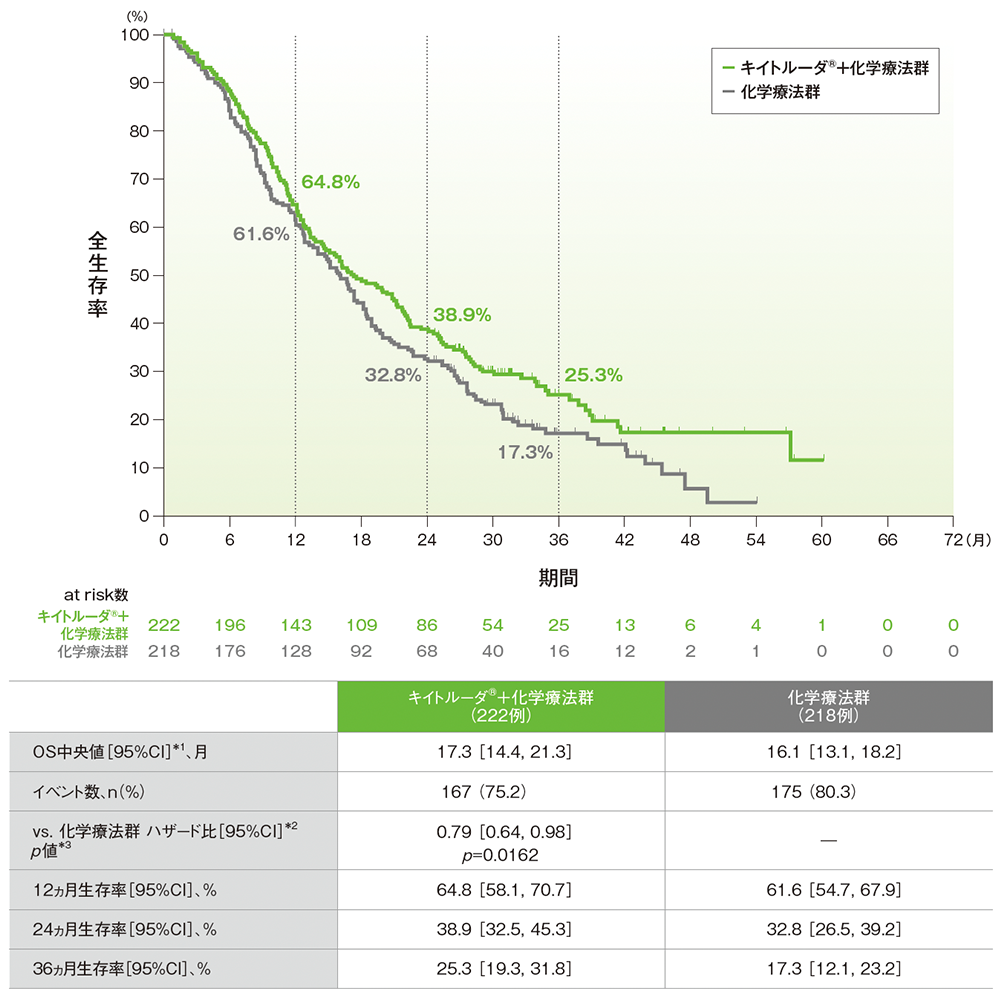
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量、組織型(上皮様、非上皮様)を層別因子とし、タイデータにはEfron法を用いた層別Cox比例ハザードモデルに基づく
*3 組織型(上皮様、非上皮様)を層別因子とした層別ログランク検定[片側]、有意水準α=0.0204
データカットオフ日:2022年9月16日
サブグループ解析 部分集団因子別の全生存期間(OS)(第Ⅲ相パート ITT集団)

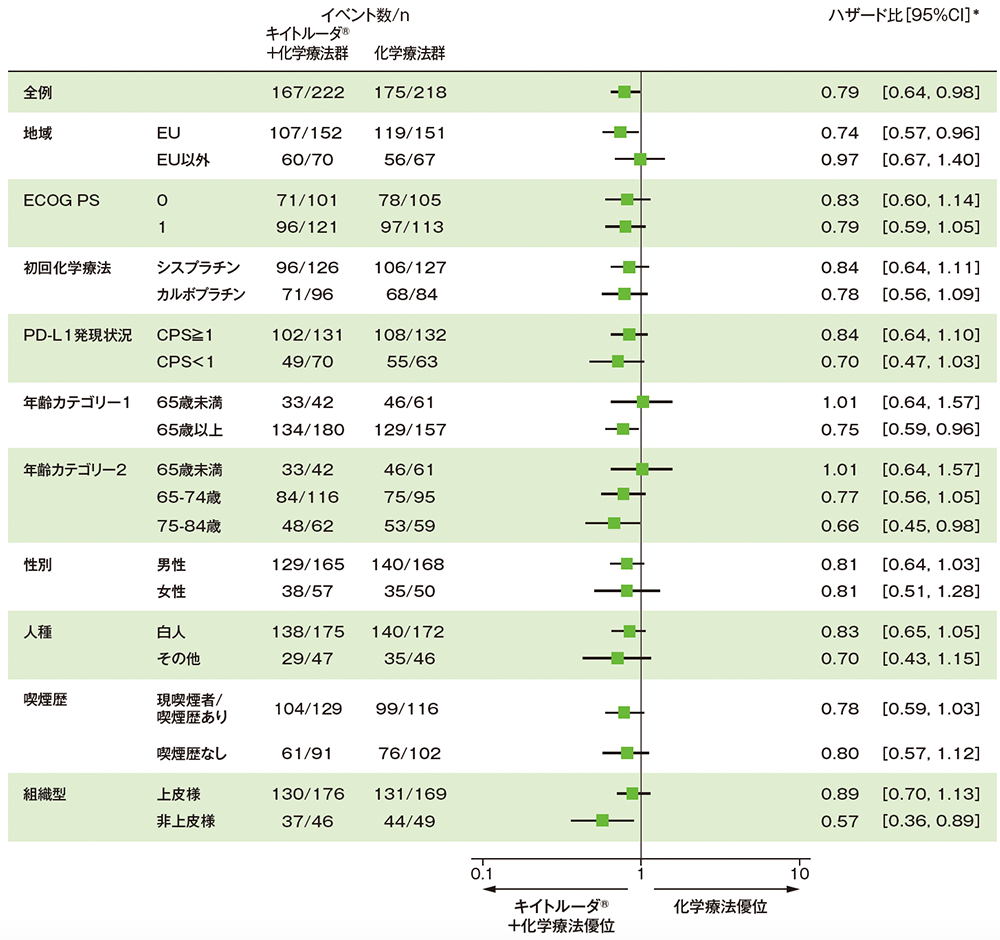
* 全集団は投与群を共変量とし、組織型(上皮様、非上皮様)を層別因子とした層別Cox比例ハザードモデル、部分集団は投与群を共変量とした非層別Cox比例ハザードモデルに基づく
データカットオフ日:2022年9月16日
サブグループ解析 組織型別の全生存期間(OS)(第Ⅲ相パート ITT集団)

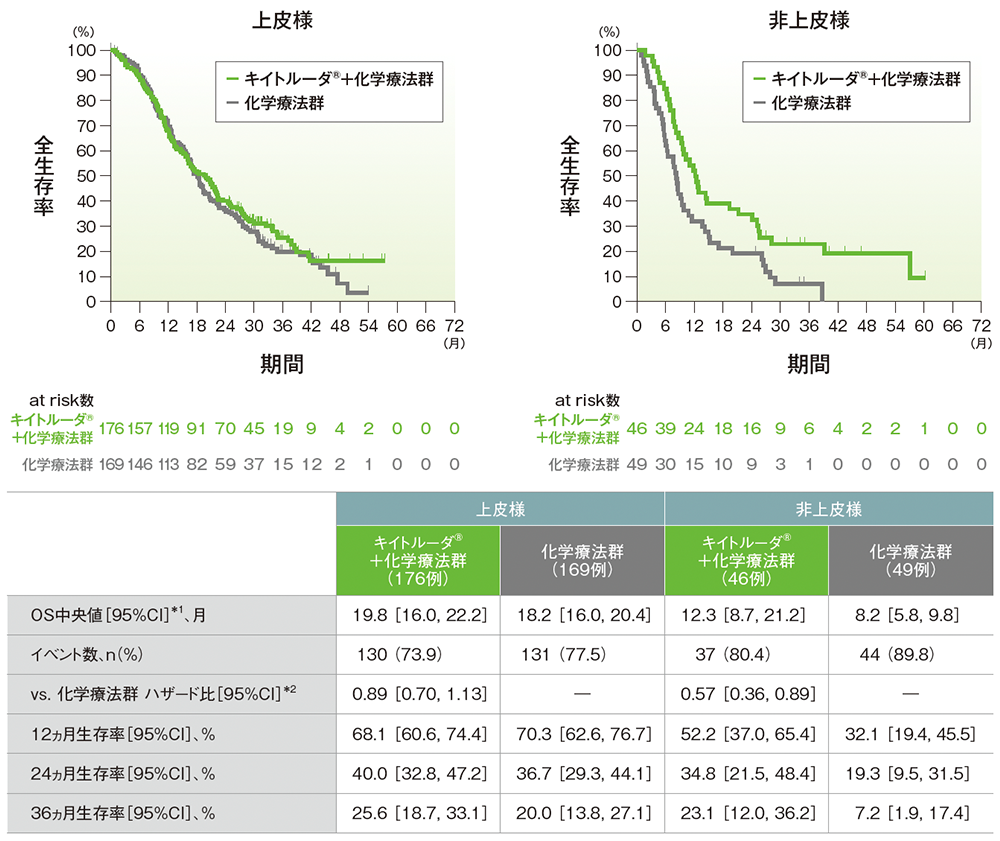
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、タイデータにはEfron法を用いた非層別Cox比例ハザードモデルに基づく
データカットオフ日:2022年9月16日
副次評価項目 無増悪生存期間(PFS)
無増悪生存期間(PFS)(第Ⅲ相パート ITT集団)(検証的解析結果*)

*p=0.0194
- 最終解析時点で、キイトルーダ®+化学療法群は化学療法群に対してPFSを有意に延長し、ハザード比は0.80(95%CI:0.65, 0.99)でした(p=0.0194、層別ログランク検定[片側]、有意水準α=0.0227; 検証的解析結果)。PFS中央値はキイトルーダ®+化学療法群で7.1ヵ月(95%CI: 6.9, 8.1)、化学療法群で7.1ヵ月(95%CI: 6.8, 7.7)でした。
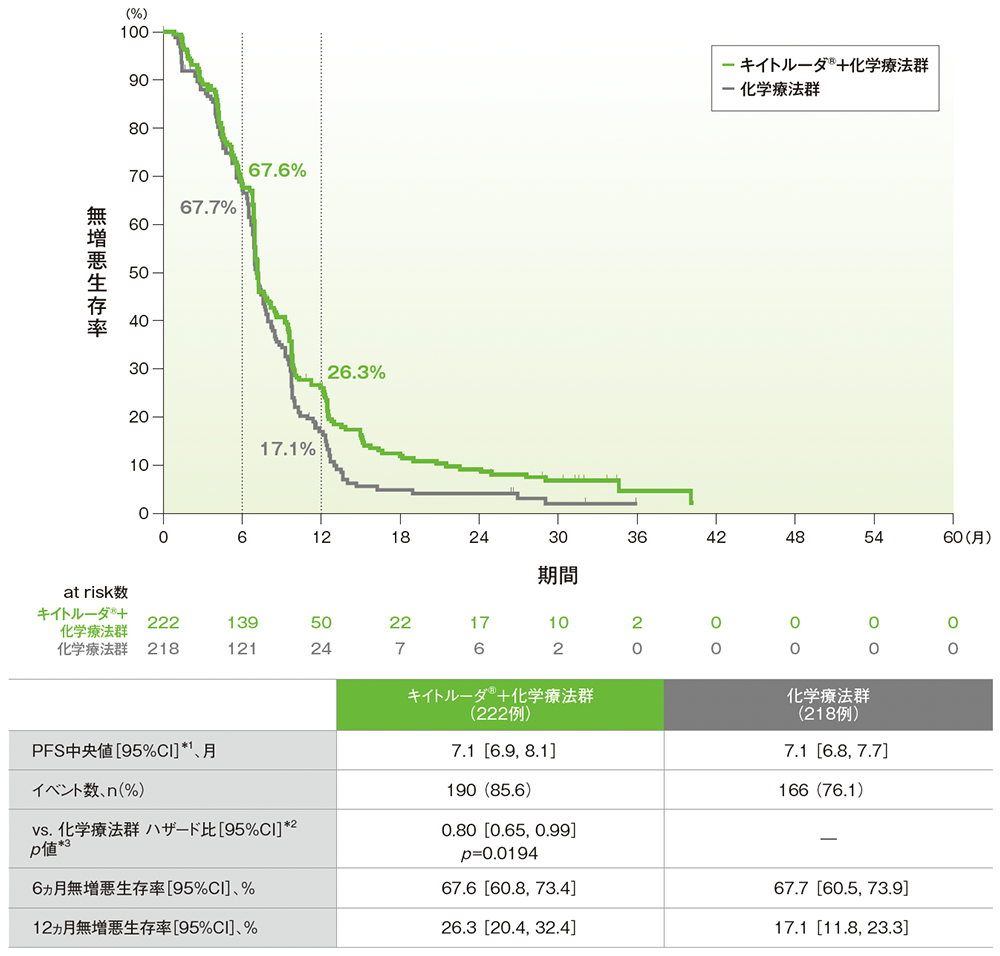
mRECISTに基づくBICRによる評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量、組織型(上皮様、非上皮様)を層別因子とし、タイデータにはEfron法を用いた層別Cox比例ハザードモデルに基づく
*3 組織型(上皮様、非上皮様)を層別因子とした層別ログランク検定[片側]、有意水準α=0.0227
データカットオフ日:2022年9月16日
サブグループ解析 部分集団因子別の無増悪生存期間(PFS)(第Ⅲ相パート ITT集団)

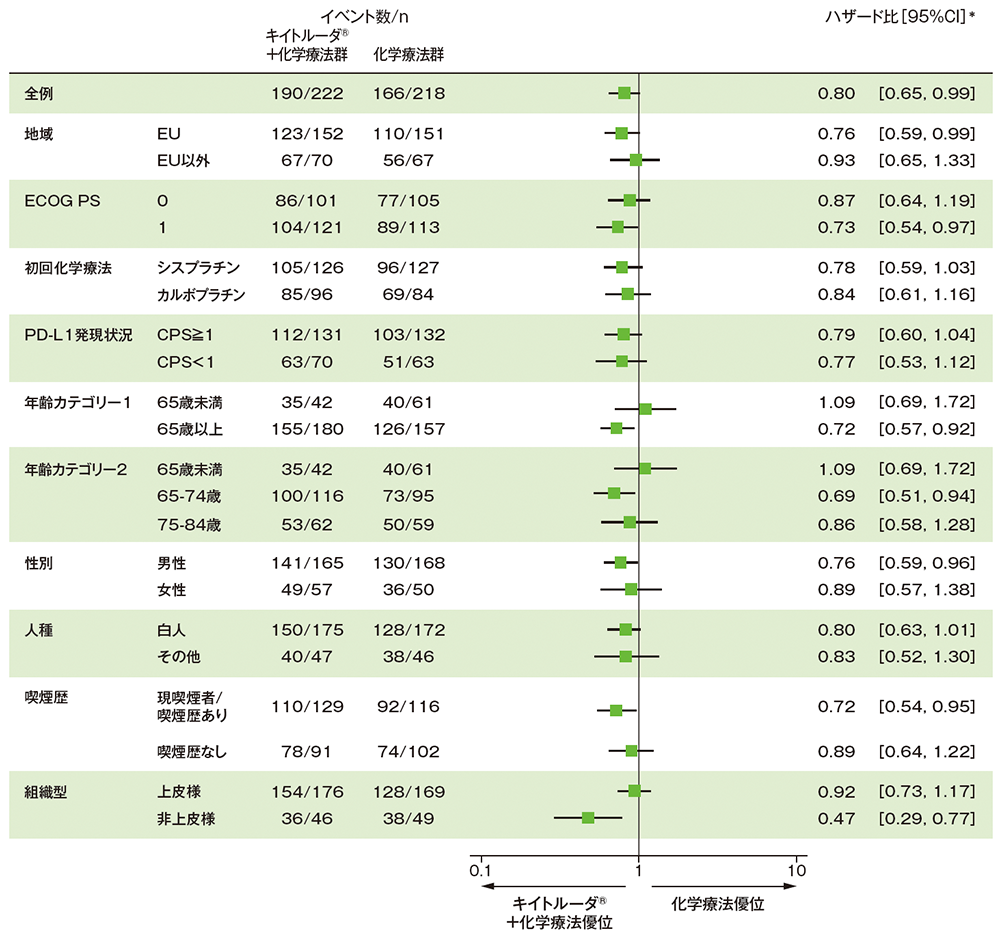
mRECISTに基づくBICRによる評価
* 全集団は投与群を共変量とし、組織型(上皮様、非上皮様)を層別因子とした層別Cox比例ハザードモデル、部分集団は投与群を共変量とした非層別Cox比例ハザードモデルに基づく
データカットオフ日:2022年9月16日
サブグループ解析 組織型別の無増悪生存期間(PFS)(第Ⅲ相パート ITT集団)

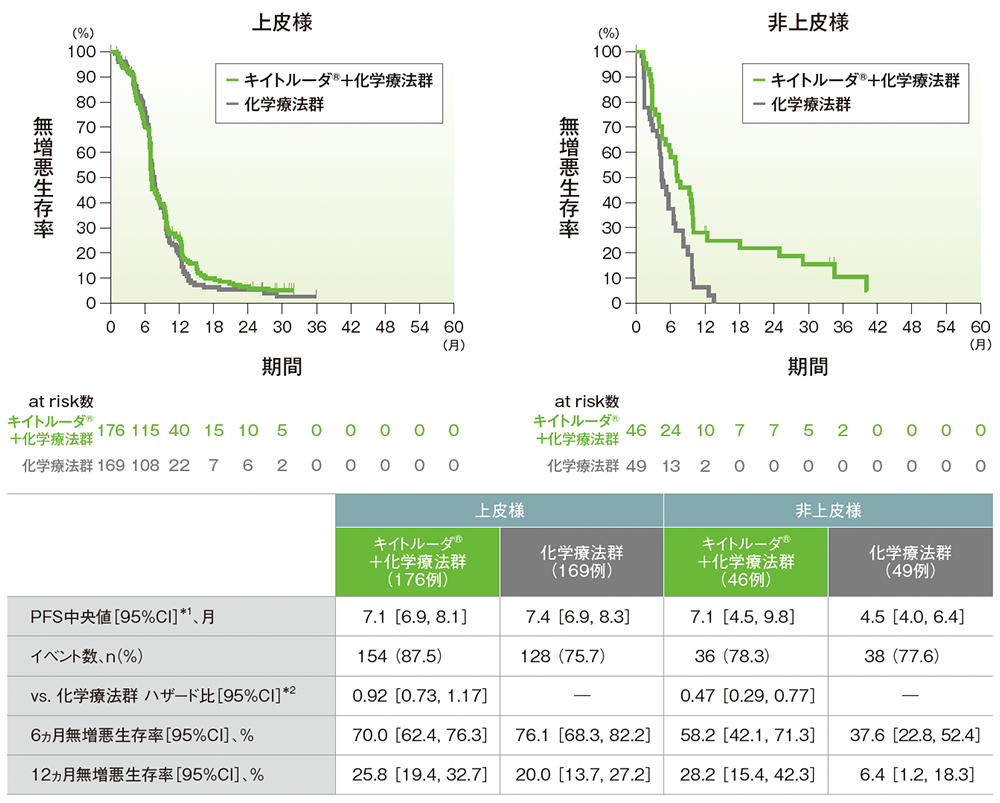
mRECISTに基づくBICRによる評価
*1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
*2 投与群を共変量とし、タイデータにはEfron法を用いた非層別Cox比例ハザードモデルに基づく
データカットオフ日:2022年9月16日
副次評価項目 奏効率(ORR)
奏効率(ORR)(第Ⅲ相パート ITT集団)(検証的解析結果*)
*p< 0.00001

- 中間解析時点で、ORRはキイトルーダ®+化学療法群で52.3%(95%CI:45.5, 59.0)、化学療法群で28.9%(95%CI:23.0, 35.4)であり、キイトルーダ®+化学療法群は化学療法群に対してORRを有意に改善しました(群間差:23.5%、95%CI:14.6, 32.0、p<0.00001、層別Miettinen and Nurminen法[片側]、有意水準α=0.0075; 検証的解析結果)。
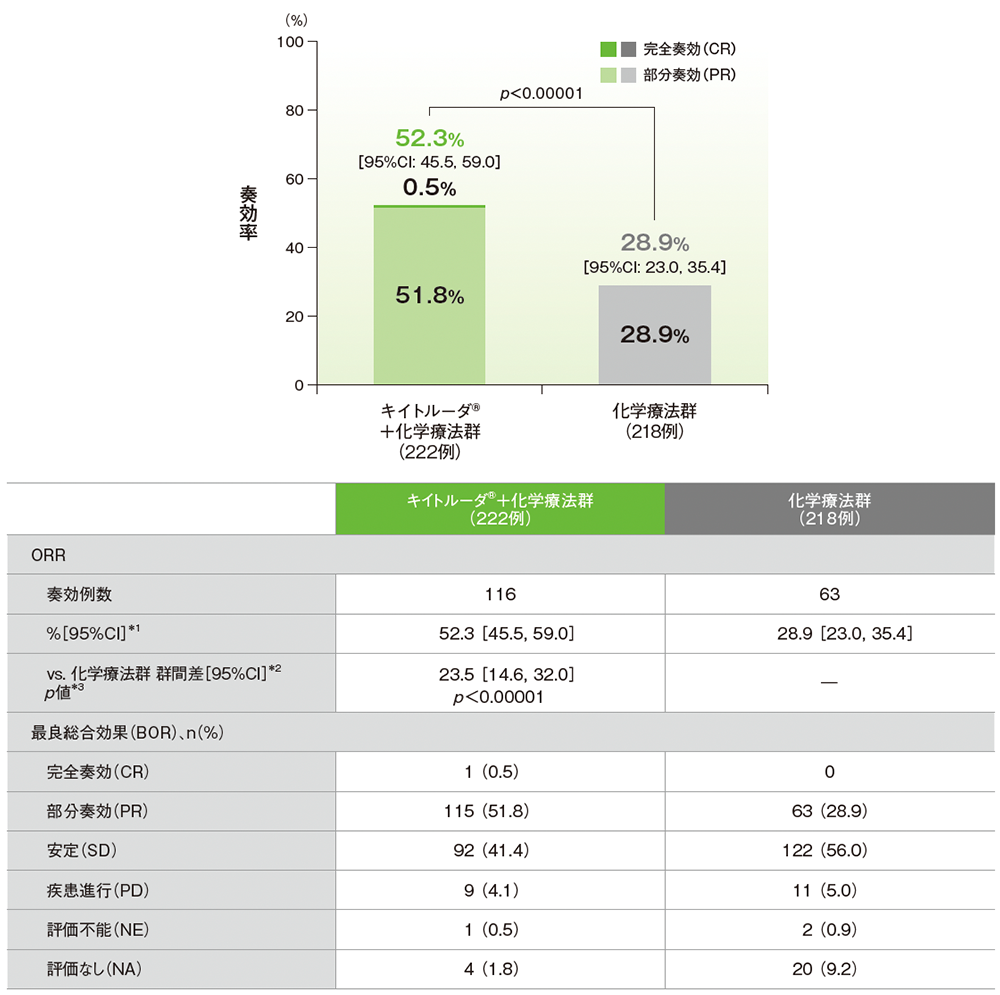
mRECISTに基づくBICRによる評価
*1 二項分布による正確法に基づく
*2 組織型(上皮様、非上皮様)を層別因子とした層別Miettinen and Nurminen法に基づく
*3 組織型(上皮様、非上皮様)を層別因子とした層別Miettinen and Nurminen法[片側]、有意水準α=0.0075
データカットオフ日:2021年7月30日
- 最終解析時点でのORRは、キイトルーダ®+化学療法群で52.7%(95%CI:45.9, 59.4)、化学療法群で29.4%(95%CI: 23.4, 35.9)でした。
データカットオフ日:2022年9月16日
サブグループ解析 部分集団因子別の奏効率(ORR)(第Ⅲ相パート ITT集団)

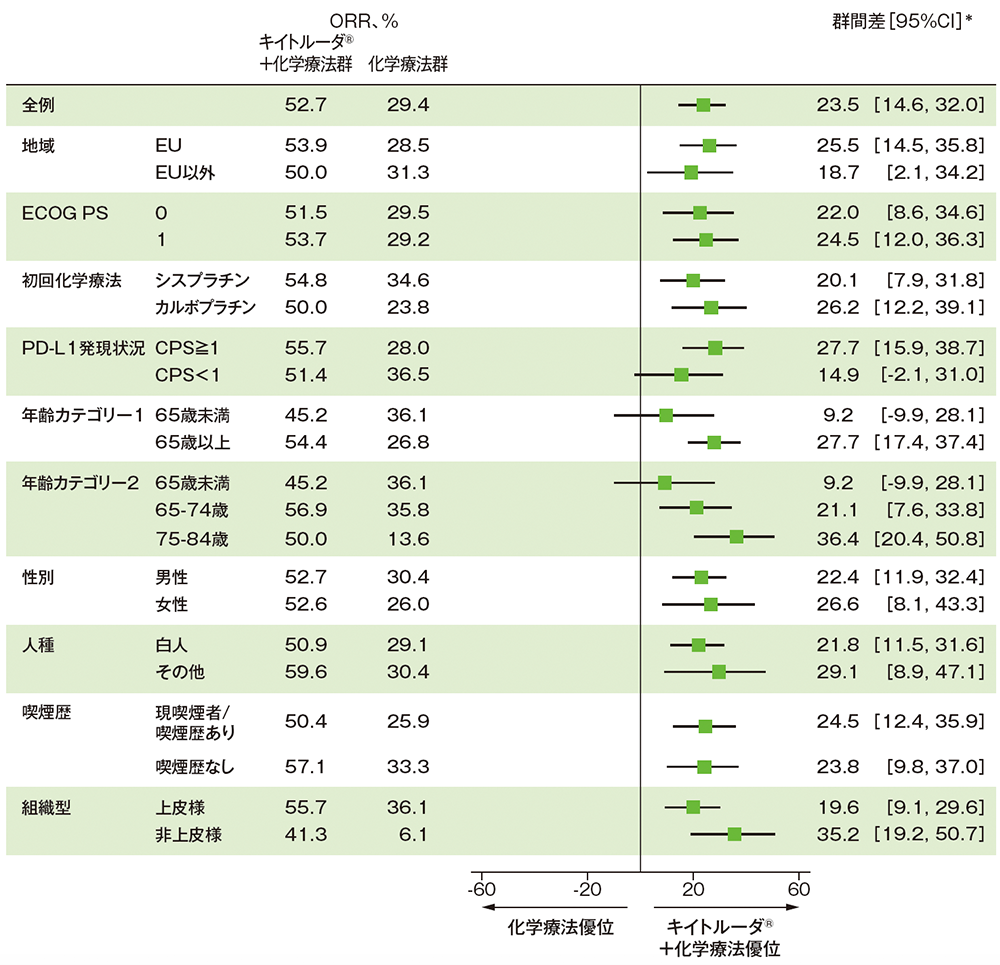
mRECISTに基づくBICRによる評価
* 全集団は組織型(上皮様、非上皮様)を層別因子とした層別Miettinen and Nurminen法、部分集団は非層別Miettinen and Nurminen法に基づく
データカットオフ日:2022年9月16日
安全性
副作用の詳細(APaT集団*)

■副作用

■重篤な副作用

■投与中止に至った副作用

■死亡に至った副作用

MedDRA v26.0
* 第Ⅱ相パート及び第Ⅲ相パートで治験薬を1回以上投与されたすべての患者
データカットオフ日:2022年9月16日
■主な副作用(いずれかの投与群で発現率5%以上、APaT集団*)
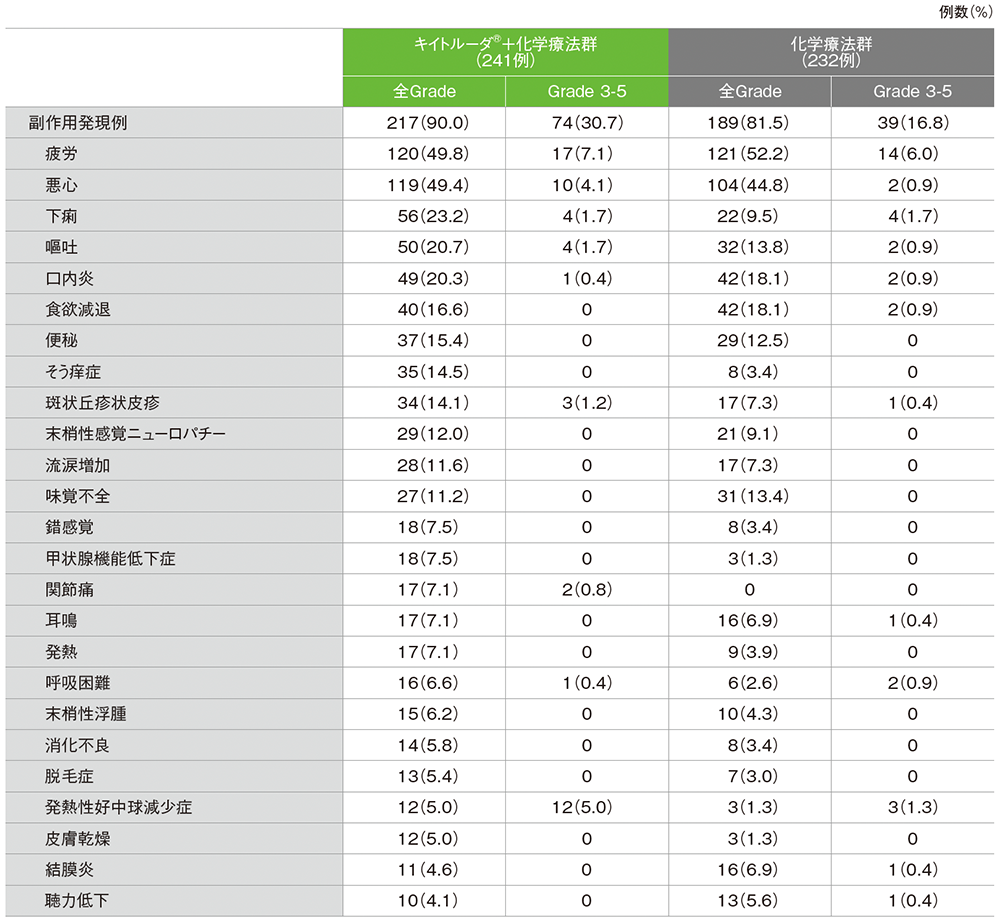
MedDRA v26.0、GradeはCTCAE v4.03
* 第Ⅱ相パート及び第Ⅲ相パートで治験薬を1回以上投与されたすべての患者
データカットオフ日:2022年9月16日
免疫関連など特に注目すべき有害事象の詳細(APaT集団*)

■ 免疫関連など特に注目すべき有害事象一覧
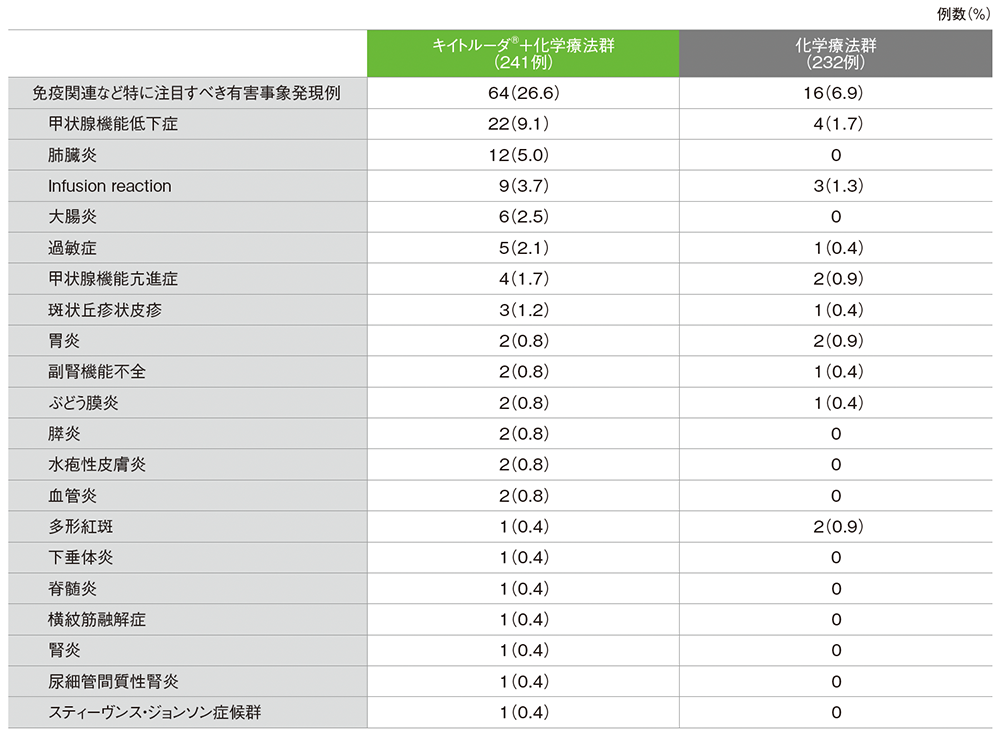
MedDRA v26.0
* 第Ⅱ相パート及び第Ⅲ相パートで治験薬を1回以上投与されたすべての患者
データカットオフ日:2022年9月16日
関連コンテンツ


キイトルーダ®患者さんやご家族、一般の方向け疾患説明用資料:〈胸膜中皮腫編〉

【悪性胸膜中皮腫】悪性胸膜中皮腫における化学療法併用治療としてのキイトルーダ®の臨床成績 KEYNOTE-483 KEYNOTE-A17
キイトルーダ®は2025年5月、「切除不能な進行・再発の悪性胸膜中皮腫」の1次治療に対して承認を取得いたしました。本動画では、悪性胸膜中皮腫の治療としてキイトル […]
キイトルーダ®・悪性腫瘍関連領域情報

キイトルーダ®治療日誌:<頭頸部癌>キイトルーダ®術前補助療法
