ICI併用療法における消化器障害:ペムブロリズマブ+同時化学放射線療法※におけるマネジメントと今後の展望
Talk Session irAE Series
婦人科腫瘍薬物療法における消化器障害マネジメントを考える
本コンテンツは、婦人科腫瘍での免疫チェックポイント阻害薬(Immune Checkpoint Inhibitor:ICI)使用に関して、ペムブロリズマブを含めた併用療法における免疫関連有害事象(immune-related Adverse Events:irAE)、特に消化器障害に注目したマネジメントについてエキスパートの先生にご討議いただくシリーズです。今回は2024年11月に、ペムブロリズマブがシスプラチンを用いた同時化学放射線療法との併用において局所進行子宮頸癌に対する治療選択肢の一つになったことを踏まえ、主にirAE腸炎と放射線性腸炎にフォーカスし、その鑑別や対処、今後の課題などについてご議論いただきました。
Series Part 2
ICI併用療法における消化器障害:ペムブロリズマブ+同時化学放射線療法※におけるマネジメントと今後の展望
※ペムブロリズマブ+シスプラチンを用いた同時化学放射線療法の効能及び効果は「局所進行子宮頸癌」です。

【ご出席者】
右)山上 亘 先生 慶應義塾大学 医学部 産婦人科学教室 教授
左)浜本 康夫 先生 東京科学大学大学院(旧東京医科歯科大学大学院)
臨床腫瘍学分野 主任教授
【開催日】2024年12月12日(木)
【開催場所】コモレ四谷タワーコンファレンス
主催 MSD株式会社 オンコロジーメディカルアフェアーズ
▶ Index
- ICIと放射線療法の併用療法 ―KEYNOTE-A18試験の概要
- KEYNOTE-A18レジメンにおける下痢の対処 ―Grade評価と放射線療法に対する考え方
- KEYNOTE-A18レジメン投与時の晩期障害
- 実臨床での課題と診療科連携の重要性
「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
ICIと放射線療法の併用療法 ―KEYNOTE-A18試験の概要
――同時化学放射線療法(CCRT:Concurrent Chemoradiotherapy)を単独で行う際、婦人科と消化器内科はどのように連携されていたでしょうか。また、ICIとCCRTの併用療法が選択肢に加わったことにより、何か変化はあるでしょうか。
山上 子宮頸癌では、1B期以降は放射線療法が選択肢となり1)、特に局所進行子宮頸癌ではより強力な治療効果を目指してCCRTが検討されることがあります。これまでCCRTを単独で実施していた時は、急性期の有害事象として下痢が認められても消化器内科にコンサルテーションを行うような重症例は少なく、むしろ治療終了後の晩期の有害事象として消化器障害が出現し、内視鏡検査を依頼するようなケースが多かったと思います。今回、ペムブロリズマブとCCRTの併用療法が登場したことで、治療の早い段階で出現した消化器障害についても消化器内科に相談することが増えるかもしれません。
これらを考えるにあたり、まず承認の根拠となった臨床試験であるKEYNOTE-A18試験の概要を振り返ってみたいと思います。KEYNOTE-A18試験は未治療のFIGO2014進行期分類のⅠB2~ⅡB期(リンパ節転移陽性)又はⅢ~ⅣA期(リンパ節転移陽性又は陰性)の局所進行子宮頸癌子宮頸癌患者を対象に、ペムブロリズマブとCCRT(シスプラチン同時併用下での外部照射、及びその後の小線源治療)の併用(ペムブロリズマブ併用群)と、プラセボとCCRTの併用(プラセボ併用群)との有効性及び安全性を比較検討した試験です2‐4)。
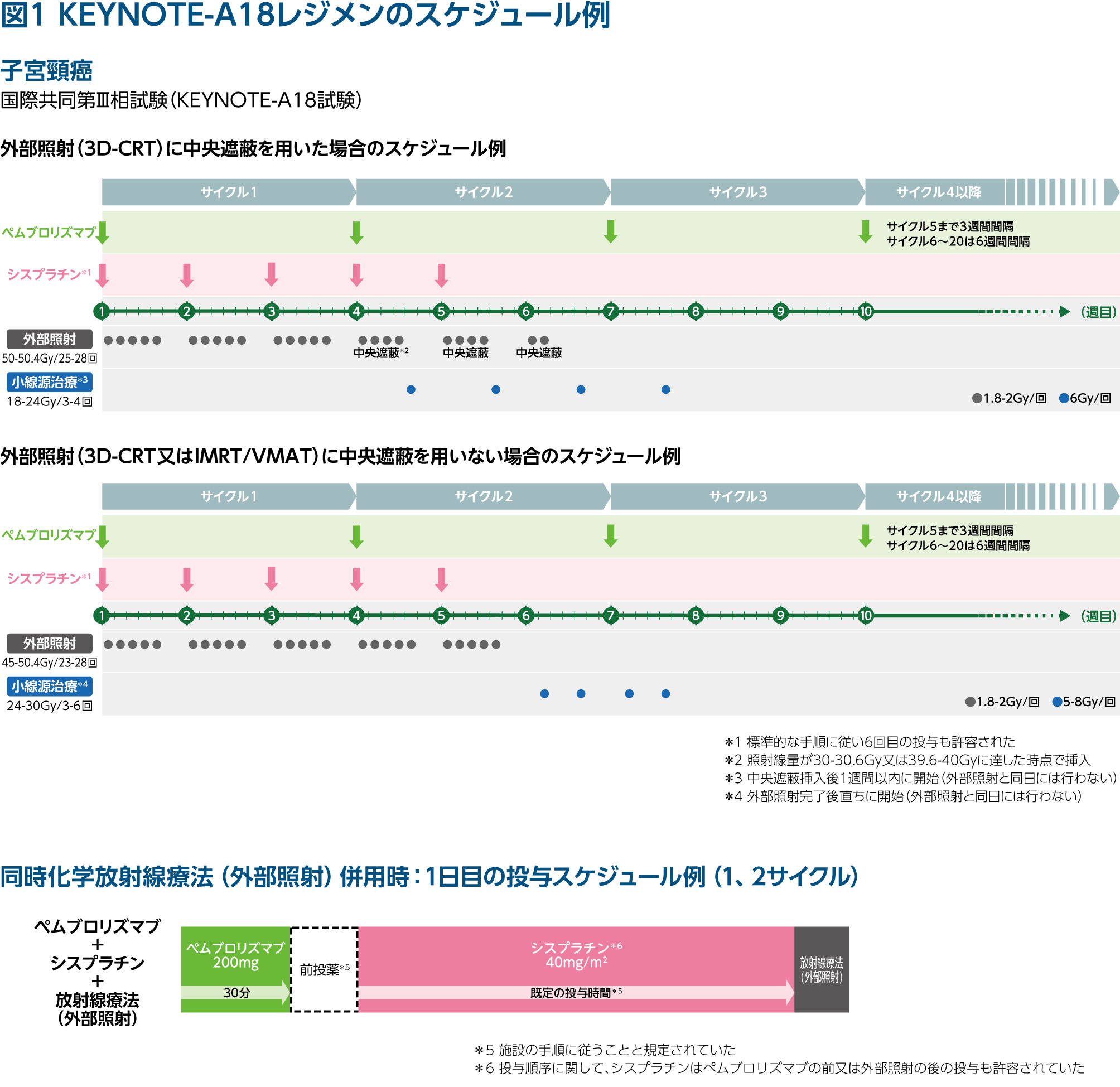
図1にKEYNOTE-A18試験のスケジュール例を示しました。CCRTはシスプラチンが1週間間隔で5又は6回投与、放射線治療は外部照射と小線源治療を合わせた全体の治療期間が50日(予期しない遅延のために最大56日間まで延長可能)を超えないこととされていました。ペムブロリズマブは5サイクルまでは3週間間隔、その後は6週間間隔で15サイクル投与されました。
子宮体癌では、ペムブロリズマブと他の薬剤の併用療法の一つとしてペムブロリズマブ+レンバチニブ併用療法注) (KEYNOTE-775/309レジメン)がありますが、チロシンキナーゼ阻害剤(TKI)による下痢とirAE腸炎は、発現時期とTKI休薬後の回復状態が鑑別のポイントでした(詳細はコンテンツ「Series Part1」を参照)。KEYNOTE-A18レジメンの場合、主に放射線性腸炎とirAE腸炎の鑑別が焦点になるかと思いますがいかがでしょうか。
注)進行・再発の子宮体癌において、ペムブロリズマブとレンバチニブとの併用について、一次治療における有効性及び安全性は確立していない。
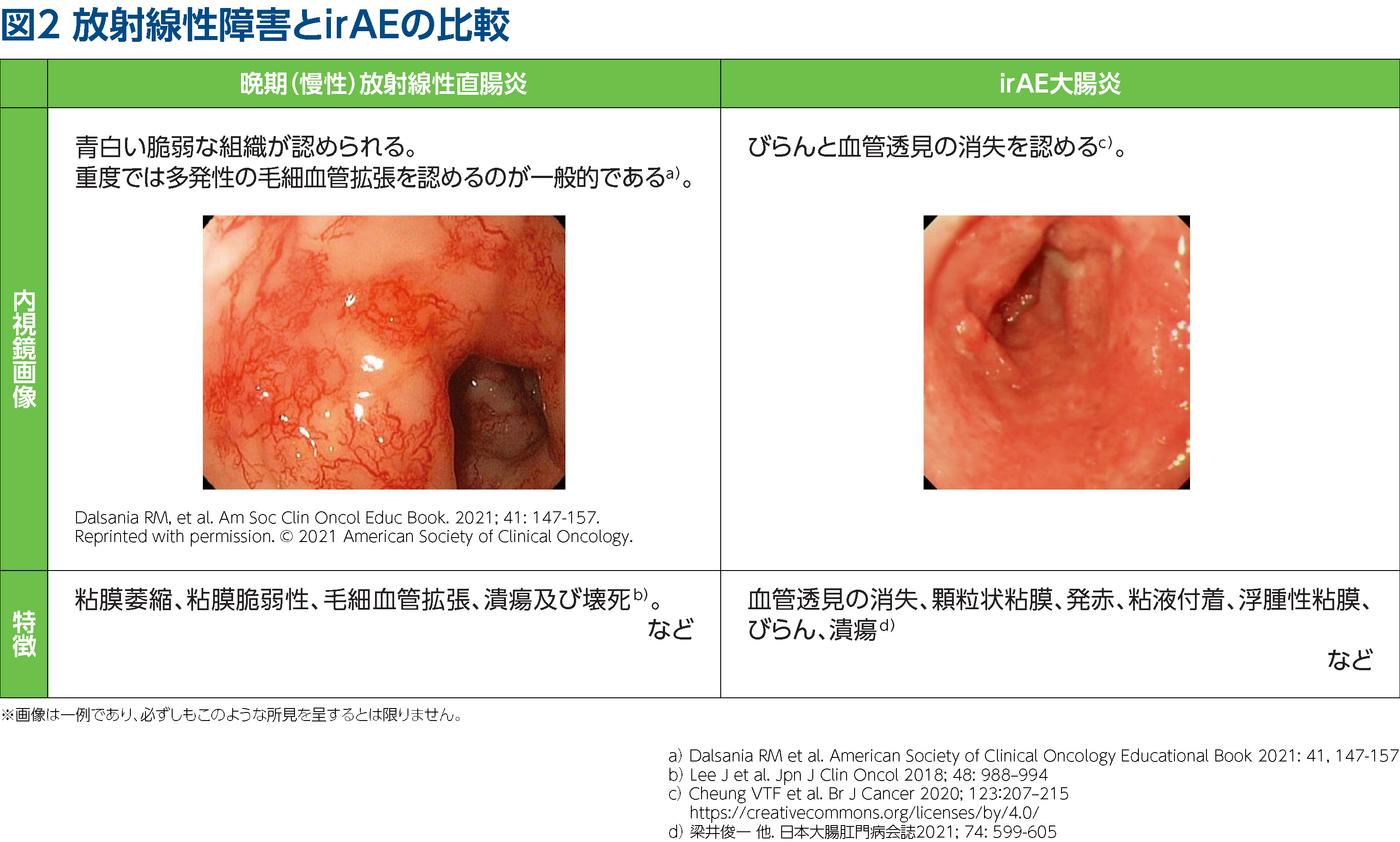
浜本 KEYNOTE-A18レジメンにおける放射線療法の治療期間は7~8週間で、その後半に小線源治療を行い、またぺムブロリズマブは最大2年間投与を継続するため、早期でも晩期でも放射線性腸炎とirAE腸炎の発現時期と重複する可能性があります。放射線性腸炎とirAE腸炎との鑑別が困難な場合、大腸内視鏡検査を実施しています。一例として、放射線性腸炎とirAE腸炎の内視鏡画像を図2に示しましたが、それぞれ、特徴的な所見が認められました。子宮頸癌における放射線療法ではリスク臓器として直腸、S状結腸、小腸などが挙げられます5)。子宮頸癌を含む骨盤内の悪性腫瘍に対する放射線療法においては、蠕動しており腹壁に固定されていない小腸よりも、固定された臓器である直腸は同一箇所に一定の線量が照射されるため、粘膜障害を来しやすいという特徴があります6)。また、癌で癒着して小腸が巻き込まれていると、同一箇所に放射線が照射されて消化管穿孔を来す可能性もあるため、癌の状態を見極めつつ慎重な照射を行う必要があると考えます。
山上 大腸内視鏡検査により、照射野と一致した箇所に粘膜障害が強く出ている場合は、放射線性腸炎である可能性が高いかもしれませんね。
浜本 そのように考えます。確定診断を行うには可能な限り腸管全体を診ることが重要ですが、放射線療法の期間中に内視鏡検査を実施するのは患者さんにとって大きな負担だと思われます。腸管の炎症性マーカーである便中カルプロテクチン7)は、放射線性腸炎とirAE腸炎の鑑別に有効な可能性があり、大腸内視鏡検査施行の可否に関するマーカーとして使用できると考えます。
キイトルーダ®適正使用ガイド
KEYNOTE-A18レジメンにおける下痢の対処 ―Grade評価と放射線療法に対する考え方
――KEYNOTE-A18レジメンにおいて、CCRTの併用期間中に下痢が発現した場合、どのような対処が考えられるでしょうか。
浜本 局所進行子宮頸癌に対するCCRTは根治的治療として位置づけられており1)、有害事象をコントロールしながら可能な限り治療を継続しています。放射線性腸炎のように局所的な粘膜障害によって起こる下痢には、排便回数は多くても排便量が少ない、いわゆる“しぶり腹”が認められます8)。排便回数と排便量が多く、脱水を来すような状態を除いて、基本的に放射線療法の中断には至らないと考えます。
山上 KEYNOTE-775/309レジメンのようにペムブロリズマブ+TKIの併用療法の場合はどちらの治療も主体と考えられますが、KEYNOTE-A18レジメンではCCRTの放射線療法が主体で、化学療法とともにペムブロリズマブは補助的な存在だと捉えています。
CTCAE※による下痢のGrade評価では、ベースラインと比較して4~6回/日の排便回数増加でGrade 2、7回以上/日の排便回数増加でGrade 3になるため9)、その評価だけで安易に判断してしまうことが危惧されます。
浜本 そうですね。CTCAEでは、観察された有害事象が複数のGradeの定義に該当する場合には、総合的に判断して最も近いGradeに分類する「Nearest match」の原則を採用しており7)、該当する排便回数増加のみでGrade付けすることは推奨されません。排便量なども含めて総合的に判断することが重要だと思います。
※Common Terminology Criteria for Adverse Events:有害事象共通用語規準
山上 不必要な治療中断につなげないために「恐れすぎず、正しく恐れる」の心構えが重要ですね。なお、KEYNOTE-A18試験では、2回の中間解析及び最終解析の実施が計画されており、現在、第2回中間解析(追跡期間中央値はペムブロリズマブ併用群が27.8ヵ月、プラセボ併用群が26.9ヵ月)が公表されています。第2回中間解析における下痢の発現率は、ペムブロリズマブ併用群で50.8%、プラセボ併用群で51.1%でした(表1)。
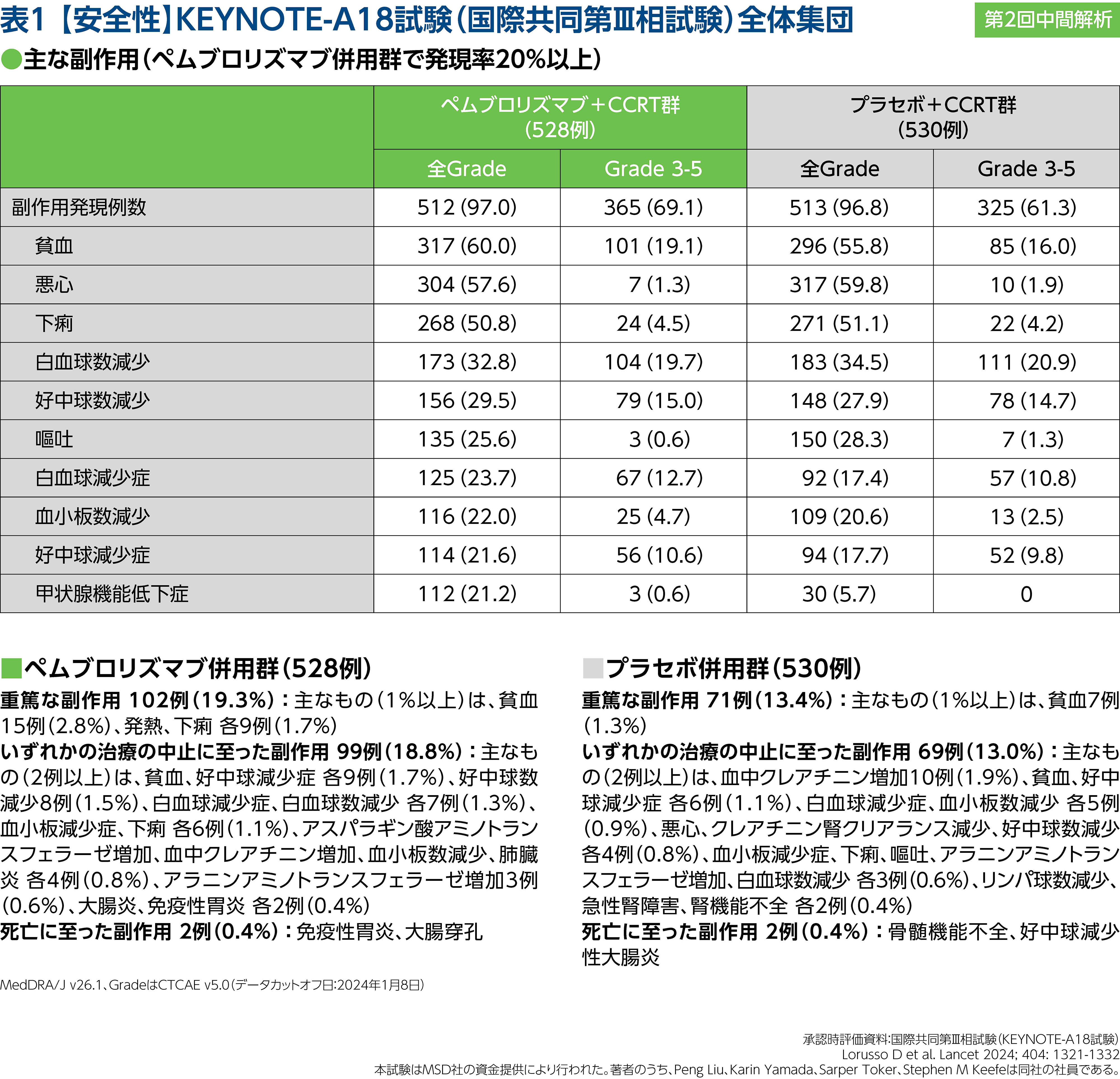
浜本 Grade 3以上の発現率はペムブロリズマブ併用群で4.5%、プラセボ併用群で4.2%という結果でしたね。これらの結果を参照しつつ、実臨床では排便状態などを総合的に判断したうえで治療継続の有無を考えていくことになるでしょう。
KEYNOTE-A18レジメンは、初回のペムブロリズマブ投与とCCRT治療は入院で実施し、以降は外来で行うというケースが多いと思われます。放射線療法の期間にはロペラミドなどの止瀉薬が必要なケースが出てくると思いますが、入院期間中は毎日診察するため症状増悪の有無を確認できて漫然とした投与は避けられるでしょう。
また、急性障害の放射線性腸炎は、照射中から発症し照射終了後2~3週間で改善されることが多いと考えられるため10)、以降は主にirAE腸炎とその他の炎症性腸疾患(詳細はコンテンツ「Series Part1」を参照)、そして晩期障害としての放射線性腸炎との鑑別が中心になります。
山上 KEYNOTE-A18試験では、CCRT終了後、ぺムブロリズマブの単独投与が行われています(図1)。この期間にGrade2から3のirAE腸炎が出現した場合、ペムブロリズマブの適正使用ガイドでは休薬するとしたうえで、「副腎皮質ホルモン剤による治療開始後12週以内に、Grade 1以下に回復してプレドニゾロン換算10mg/日以下まで減量できた場合には、本剤の投与再開を検討する」とされています。また、婦人科癌に特定されたデータはないものの、irAEの発現はICIの効果と関連性が報告されているため11)再投与を検討したいところですが、再びirAE腸炎が発現する可能性は否定できず慎重にならざるを得ません。
浜本 ご紹介いただいた報告11)は、慶應義塾大学病院にて私も参加したもので、ICI投与患者を対象にirAE発現の有無別に予後をレトロスペクティブに検討したものです。本検討では、複数のirAEの発生が良好な予後と関連する傾向がありました。ただ、症例が集積されておらず、irAE種類別にはまだ検討できない状況です。
KEYNOTE-A18レジメン投与時の晩期障害
――晩期障害による放射性腸炎に関しては、どのような注意が必要でしょうか。
山上 放射線療法による晩期障害は急性反応が軽快し、数か月~数年を経てから発症するため5)、ペムブロリズマブ単剤投与時、そしてペムブロリズマブ投与終了後にも発現する可能性があります。たとえ治療によって癌が根治しても、晩期障害の腸炎による下血5)によって輸血の必要が出るなど、QOLが低下してしまうこともあります。治療開始前には患者さんに対して、irAEと同様に晩期障害の可能性についても説明しておくことが重要だと思います。
浜本 晩期障害の放射線性腸炎は、粘膜に毛細血管の拡張がみられ10)、出血しやすい状態になっています。また、血流障害による潰瘍の形成や直腸狭窄など多様な症状を認めるため10)、マネジメントに難渋することがあります。加えて、晩期障害の放射線性腸炎を癌の再発による症状と誤認する可能性や、irAE腸炎を癌の末期症状と誤認する可能性も考えられます。原疾患の進行や再発で現れる症状などの可能性も考慮しながら、臨床像や経過を総合的に診て慎重に判断することが求められます。
山上 KEYNOTE-A18試験の第2回中間解析におけるフォローアップ期間中央値は約30ヵ月ですから、晩期障害に関しては今後の報告が待たれます。また、進行又は再発の子宮頸癌患者を対象にしたKEYNOTE-826試験では、前治療として放射線療法歴がある群が含まれていますので、こちらの長期的なフォローアップ結果も参照したいところです。
実臨床での課題と診療科連携の重要性
――KEYNOTE-A18レジメンでは、婦人科に加えて放射線科の先生が治療に携わります。消化器内科を含め、どのような連携体制が必要でしょうか。
山上 KEYNOTE-A18レジメンでは基本的に婦人科が薬物療法、放射線科が放射線療法を担当しますが、薬物療法が週に1回である一方で放射線療法は基本的に毎日行うため、症状が発現した患者さんはまず放射線科に相談する可能性が高いと考えられます。そのため、放射線科の先生方にもKEYNOTE-A18レジメンを把握いただくことが重要だと考えます。これまでの経験から放射線科の先生は下痢の対処には慣れていると思いますが、KEYNOTE-A18レジメンではirAE腸炎の可能性があるという認識のもとで、婦人科や消化器内科と連携いただけたらと思います。
浜本 ICIとCCRTによる同時併用療法は、このKEYNOTE-A18レジメンが本邦で初めてです。また、婦人科腫瘍では放射線療法で根治を目指すことも多いため、有害事象出現時の治療継続の可否については各診療科で見解が異なることがあるかもしれません。その他、長期的なフォローアップが必要など、これまでにはなかった診療科を超えたチーム医療が必要になると思われます。なお、放射線科の先生には周知されている放射線療法の晩期障害ですが、消化器内科では経験が少ない医師もみられます。ぜひ、病態をよく知る放射線科の先生には積極的にチームに関わっていただけたらと思います。
消化器内科としては、マネジメントで問題となることが生じれば早い時点で相談いただける環境を作りたいと考えています。KEYNOTE-A18レジメンを実施する施設は、多くの患者さんが集まる拠点病院が中心で、局所進行子宮頸癌においては集学的治療が必要です。診療科の垣根を取り払い、患者さんにとってより良い治療が選択できるよう協力できる仕組みづくりが重要だと感じました。
山上 婦人科領域にICIが登場し、この数年で複数の併用療法が行われるようになりました。婦人科としてマネジメント経験は積み重ねているものの、今回、ICIとCCRTの同時併用療法が加わったことで、担当医だけでなくすべてのメディカルスタッフの知識をアップデートして周知すべきだと思いました。その上で、関連する診療科へのコンサルテーションの遅れは重大な事態を招きかねないため、普段から依頼しやすい関係性を構築し、密な連携をとるように心掛けたいです。本日はありがとうございました。
コンテンツ 「Series Part 1」 は こちら
参考文献
1)日本婦人科腫瘍学会 編: 子宮頸癌治療ガイドライン2022年版. 金原出版, 2022
2)承認時評価資料: 国際共同第Ⅲ相試験(KEYNOTE-A18試験)
3)Lorusso D et al. Lancet 2024; 403: 1341-1350
本試験はMSD社の資金提供により行われた。著者のうち、Kan Li、Karin Yamada、Sarper Toker、Stephen M Keefeは同社の社員である。
4)Lorusso D et al. Lancet 2024; 404: 1321-1332
Peng Liu、Karin Yamada、Sarper Toker、Stephen M Keefeは同社の社員である。
5)日本放射線腫瘍学会 編: 放射線治療計画ガイドライン2024年版. 金原出版, 2024
6)Kennedy GD et al. Clin Colon Rectal Surg 2007; 20 :64-72
7)NCCN Guidelines. Management of Immunotherapy-Related Toxicities. Version 2. 2024
8)Nelamangala Ramakrishnaiah VP et al. World J Gastrointest Surg 2016; 8: 483-491
9)National Cancer Institute Cancer Therapy Evaluation Program(CTEP):Common Terminology Criteria for Adverse Events (CTCAE). https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm (2025年4月参照)
10)千野晶子,他. 日本消化器内視鏡学会雑誌 2010; 52: 1381-1392
11)Shinozaki K et al. Cancer Manag Res 2020; 12: 4585-4593
著者にMSD社より謝金等を受領している者が含まれる。
目的:実臨床におけるirAEと治療効果の関連性についてレトロスペクティブに検討した。
対象・方法:2014年9月から2019年1月までに抗PD-1/PD-L1抗体(ニボルマブ、ペムブロリズマブ、アテゾリズマブ)を投与された再発又は転移性の非小細胞肺癌、悪性黒色腫、腎細胞癌、胃癌の患者を対象に、診療記録による有害事象(CTCEA ver4.0)の発現数と全生存期間との関係について、Cox比例ハザードモデルと共有フレイルティモデルを用いて調査した。
Limitation:本研究ではirAEの診断基準を定義しなかったため、一部のirAEが除外された可能性がある。また、診療記録に具体的な記載がなかったirAEが見落とされている可能性がある。本検討では4つのがん種を対象としており、ICIの投与レジメンが異なっていた。PD-L1発現状況など、有効性と関連するバイオマーカーの評価ができなかった。
ペムブロリズマブ(遺伝子組換え)の電子添文を確認する。
コンテンツ 「Series Part 1」 は こちら
国際共同第Ⅲ相試験(KEYNOTE-A18試験)1-3):試験概要
1)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-A18試験)
2)Lorusso D et al. Lancet 2024; 403: 1341-1350
本試験はMSD社の資金提供により行われた。著者のうち、Kan Li、Karin Yamada、Sarper Toker、Stephen M Keefeは同社の社員である。
3)Lorusso D et al. Lancet 2024; 404: 1321-1332
Peng Liu、Karin Yamada、Sarper Toker、Stephen M Keefeは同社の社員である。
【目的】
未治療*1の局所進行子宮頸癌患者におけるキイトルーダ®と同時化学放射線療法(CCRT:シスプラチン同時併用下での外部照射、及びその後の小線源治療)との併用群(以下、キイトルーダ®+CCRT群)と、プラセボとCCRTとの併用群(以下、プラセボ+CCRT群)の有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化二重盲検第Ⅲ相試験[優越性試験](第1回中間解析データカットオフ日:2023年1月9日)(第2回中間解析データカットオフ日:2024年1月8日)
【対象】
未治療*1のFIGO 2014進行期分類のⅠB2~ⅡB期*2(リンパ節転移陽性)又はⅢ~ⅣA期*3(リンパ節転移陽性又は陰性)の局所進行子宮頸癌患者1,060例(日本人90例を含む)
【方法】
キイトルーダ®+CCRT群[キイトルーダ®200mgをQ3Wで5サイクル、シスプラチン40mg/m2をQWで5回又は6回投与、及び放射線治療(外部照射とその後の小線源治療)*4後、キイトルーダ®400mgをQ6Wで15サイクル投与]又はプラセボ+CCRT群[プラセボをQ3Wで5サイクル及びキイトルーダ®+CCRT群と同一の化学放射線療法後、プラセボをQ6Wで15サイクル投与]に1:1の割合で無作為に割り付け、投与完了又は疾患進行等による投与中止まで継続した。最初の画像評価は、CCRTの完了から12週間後に実施した。2年目までは12週間間隔、3年目は24週間間隔、それ以降は1年間隔で実施した。
【評価項目】
主要評価項目: 無増悪生存期間(progression free survival:PFS)a※及び全生存期間(overall survival:OS)※
副次評価項目: 2年PFS率a、3年OS率、CCRT実施後12週時点の完全奏効(CR)率b、奏効率(overall response rate:ORR)b、安全性など
探索的評価項目: 奏効期間(duration of response:DOR)bなど
※ 検証的解析項目
【解析計画】
解析対象集団:主な有効性の解析はITT*5集団、ORR、CR率、DORの解析は、無作為化され、治験組入れ時に測定可能病変を有する患者集団、安全性の解析はAPaT*6集団を対象として実施した。
有効性評価の統計手法:PFS、OS、2年PFS率、3年OS率はKaplan-Meier法を用いて推定した。PFS、OSの群間比較には、層別ログランク検定を用い、投与群を共変量とした層別Cox比例ハザードモデルを用いて、ハザード比(HR)及び95%信頼区間(95%CI)を算出した。ORRの群間比較には層の例数を重みとする層別Miettinen and Nurminen法を用いた。層別ログランク検定、層別Cox比例ハザードモデル及び層別Miettinen and Nurminen法の層別因子には、無作為化層別因子*7を用いた。PFS及びOSについて、投与群を共変量としたCox比例ハザードモデルを用いて、無作為化層別因子に加え、年齢(65歳未満、65歳以上)、人種(白人、白人以外)、ECOG PS(0、1)別のサブグループ解析を実施した。日本人集団は、全体集団と同様の解析手法により解析したが、層での調整については行わなかった。
多重性の調整:本試験では2回の中間解析及び最終解析を実施する計画とした。PFSは2回目の中間解析を最終解析とし、OSは2回の中間解析及び最終解析を実施することとした。PFS及びOSの有意水準は片側2.5%となるように厳密に制御した。これらの多重性の調整には、Maurer & Bretzのグラフィカルアプローチを用い、次のように計画した。まず、有意水準をPFSに片側2.5%配分する。PFSが統計学的に有意であった場合、有意水準をOSに再配分する。
2回の中間解析と最終解析における有意水準の配分には、α消費関数を用いることとした。
主な判定基準:
a: 治験担当医師がRECISTガイドライン1.1版に基づき評価、又は[RECISTガイドライン1.1版に基づく画像上の疾患進行(PD)が確認されていない場合]病理組織学的に確認したPDに基づく
b: 治験担当医師がRECISTガイドライン1.1版に基づき評価
*1 未治療:子宮頸癌に対する根治的手術、放射線治療又は全身療法を受けておらず、かつ免疫療法による治療歴のない患者
*2 ⅠB2~ⅡB期:病巣が4cmを超えるもの、又は臨床的に明らかな病巣が子宮頸部を超えて広がっているが骨盤壁又は腟壁下1/3には達していないもの
*3 Ⅲ~ⅣA期: 腟壁浸潤が腟壁下にあるが骨盤側壁にまでは達していないもの、骨盤側壁にまで達しているもの若しくは水腎症や無機能腎を認めるもの、又は隣接する骨盤内臓器に浸潤があるもの
*4 放射線治療:外部照射と小線源治療を合わせた全体の治療期間は50日(予期しない遅延のために最大56日間まで延長可能)を超えないこととした。
*5 ITT(intention to treat):無作為化されたすべての患者
*6 APaT(All Participants as Treated):無作為化され、治療を1回以上受けたすべての患者
*7 無作為化層別因子:計画された外部照射の種類(IMRT又はVMAT、IMRT又はVMAT以外)、スクリーニング時の病期[FIGO 2014進行期分類でⅠB2~ⅡB期(リンパ節転移陽性)、FIGO 2014進行期分類でⅢ~ⅣA期(リンパ節転移陽性又は陰性)]、計画された外部照射及び小線源治療の総線量[<70 Gy(2Gy換算等価線量(EQD2))、≧70 Gy(EQD2)]
5. 効能又は効果に関連する注意(抜粋)〈局所進行子宮頸癌〉
5.30 臨床試験に組み入れられた患者の病期等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.32参照]
5.31 本剤の術後補助療法における有効性及び安全性は確立していない。
シスプラチンの用法及び用量は以下のとおりです。
6. 用法・用量(抜粋)〈シスプラチン通常療法〉
J法:シスプラチンとして40mg/m2(体表面積)を1日1回投与し、6日間休薬する。これを1クールとして投与を繰り返す。