国際共同第Ⅲ相試験<LITESPARK-005試験>
国際共同第Ⅲ相試験<LITESPARK-005試験>
承認時評価資料:国際共同第Ⅲ相試験(LITESPARK-005試験)
Choueiri TK et al. N Engl J Med 2024; 391: 710-721
本試験はMSD社の資金提供により行われた。著者に同社から顧問料等を受領している者が含まれる。
著者のうち、Li He、Aobo Wang、Rodolfo F. Perini、Donna Vickeryは同社の社員である。
試験概要
【目的】
PD-1/L1阻害剤及びVEGF標的療法による前治療歴を有する根治切除不能又は転移性の淡明細胞型腎細胞癌患者に対するウェリレグ®とエベロリムスの有効性及び安全性を比較検討する。
【デザイン】
国際共同無作為化非盲検第Ⅲ相試験[優越性検証試験]
[第1回中間解析結果(データカットオフ日:2022年11月1日)、第2回中間解析結果(データカットオフ日:2023年6月13日)]
【対象】
PD-1/L1阻害剤及びVEGF標的療法による前治療歴を有する根治切除不能又は転移性の淡明細胞型腎細胞癌患者746例(日本人患者44例を含む)
【方法】
ウェリレグ®群(ウェリレグ® 120mgを1日1回経口投与)又はエベロリムス群(エベロリムス10mgを1日1回経口投与)に1:1で無作為割付けし、BICRによるRECISTガイドライン1.1版に基づく疾患進行又は許容できない有害事象の発現等まで投与を継続した。副作用の管理を目的として、ウェリレグ®を1日1回80mg、その後40mgに減量することは可能とした。エベロリムスについては、エベロリムスの添付文書に従う用量調整を可能とした。画像評価は9週目、その後49週目までは8週間ごと、それ以降は12週間ごとに実施した。
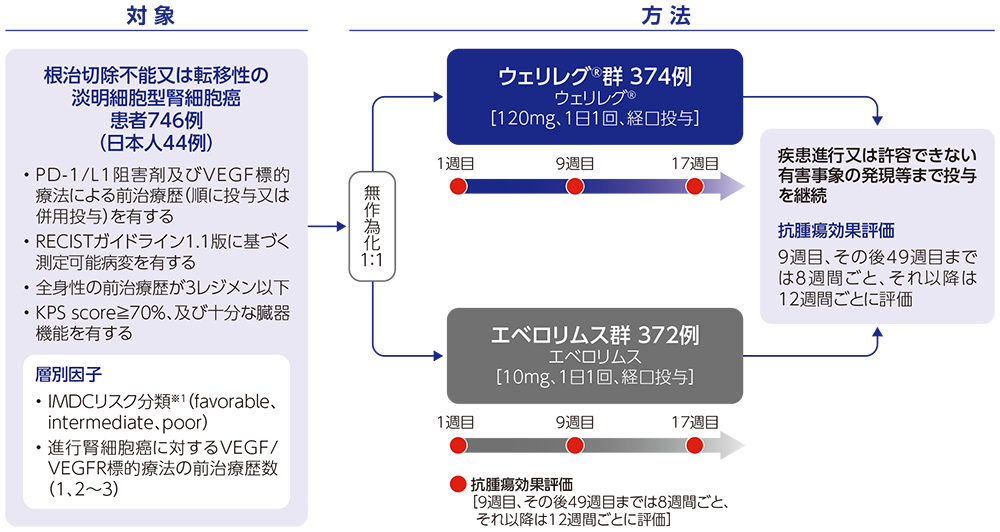
【評価項目】
主要評価項目:無増悪生存期間(progression-free survival:PFS)# 、全生存期間(overall survival:OS)#
副次評価項目:奏効率(objective response rate:ORR)#、奏効期間(duration of response:DOR)、安全性(貧血、低酸素症を含む)
健康関連QOL(HRQoL)に関する患者報告アウトカム(patient reported outcome:PRO):EORTC QLQ-C30(全般的健康状態/HRQoLスコア、身体機能尺度)及びFKSI-DRSスコアのベースラインからの変化量及び悪化までの期間(time to confirmed deterioration:TTD)、EQ-5D-5L VASのベースラインからの変化量
# 検証的解析項目
【判定基準】
PFS、ORR、DORはRECISTガイドライン1.1版に基づきBICRの判定により評価した。
【解析計画】
解析対象集団:有効性の解析はITT集団※2、安全性の解析はAPaT集団※3、PROの解析はPRO FAS集団※4を対象として実施した。
有効性評価の統計手法:有効性の主要評価項目であるPFS、OSのいずれかでウェリレグ®群がエベロリムス群に対して優越性を示した場合に主要目的を達成したとみなした。PFS、OSはKaplan-Meier法を用いて生存曲線を推定した。PFS及びOSの群間比較は層別ログランク検定を用いて評価した。ハザード比(HR)と95%信頼区間(CI)は、投与群を共変量とした層別Cox比例ハザードモデルにより算出した。ORRの群間差及び95%CIは、層の例数を重みとした層別Miettinen and Nurminen法を用いて算出し、ORRの点推定値の95%CIはClopper and Pearson法により算出した。DORはKaplan-Meier法を用いて生存曲線を推定した。無作為化に用いた層別因子[IMDCリスク分類※1(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGF受容体(VEGFR)標的療法の前治療歴数(1、2~3)]を層別ログランク検定、層別Cox比例ハザードモデル及び層別Miettinen and Nurminen法に用いた。
PFSとOS及びORRについて、IMDCリスク分類※1(favorable、intermediate、poor; favorable、intermediate又はpoor)、地域(北米、西欧、その他の地域)、年齢(65歳未満、65歳以上)、性別(男性、女性)、人種(白人、白人以外)、進行腎細胞癌に対するVEGF/VEGFR標的療法による前治療歴数(1、2~3)、前治療歴数(1、2、3)別のサブグループ解析を実施した。PFS及びOSのサブグループ解析にはCox比例ハザードモデルを用い、ORRのサブグループ解析にはMiettinen and Nurminen法を用いた。日本人集団は、全体集団と同様の解析手法により解析したが、層での調整は行わなかった。
HRQoLに関するPRO評価の統計手法:PROスコアを応答変数として、投与群、時点、投与群と時点の交互作用項、及び無作為化に用いた層別因子を共変量として含めた制約つき経時データ解析(cLDA)モデルを適用することとした。本モデルを用いて、ベースラインからの最小二乗平均(LS平均)変化の群間差及び95%CIを推定し、各投与群のLS平均を経時的に示した。TTDはKaplan-Meier法を用いて生存曲線を推定し、投与群を共変量とした層別Cox比例ハザードモデルを用いてHR 及び95%CIを算出した。無作為化に用いた層別因子を層別Cox比例ハザードモデルに用いた。日本人集団は、全体集団と同様の解析手法により解析したが、層での調整は行わなかった。
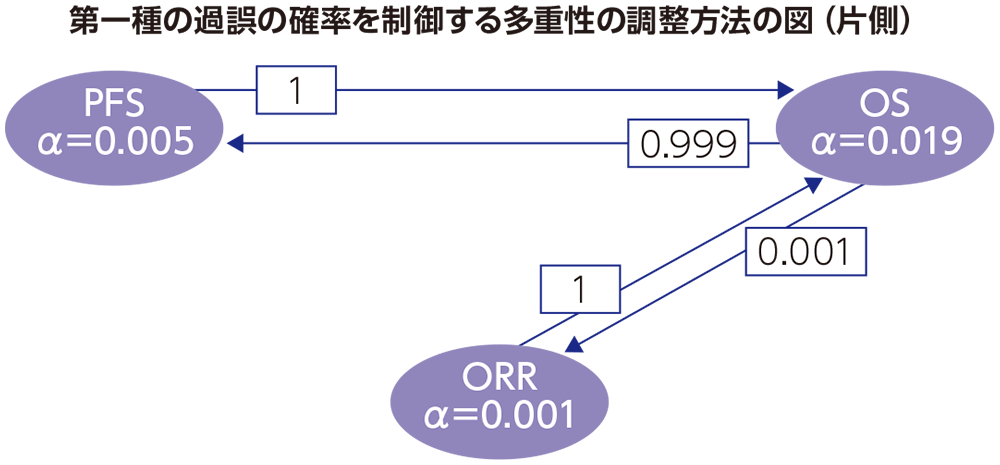
多重性の調整:本試験では2回の有効性の中間解析及び最終解析を実施する計画とした。ORRは1回目の中間解析を最終解析、PFSは2回目の中間解析を最終解析とし、OSは2回の中間解析及び最終解析を実施することとした。OSの最終解析は、死亡が約483件観察され、最後の患者が無作為割付けされてから約27ヵ月が経過した時点で実施することが規定されていた。Maurer and Bretzのグラフィカルアプローチを用いて、PFS、OS及びORRに関連する複数の仮説について、全体の有意水準を片側2.5%に厳密に制御した。最初にPFSに片側0.5% 、OSに片側1.9% 、ORRに片側0.1%の有意水準を配分し、いずれかの仮説が棄却された場合、その有意水準を他の仮説へ再配分することとした。PFSとOSの中間解析と最終解析の有効性の境界値は、Lan-DeMetsによるO’Brien-Fleming型のα消費関数を用いて決定することとした。
※1 IMDC(International Metastatic Renal Cell Carcinoma Database Consortium)リスク分類:6つのリスク因子(Karnofsky PSスコア80%未満、診断から1次治療を開始するまでの期間が1年未満、ヘモグロビン値が正常範囲の下限未満、補正血清カルシウム値が正常範囲の上限超、好中球数が正常範囲の上限超、血小板数が正常範囲の上限超)で構成され、IMDCスコア0をfavorable、1-2をintermediate、3-6をpoorに分類
※2 ITT集団(intention to treat):無作為化されたすべての患者
※3 APaT集団(all participants as treated):治験薬を1回以上投与された患者
※4 PRO FAS集団(PRO full analysis set):治験薬を1回以上投与され、PROの評価が1つ以上得られている患者
EORTC QLQ-C30:European Organisation for the Research and Treatment of Cancer Quality of Life Questionnaire 30
FKSI-DRS:Functional Assessment of Cancer Therapy – Kidney Symptom Index-disease-related symptoms
EQ-5D-5L:European Quality of Life 5-dimension, 5-level Questionnaire
VAS:Visual Analog Scale
患者背景(全体集団)
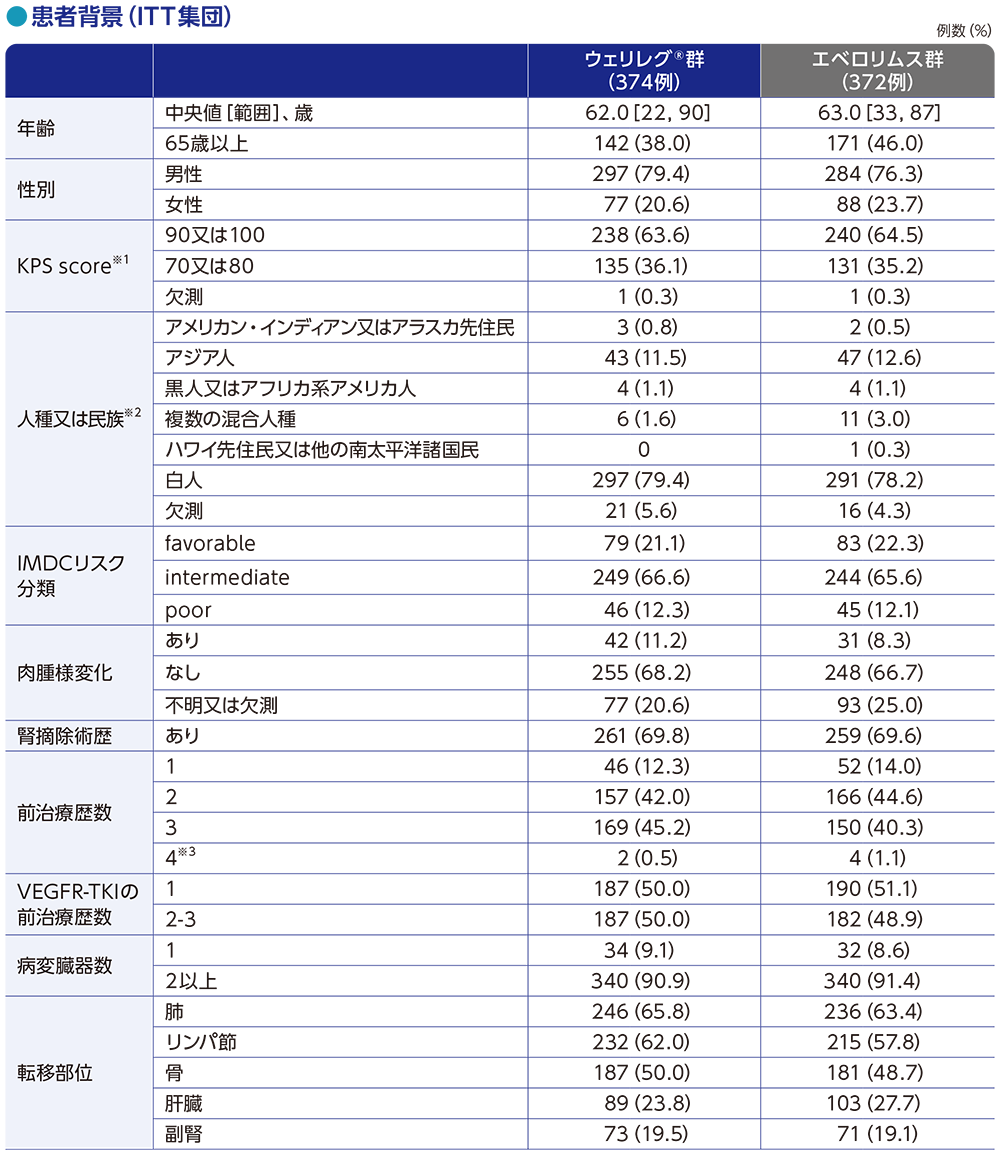
※1 Karnofsky performance-status score(KPS score)は0~100の範囲で、スコアが低いほど全身状態が悪いことを示す
※2 人種又は民族は、患者の報告に基づく
※3 前治療歴数が4レジメンの患者はプロトコール違反例である
患者の内訳
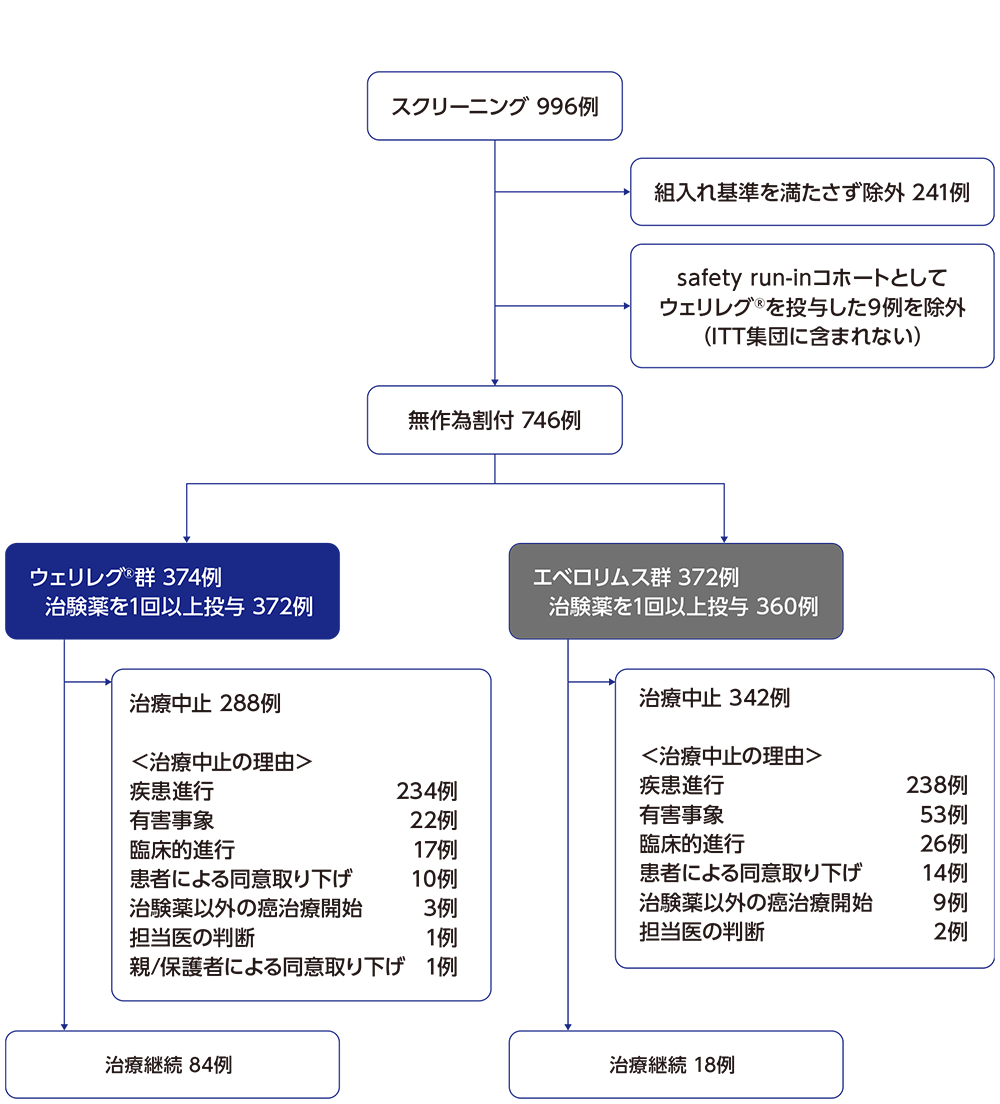
データカットオフ日:2023年6月13日
前治療歴
前治療で最も多かったレジメンは、一次治療が両群ともにスニチニブ単剤投与、二次治療が両群ともにニボルマブ単剤投与、三次治療がウェリレグ®群ではカボザンチニブ単剤投与、エベロリムス群ではニボルマブ単剤投与でした。本試験の規定に従い、すべての患者がPD-1/L1及びVEGF/VEGFRを標的とする前治療を単独又は併用で受けていました。
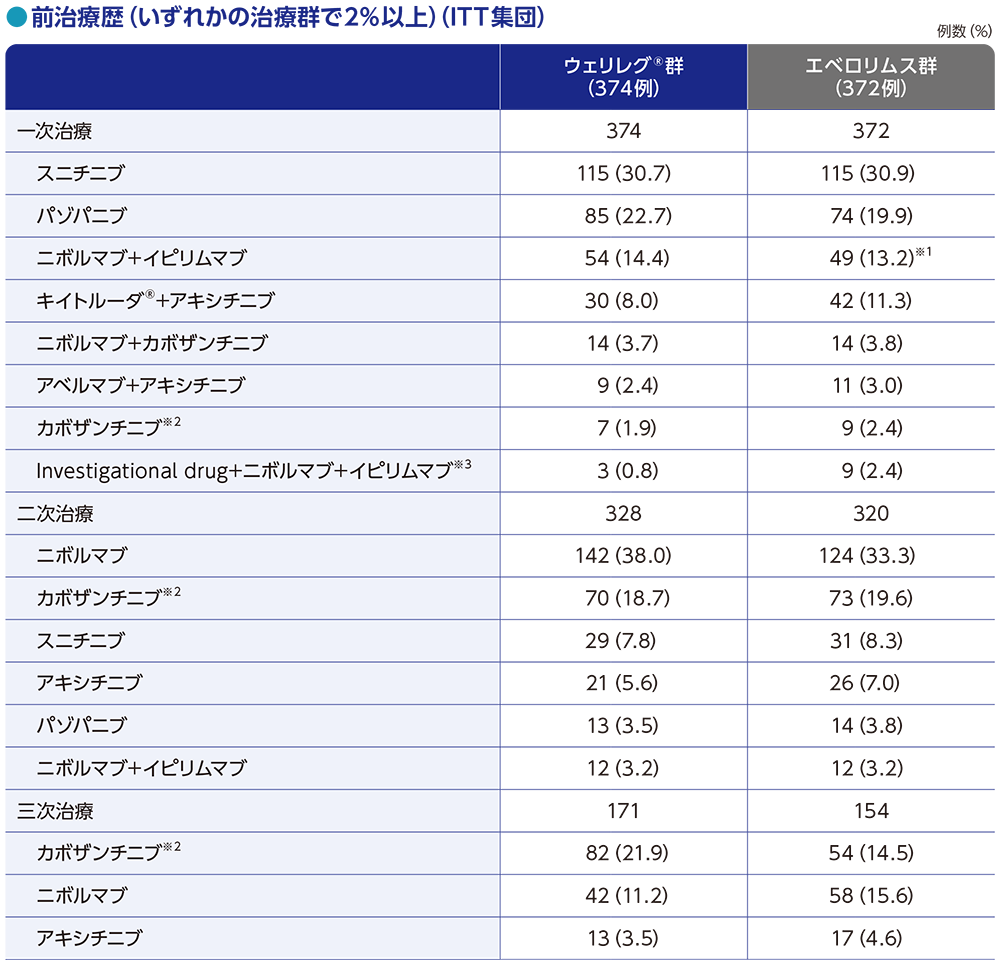
※1 ニボルマブ+イピリムマブ+プラセボの投与を受けた患者1例を含む
※2 カボザンチニブ+プラセボを含む
※3 本レジメンは、根治切除不能又は転移性の腎細胞癌に対して国内承認外のレジメンである
Choueiri TK et al. N Engl J Med 2024; 391: 710-721
Adapted with permission from The New England Journal of Medicine, Choueiri TK et al, Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma, 391, 710-721. Copyright © 2024 Massachusetts Medical Society. Translated with permission.
投与状況

第2回中間解析のデータカットオフ時点で、投与期間中央値は、ウェリレグ®群で7.6ヵ月(範囲:0.1, 35.8)、エベロリムス群で3.9ヵ月(範囲:0, 33.2)でした。
また、追跡期間中央値は25.7ヵ月(範囲:16.8, 39.1)でした。
後治療

後治療を受けた患者は、ウェリレグ®群で47.3%、エベロリムス群で64.5%でした。

※1 患者は該当する各行で1 回のみカウントされた
※2 単剤投与は国内承認外
※3 国内未承認
Choueiri TK et al. N Engl J Med 2024; 391: 710-721
Adapted with permission from The New England Journal of Medicine, Choueiri TK et al, Belzutifan versus Everolimus for Advanced Renal-Cell Carcinoma, 391, 710-721. Copyright © 2024 Massachusetts Medical Society. Translated with permission.
レンビマ®の用法及び用量は以下のとおりです(一部抜粋)。
6.用法及び用量(抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
ペムブロリズマブ(遺伝子組換え)との併用において、通常、成人にはレンバチニブとして1日1回20mgを経口投与する。なお、患者の状態により適宜減量する。
キイトルーダ®の用法及び用量は以下のとおりです(一部抜粋)。
6.用法及び用量(抜粋)
〈根治切除不能又は転移性の腎細胞癌〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。

主要評価項目:無増悪生存期間(PFS)【検証的解析結果】
PFS中央値は、ウェリレグ®群で5.6ヵ月(95%CI:3.9, 7.0)、エベロリムス群で5.6ヵ月(95%CI:4.8, 5.8)でした。ウェリレグ®群は、エベロリムス群に対してPFSを有意に延長しました(ハザード比:0.75、95%CI:0.63, 0.90、p=0.00077、層別ログランク検定[片側]、有意水準α=0.0021;検証的解析結果)。
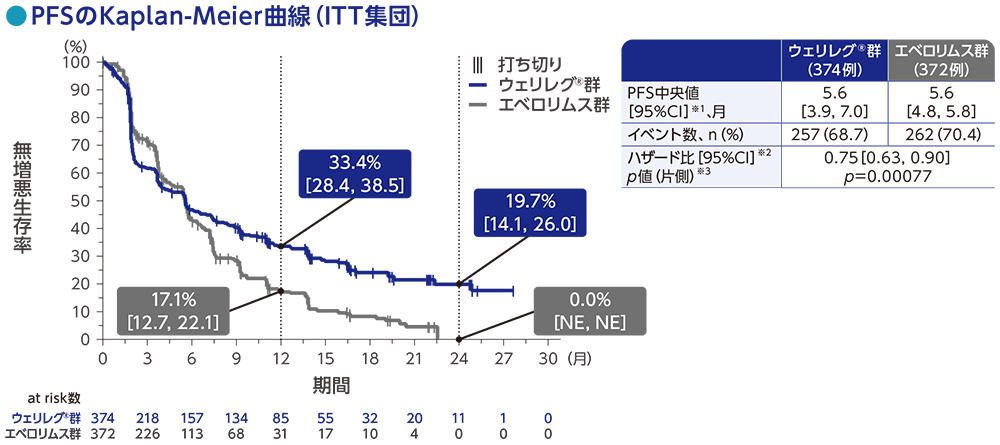
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2022年11月1日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた上記の層別因子による層別ログランク検定[片側]、有意水準α=0.0021(検証的解析結果)
NE:Not Estimated
サブグループ解析:無増悪生存期間(PFS)の部分集団解析

RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2022年11月1日
※1 全体:投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく、サブグループ:投与群を共変量としたCox比例ハザードモデルに基づく

主要評価項目:無増悪生存期間(PFS)
PFS中央値は、ウェリレグ®群で5.6ヵ月(95%CI:3.8, 6.5)、エベロリムス群で5.6ヵ月(95%CI:4.8, 5.8)でした。ウェリレグ®群のエベロリムス群に対するPFSのハザード比は0.74(95%CI:0.63, 0.88)でした。
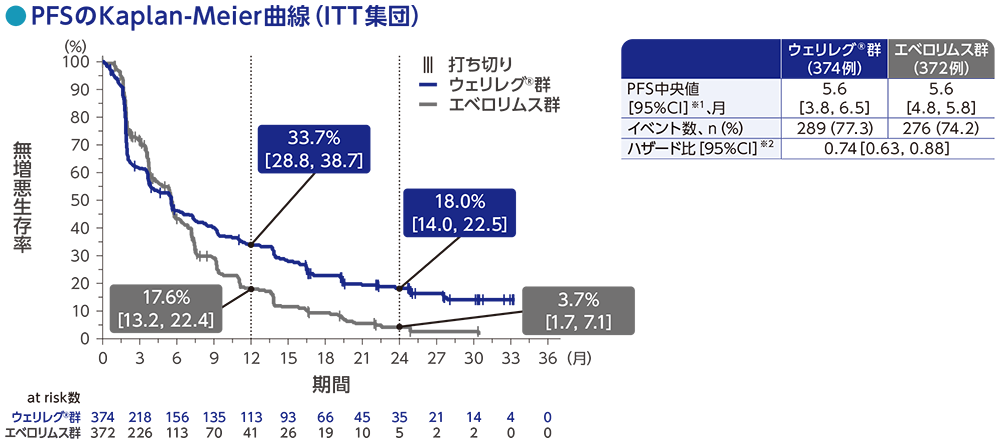
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく
サブグループ解析:無増悪生存期間(PFS)の部分集団解析
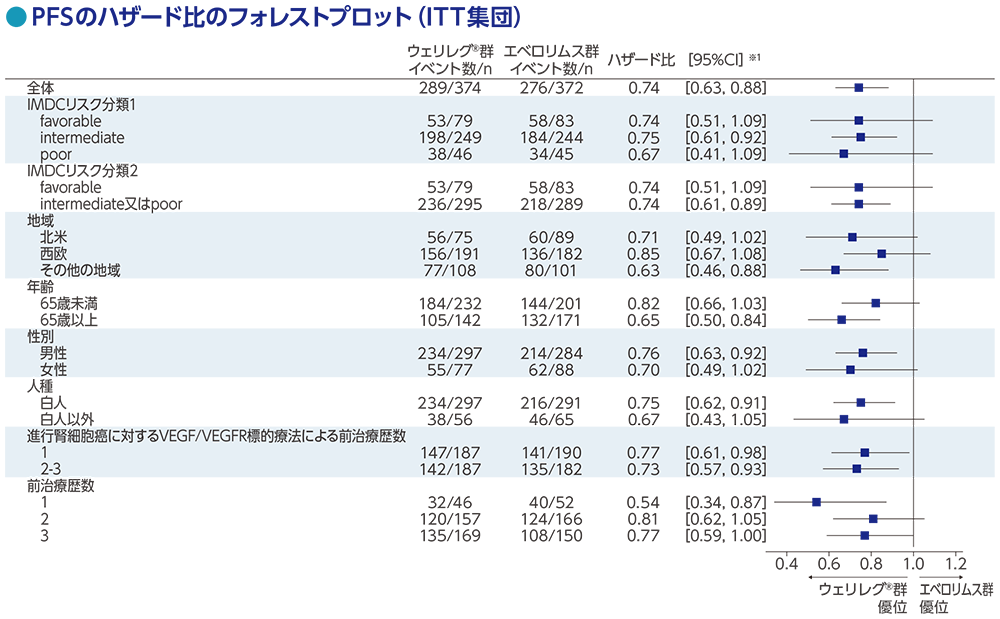
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 全体:投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく、サブグループ:投与群を共変量としたCox比例ハザードモデルに基づく

主要評価項目:全生存期間(OS)【検証的解析結果】
OS中央値は、ウェリレグ®群で21.0ヵ月(95%CI:17.2, 24.3)、エベロリムス群で17.2ヵ月(95%CI:15.3, 19.0)でした。ウェリレグ®群のエベロリムス群に対する優越性は検証されませんでした(ハザード比:0.87、95%CI:0.71, 1.07、p=0.09583、層別ログランク検定[片側]、有意水準 α=0.0045;検証的解析結果)。

データカットオフ日:2022年11月1日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた上記の層別因子による層別ログランク検定[片側]、有意水準α=0.0045(検証的解析結果)
サブグループ解析:全生存期間(OS)の部分集団解析
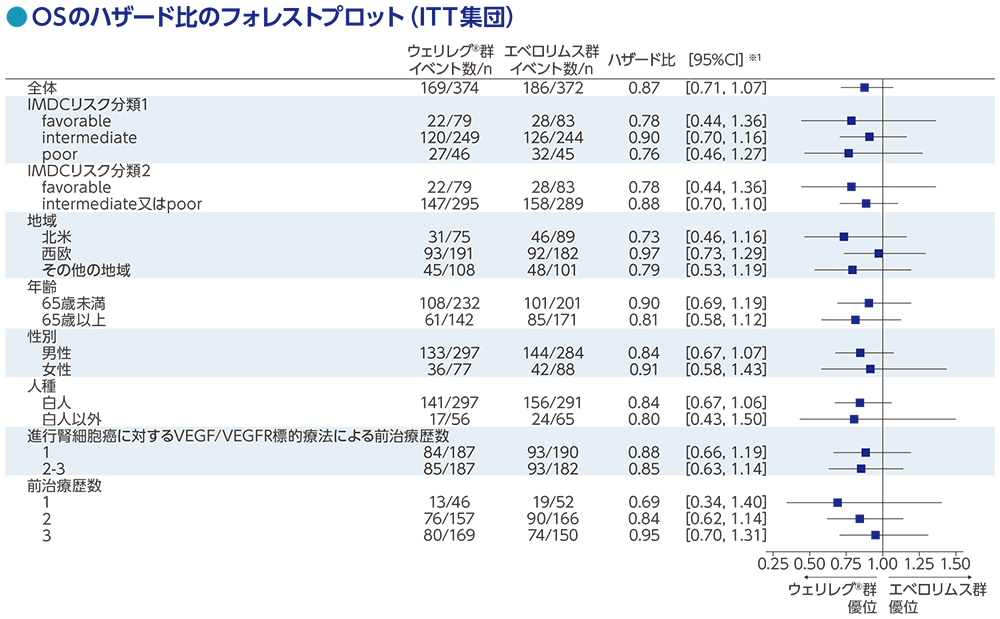
データカットオフ日:2022年11月1日
※1 全体:投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく、サブグループ:投与群を共変量としたCox比例ハザードモデルに基づく

主要評価項目:全生存期間(OS)【検証的解析結果】
OS中央値は、ウェリレグ®群で21.4ヵ月(95%CI:18.2, 24.3)、エベロリムス群で18.1ヵ月(95%CI:15.8, 21.8)でした。ウェリレグ®群のエベロリムス群に対する優越性は検証されませんでした(ハザード比:0.88、95%CI:0.73, 1.07、p=0.09941、層別ログランク検定[片側]、有意水準 α=0.014;検証的解析結果)。

データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく
※3 無作為化に用いた上記の層別因子による層別ログランク検定[片側]、有意水準α=0.014(検証的解析結果)
サブグループ解析:全生存期間(OS)の部分集団解析

データカットオフ日:2023年6月13日
※1 全体:投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく、サブグループ:投与群を共変量としたCox比例ハザードモデルに基づく

副次評価項目:奏効率(ORR)【検証的解析結果】
ORRは、ウェリレグ®群で21.9%(95%CI:17.8, 26.5)、エベロリムス群で3.5%(95%CI:1.9, 5.9)であり、ウェリレグ®群のORRはエベロリムス群に比べて有意に高い値でした(群間差の推定値:18.4%、95%CI:14.0, 23.2、p<0.00001、層別Miettinen and Nurminen法[片側]、有意水準α=0.001;検証的解析結果)。
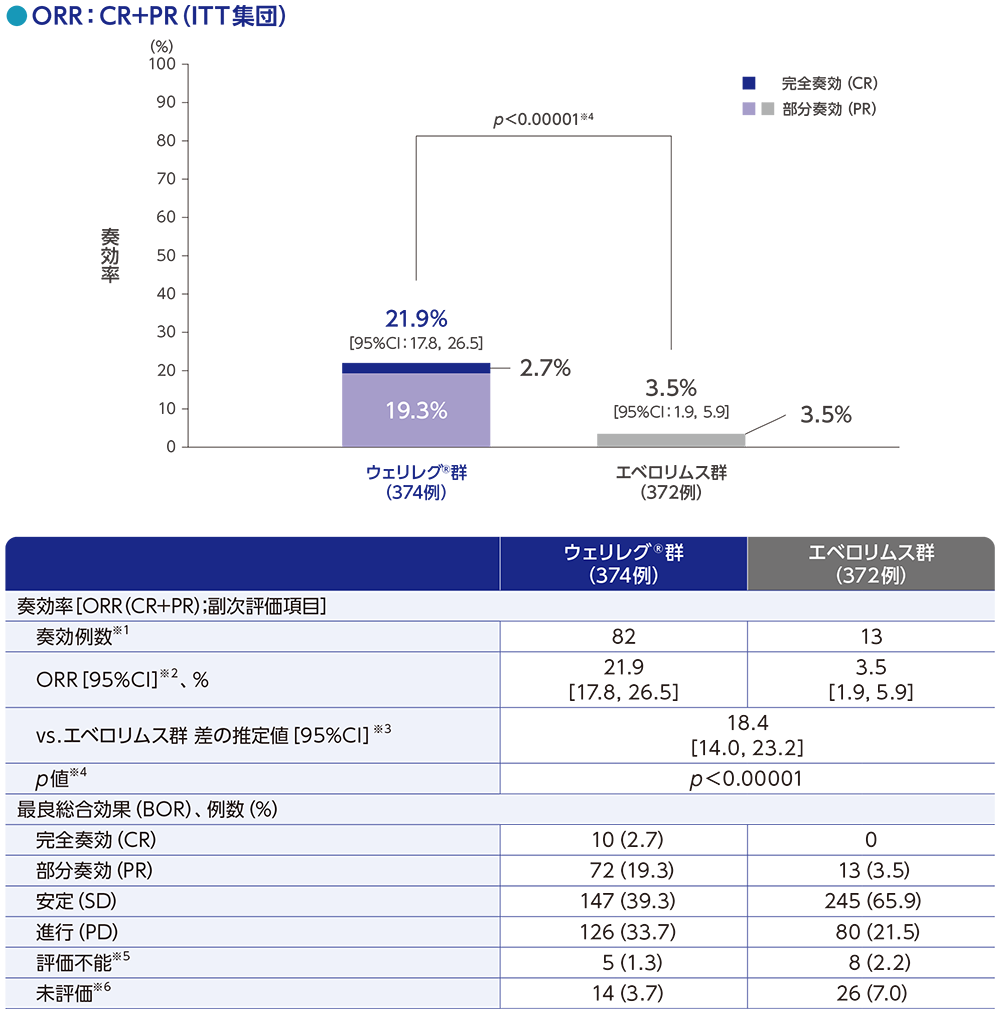
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2022年11月1日
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
※3 層の例数を重みとし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Miettinen and Nurminen法に基づく
※4 無作為化に用いた上記の層別因子による層別Miettinen and Nurminen法[片側]、有意水準α=0.001(検証的解析結果)
※5 評価不能には、RECISTガイドライン1.1版に基づく奏効評価のためのデータが不十分な患者が含まれる
※6 未評価には、データカットオフ時にベースライン後の評価が行われていない患者が含まれる

副次評価項目:奏効率(ORR)
ORRは、ウェリレグ®群で22.7%(95%CI:18.6, 27.3)、エベロリムス群で3.5%(95%CI:1.9, 5.9)でした。
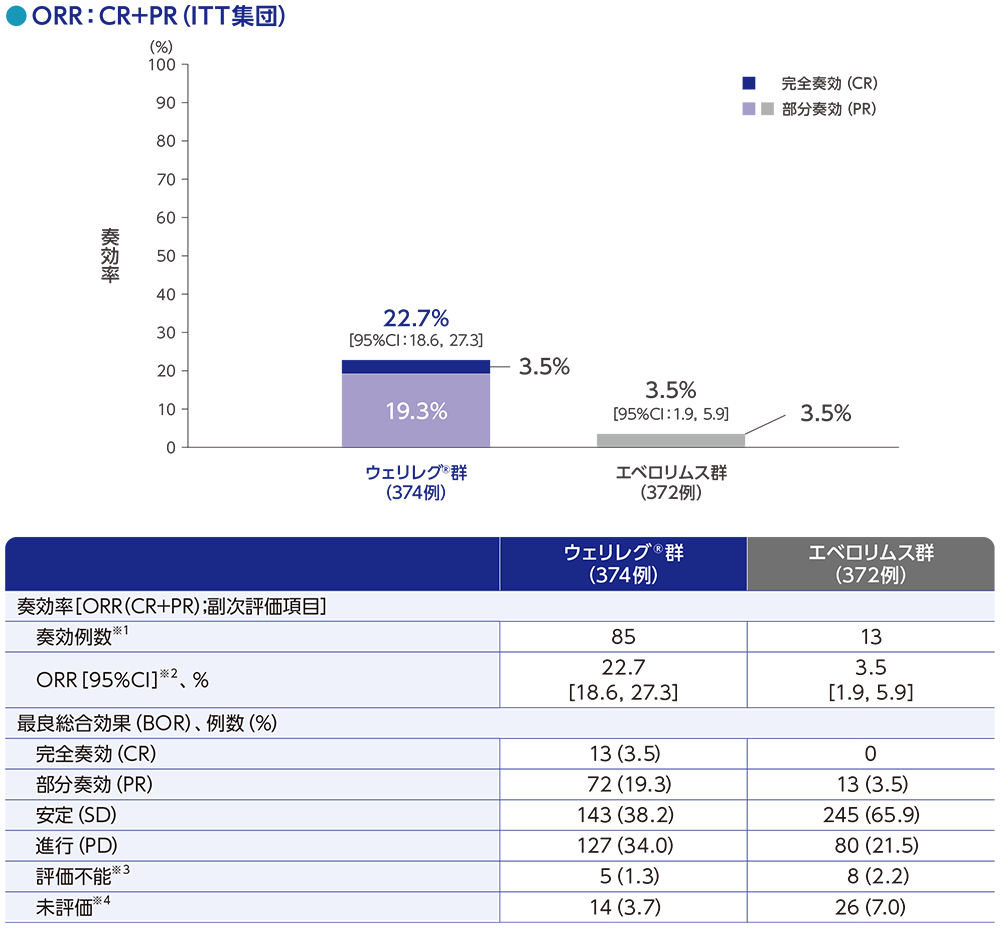
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
※3 評価不能には、RECISTガイドライン1.1版に基づく奏効評価のためのデータが不十分な患者が含まれる
※4 未評価には、データカットオフ時にベースライン後の評価が行われていない患者が含まれる

副次評価項目:奏効期間(DOR)
DOR中央値は、ウェリレグ®群で未到達(範囲:1.7+, 23.2+)、エベロリムス群で17.2ヵ月(範囲:3.8, 18.0+)でした。
奏効が12ヵ月以上持続した患者の割合は、ウェリレグ®群で74.2%、エベロリムス群で68.4%でした。
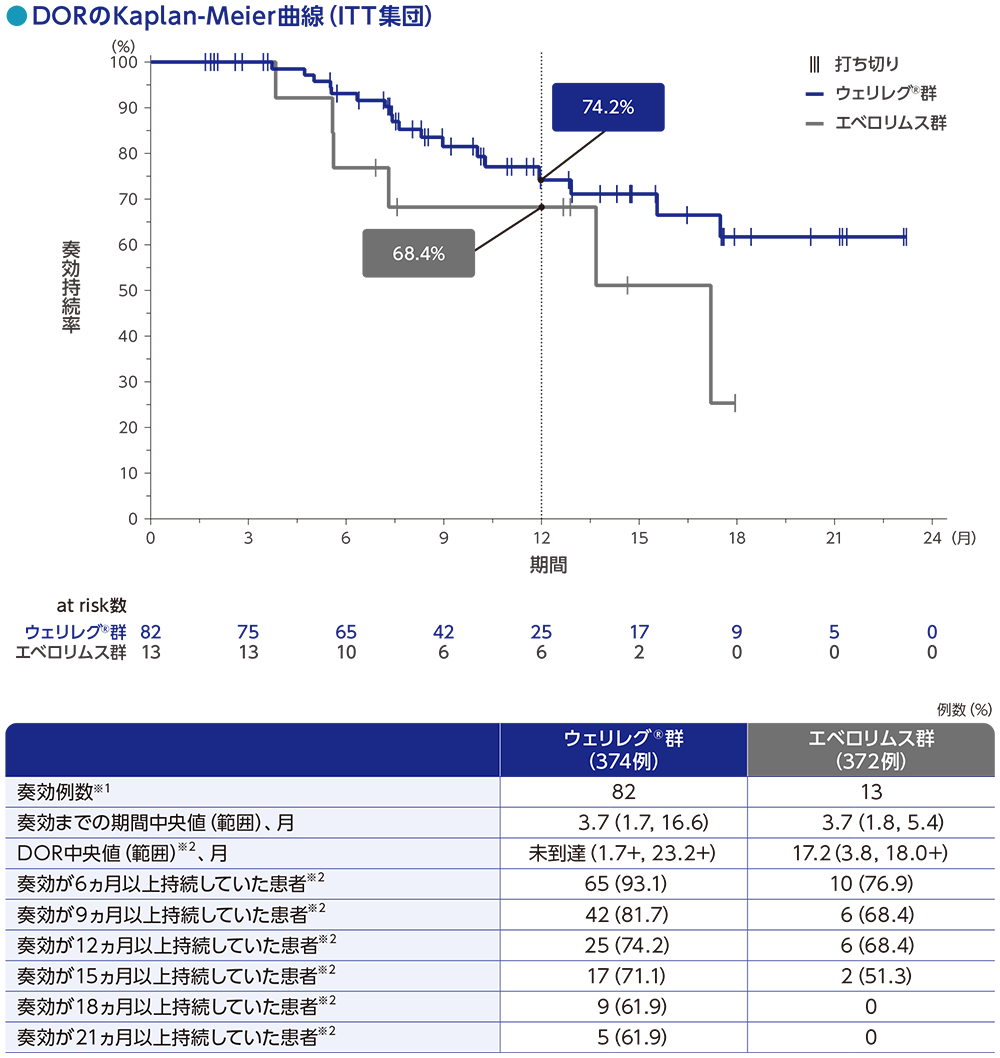
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2022年11月1日
※1 CR又はPRが認められた患者数
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す

副次評価項目:奏効期間(DOR)
DOR中央値は、ウェリレグ®群で19.5ヵ月(範囲:1.9+, 31.6+)、エベロリムス群で13.7ヵ月(範囲:3.8, 21. 2+)でした。
奏効が12ヵ月以上持続した患者の割合は、ウェリレグ®群で73.2%、エベロリムス群で61.5%でした。
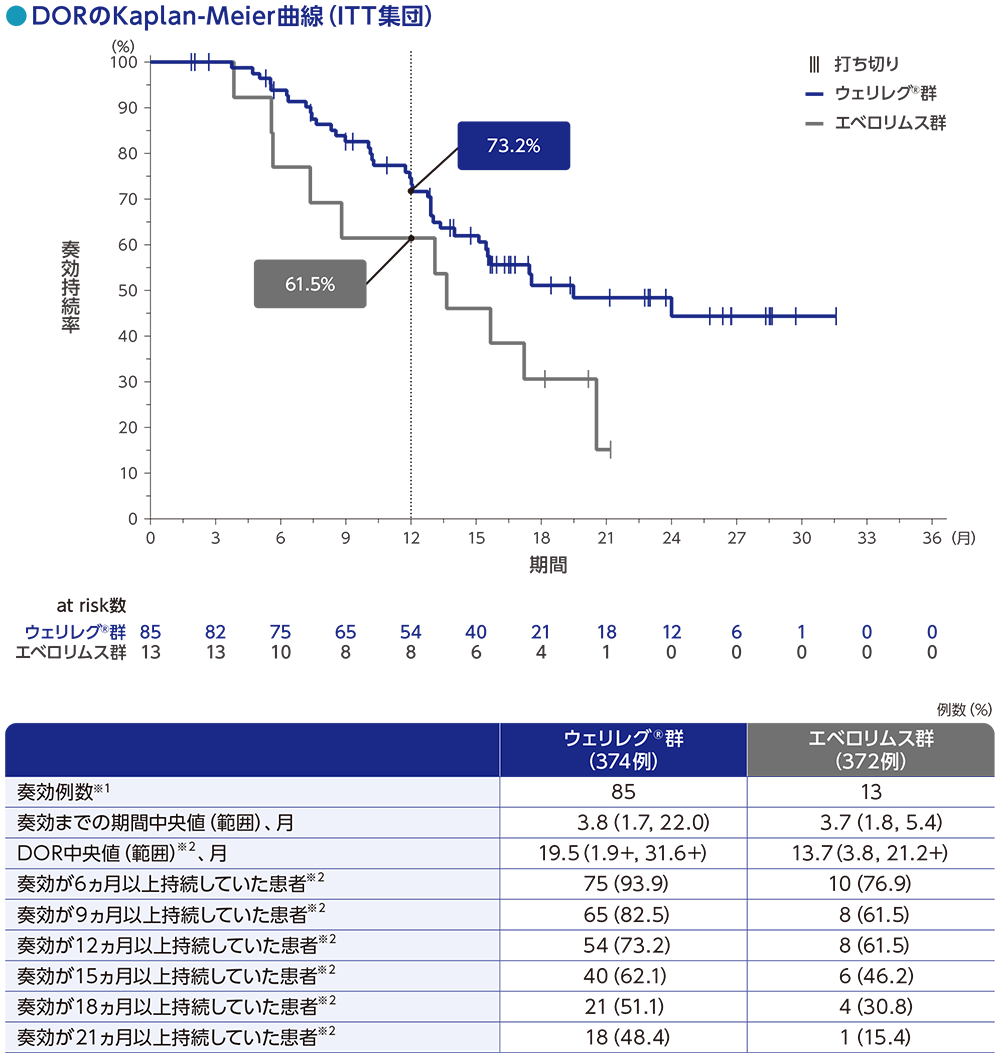
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 CR又はPRが認められた患者数
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す

副次評価項目:EORTC QLQ-C30の全般的健康状態/HRQoLスコア
EORTC QLQ-C30の全般的健康状態/HRQoLスコアのTTD※1中央値は、ウェリレグ®群で19.35ヵ月(95%CI:11.89, NE)、エベロリムス群で10.19ヵ月(95%CI:6.47, 12.98)でした。ウェリレグ®群のエベロリムス群に対するハザード比は0.75(95%CI:0.58, 0.96)でした。
※1 EORTC QLQ-C30のTTDは、ベースラインからスコアが10ポイント以上減少するまでの期間と定義した
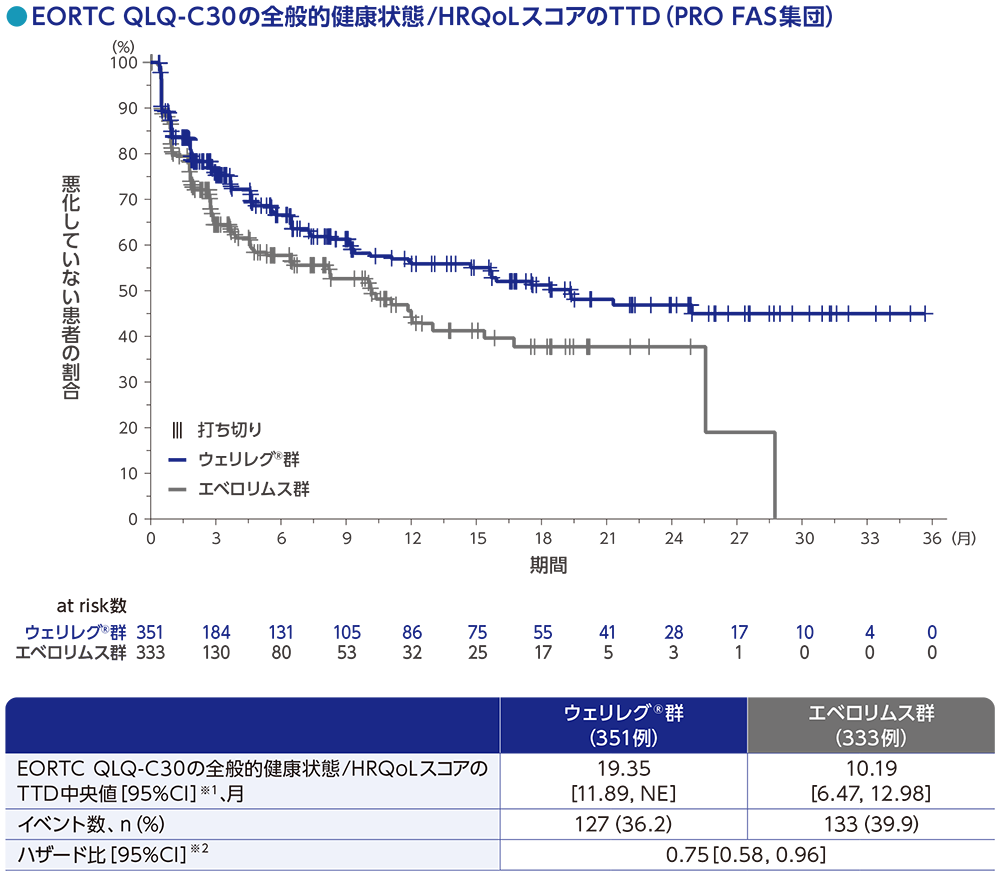
データカットオフ日: 2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく
NE:Not Estimated
EORTC QLQ-C30は、がん患者の生活の質(QoL)を評価する目的で開発された。100を超える言語に翻訳、バリデートされており、全世界で3,000を超える試験で使用されている。EORTC QLQ-C30には、5つの活動性尺度(身体的、役割、精神的、認知、社会的)、3つの身体症状尺度(疲れ、悪心/嘔吐、痛み)、6つの身体症状又は経済的項目(息切れ、不眠、食欲不振、便秘、下痢及び経済状態)が含まれる[Aaronson NK et al. J Natl Cancer Inst 1993; 85: 365-376]。EORTC QLQ-C30は、4段階(1=全くない、2=少しある、3=多い、4=とても多い)でスコア化する。EORTC QLQ-C30には、7段階(1=とても悪い~7=とてもよい)でスコア化する全般的健康状態/QoLの尺度も1つ含まれる。

副次評価項目:FKSI-DRSスコア
FKSI-DRSスコアのTTD※1中央値は、ウェリレグ®群で未到達(95%CI:21.26, NE)、エベロリムス群で11.99ヵ月(95%CI:5.55, 15.38)でした。ウェリレグ®群のエベロリムス群に対するハザード比は0.53(95%CI:0.41, 0.69)でした。
※1 FKSI-DRSスコアのTTDは、ベースラインからスコアが3ポイント以上減少するまでの期間と定義した
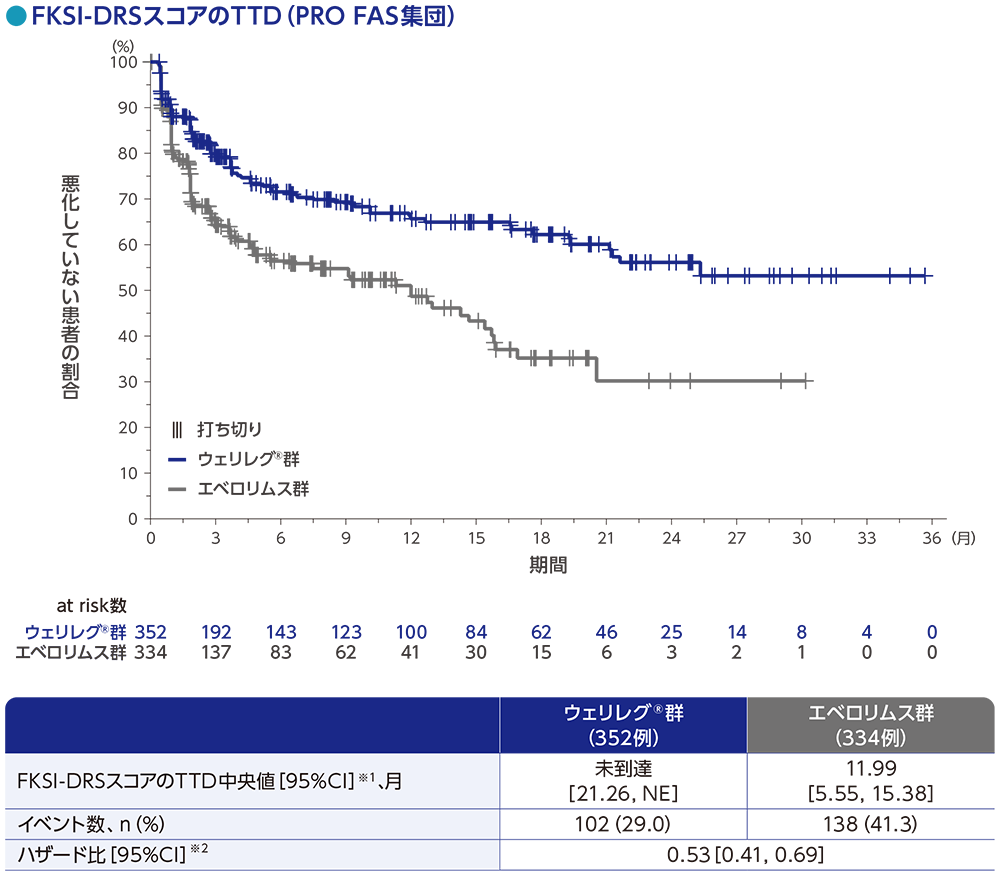
データカットオフ日: 2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量とし、無作為化に用いた層別因子[IMDCリスク分類(favorable、intermediate、poor)、進行腎細胞癌に対するVEGF/VEGFR標的療法の前治療歴数(1、2~3)]で層別した層別Cox比例ハザードモデルに基づく
NE:Not Estimated
FKSI-DRSは、患者報告式の評価ツールであり、腎癌に関連する9つの症状[活力喪失、疲労、体重減少、疼痛(全身性)、骨痛、息切れ、咳嗽、発熱、血尿]を測定する[Cella D et al. Med Care 2007; 45: S3-S11]。各症状を5段階の選択肢(0=全くない、1=ほんの少しある、2=多少ある、3=多い、4=とても多い)によりスコア化する。9つの質問全てが否定的であるため、スコア評価マニュアルに従い、各症状で選択されたスコアから4を減じ、負の値は正の値に反転させる。FKSI-DRSの各症状のスコアを合計し、0から36までの合計スコア[スコアが高いほど、改善した(より好ましい)症状を表す]を算出する。

安全性:副作用(APaT集団)
ウェリレグ®群
ウェリレグ®群の副作用は、372例中331例(89.0%)に認められ、10%以上に発現した主な副作用は、貧血267例(71.8%)、疲労79例(21.2%)、低酸素症44例(11.8%)、悪心39例(10.5%)でした。
Grade 3以上の副作用は、144例(38.7%)に認められ、5%以上に発現した主なGrade 3以上の副作用は、貧血101例(27.2%)、低酸素症32例(8.6%)でした。
重篤な副作用は、49例(13.2%)に認められ、1%以上に発現した主な重篤な副作用は、低酸素症21例(5.6%)、貧血16例(4.3%)でした。
減量に至った副作用は44例(11.8%)に認められ、1%以上に発現した主な減量に至った副作用は、低酸素症20例(5.4%)、貧血11例(3.0%)でした。
休薬に至った副作用は80例(21.5%)に認められ、2%以上に発現した主な休薬に至った副作用は、貧血25例(6.7%)、低酸素症16例(4.3%)でした。
投与中止に至った副作用は、10例(2.7%)に認められ、0.5%以上に発現した主な投与中止に至った副作用は、低酸素症3例(0.8%)でした。
死亡に至った副作用は、多臓器機能不全症候群1例(0.3%)でした。
エベロリムス群
エベロリムス群の副作用は、360例中322例(89.4%)に認められ、10%以上に発現した主な副作用は、口内炎125例(34.7%)、貧血123例(34.2%)、疲労60例(16.7%)、下痢57例(15.8%)、発疹56例(15.6%)、肺臓炎48例(13.3%)、そう痒症47例(13.1%)、高トリグリセリド血症45例(12.5%)、無力症39例(10.8%)、高血糖37例(10.3%)でした。
Grade 3以上の副作用は、142例(39.4%)に認められ、5%以上に発現した主なGrade 3以上の副作用は、貧血39例(10.8%)でした。
重篤な副作用は、47例(13.1%)に認められ、1%以上に発現した主な重篤な副作用は、肺臓炎15例(4.2%)、貧血5例(1.4%)でした。
減量に至った副作用は52例(14.4%)に認められ、1%以上に発現した主な減量に至った副作用は、口内炎10例(2.8%)、貧血6例(1.7%)、高血糖、肺臓炎 各4例(1.1%)でした。
休薬に至った副作用は132例(36.7%)に認められ、2%以上に発現した主な休薬に至った副作用は、口内炎27例(7.5%)、肺臓炎13例(3.6%)、発疹9例(2.5%)、高トリグリセリド血症8例(2.2%)でした。
投与中止に至った副作用は、38例(10.6%)に認められ、0.5%以上に発現した主な投与中止に至った副作用は、肺臓炎16例(4.4%)、血中クレアチニン増加及び貧血 各2例(0.6%)でした。
死亡に至った副作用は、敗血症及び急性腎障害 各1例(0.3%)でした。
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日

■主な副作用(APaT集団)
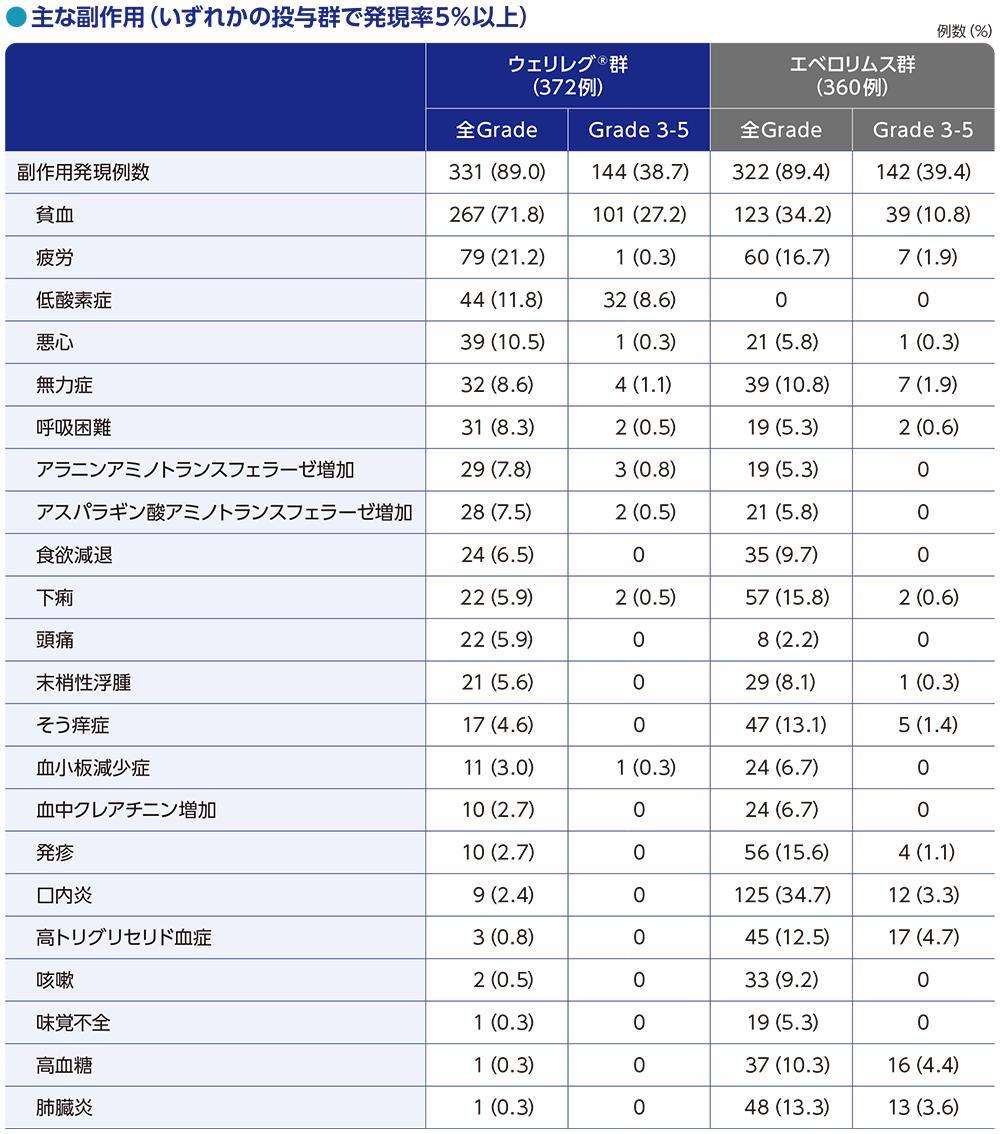
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日

■注意を要する有害事象(APaT集団)
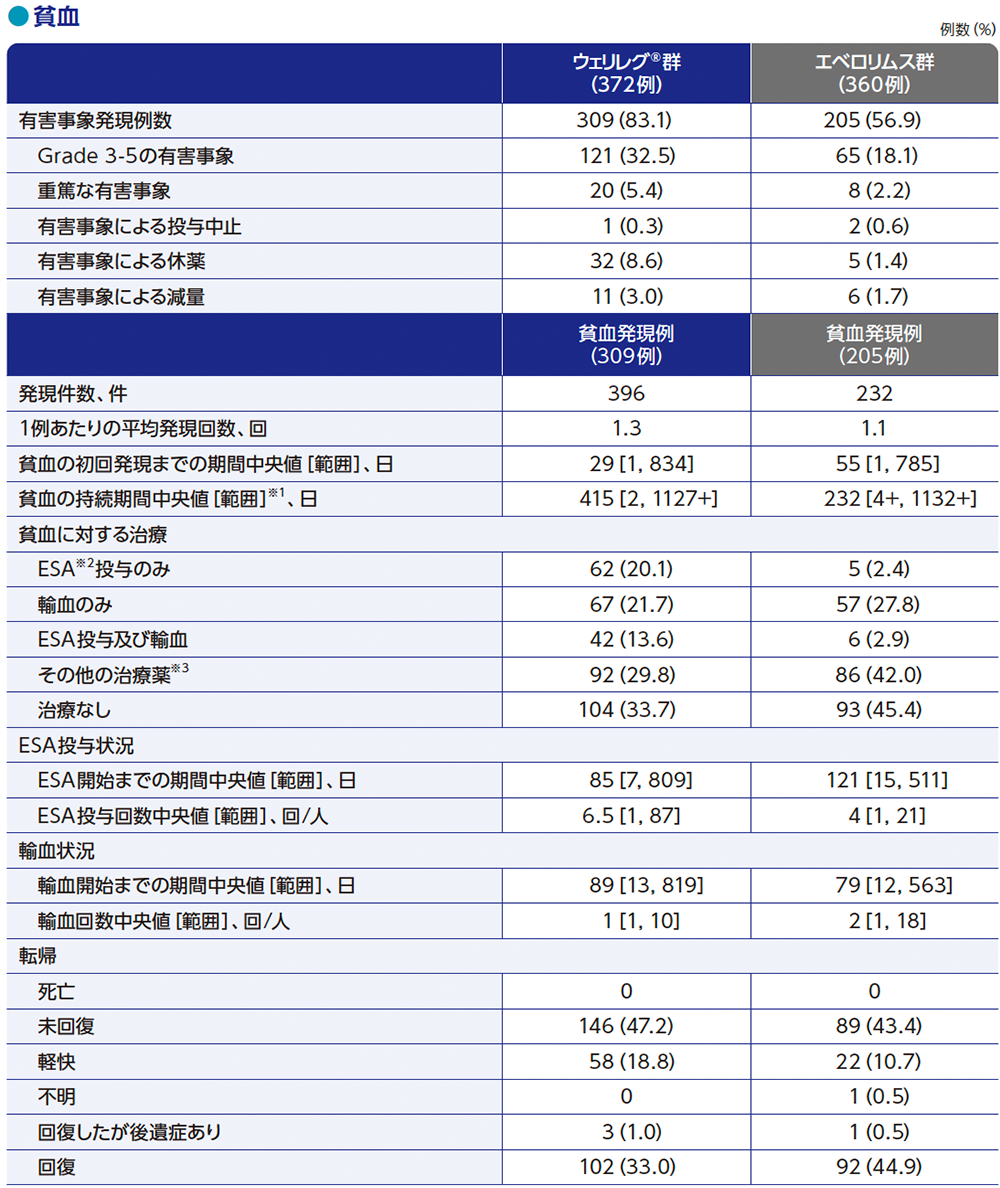
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。データ解析時点で有害事象が未回復の場合、又は有害事象が未回復のまま死亡した場合、データカットオフ日又は死亡日のいずれか早い方で打ち切りとした
※2 ESA(erythropoiesis-stimulating agents):赤血球造血刺激因子製剤
※3 鉄及びビタミンサプリメント等
「+」は有害事象がデータカットオフ日または死亡日までに回復/治癒しなかったことを示す
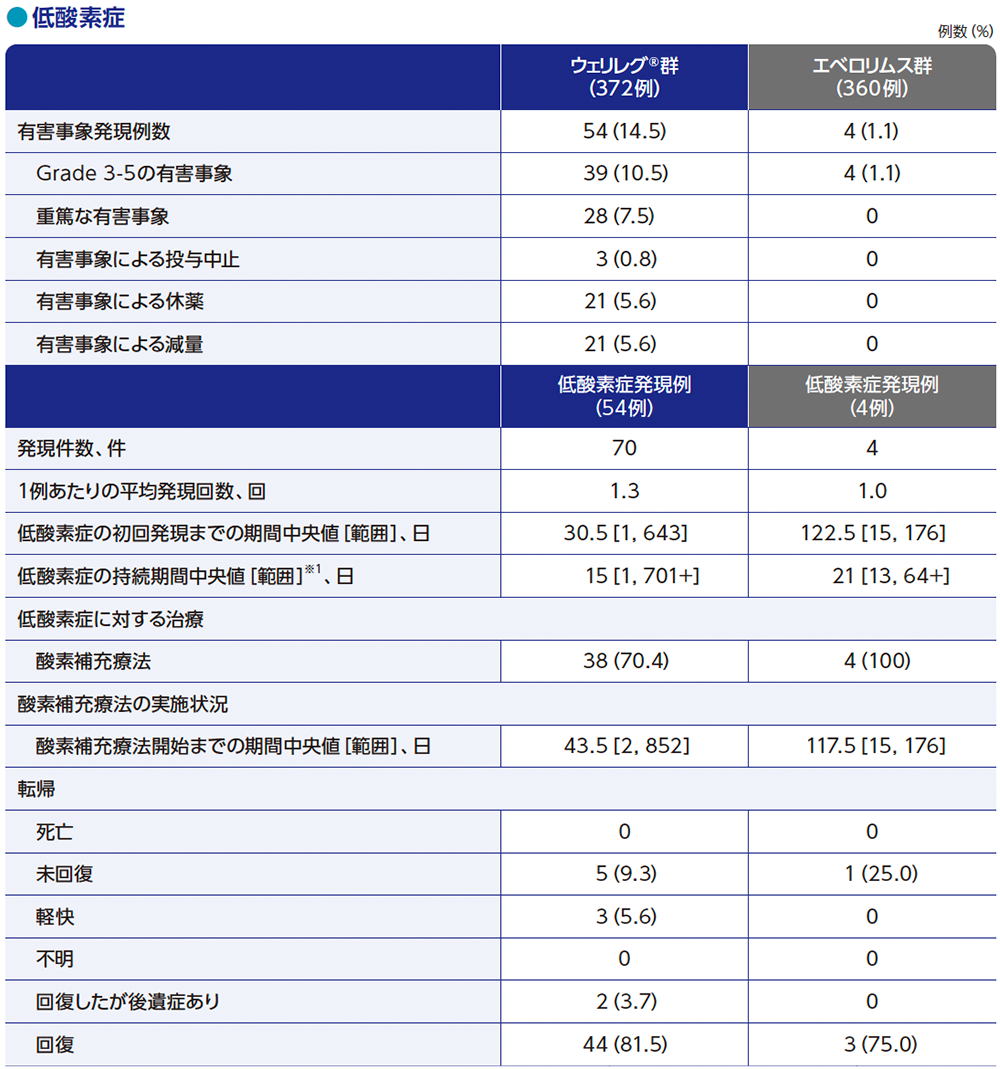
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。データ解析時点で有害事象が未回復の場合、又は有害事象が未回復のまま死亡した場合、データカットオフ日又は死亡日のいずれか早い方で打ち切りとした
「+」は有害事象がデータカットオフ日または死亡日までに回復/治癒しなかったことを示す
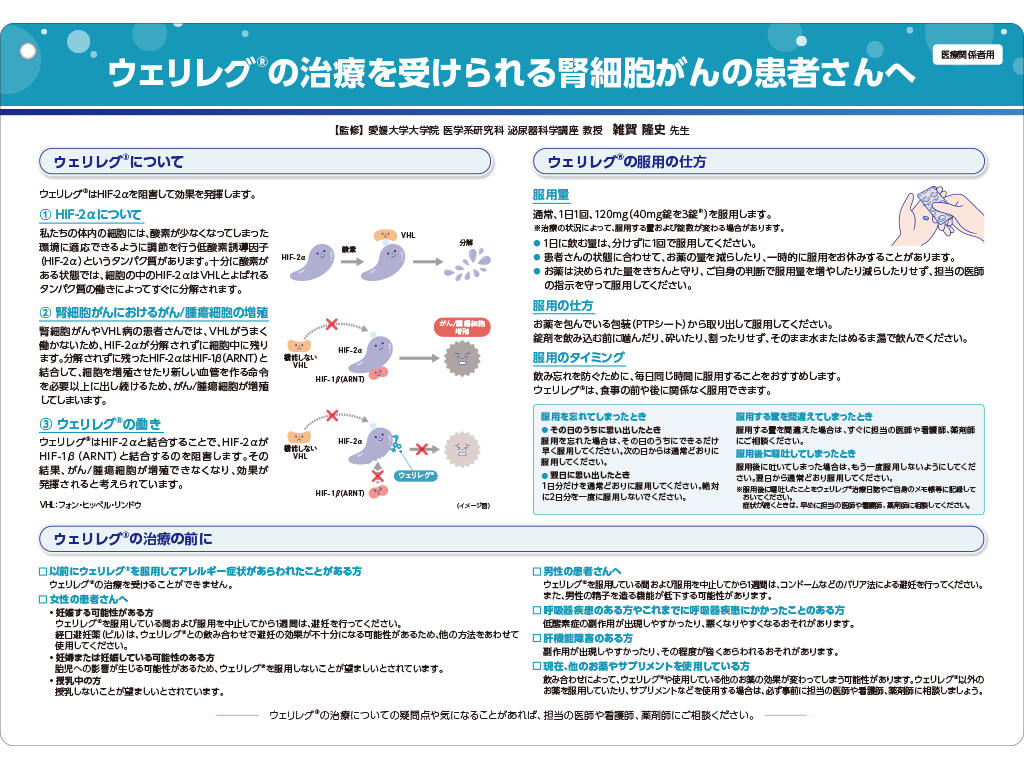
ウェリレグ®投与に伴う貧血の発現機序
通常時(正常な酸素環境/正常なVHL蛋白質機能)1)
通常時では、HIF-2αにVHL蛋白質が結合し、HIF-2αは分解されます。

低酸素環境/VHL蛋白質機能喪失:赤血球生成の増加1)
低酸素環境下、又はVHL遺伝子変異等*によるVHL蛋白質の機能が喪失している場合には、HIF-2αは分解を免れ、HIF-1βとのヘテロ二量体を形成します。HIF-2α-HIF-1βヘテロ二量体は、赤血球生成を制御する遺伝子など、様々な下流遺伝子の発現を誘導します。特にエリスロポエチン(EPO)産生には重要な役割を果たしており、HIF-2α-HIF-1βヘテロ二量体形成によりEPO遺伝子転写が誘導され、赤血球生成が増加します。

*エピジェネティックなサイレンシングを有することがあるため、VHL遺伝子に変異が認められない場合があります2)。
ウェリレグ®投与時:赤血球生成の減少1,3,4)
ウェリレグ®は、選択的HIF-2α阻害剤です。ウェリレグ®投与によりHIF-2α-HIF-1βヘテロ二量体形成が阻害されることによりEPO遺伝子転写が抑制され、赤血球生成が減少する可能性があります。

1)Kaelin Jr WG. J Clin Oncol 2018; 36: 908-910
著者はPeloton Therapeutics社(現MSD)から資金援助等を受けている。
2)Nguyen MP et al. Arch Pharm Res 2013; 36: 252-263
3)ウェリレグ®電子添文
4)社内資料:HIF-2αの選択的阻害
患者背景(日本人集団)
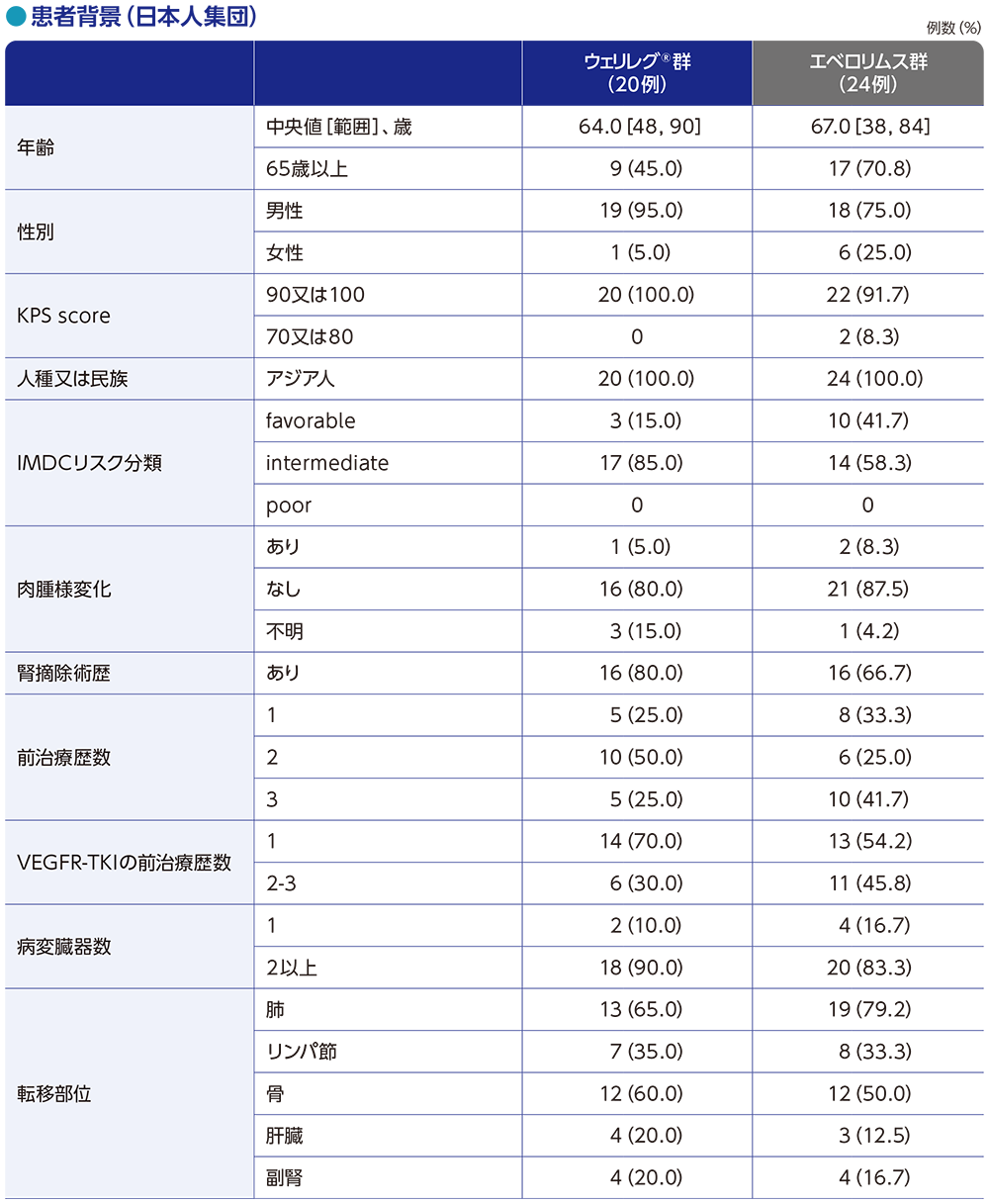
日本人集団の患者の内訳
●患者の内訳(日本人集団)
日本人集団44例のうち、20例がウェリレグ®群、24例がエベロリムス群に無作為割付けされ、全例が1回以上治験薬の投与を受けました。
第1回中間解析のデータカットオフ時点において、治験薬投与を継続していた患者は、ウェリレグ®群で11例(55.0%)、エベロリムス群で5例(20.8%)でした。
第2回中間解析のデータカットオフ時点において、治験薬投与を継続していた患者は、ウェリレグ®群で7例(35.0%)、エベロリムス群で5例(20.8%)でした。

投与状況
第2回中間解析における日本人集団の投与期間中央値は、ウェリレグ®群で15.3ヵ月(範囲:0.5, 25.7)、エベロリムス群で7.2ヵ月(範囲:0.9, 23.3)でした。
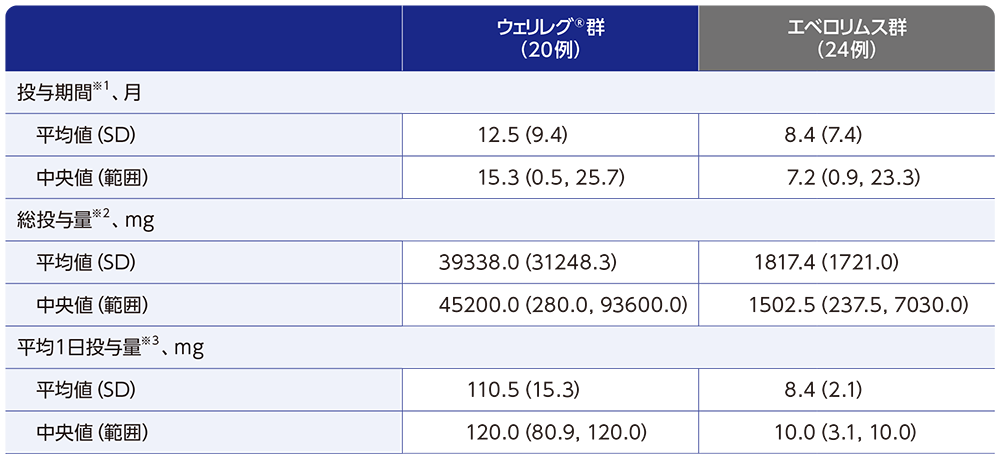
データカットオフ日:2023年6月13日
※1 投与期間は、各治療群における初回投与日から最終投与日までの期間として計算した。
※2 患者の総投与量は、患者が服用した総服用量である。
※3 患者の平均1日投与量は、総投与量を服用した総日数で割って計算した。
SD(standard deviation):標準偏差

サブグループ解析:日本人集団における無増悪生存期間(PFS)
PFSのハザード比は0.59(95%CI:0.26, 1.34)でした。PFS中央値は、ウェリレグ®群で未到達(95%CI:1.7, NE)、エベロリムス群で5.6ヵ月(95%CI:3.0, 7.4)でした。

RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2022年11月1日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量としたCox比例ハザードモデルに基づく
NE:Not Estimated

サブグループ解析:日本人集団における無増悪生存期間(PFS)
PFSのハザード比は0.61(95%CI:0.29, 1.27)でした。PFS中央値は、ウェリレグ®群で13.7ヵ月(95%CI:1.7, NE)、エベロリムス群で5.6ヵ月(95%CI:3.0, 7.4)でした。
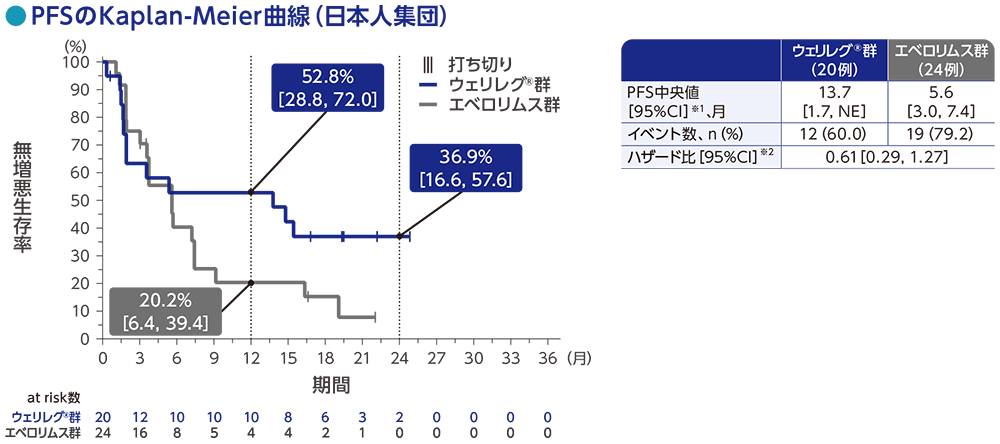
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量としたCox比例ハザードモデルに基づく
NE:Not Estimated
サブグループ解析:日本人集団における全生存期間(OS)
OSのハザード比は1.18(95%CI:0.44, 3.15)でした。OS中央値は、ウェリレグ®群で23.0ヵ月(95%CI:10.9, NE)、エベロリムス群で未到達(95%CI:14.1, NE)でした。

データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量としたCox比例ハザードモデルに基づく
NE:Not Estimated

サブグループ解析:日本人集団における奏効率(ORR)
ORRは、ウェリレグ®群で35.0%(95%CI:15.4, 59.2)、エベロリムス群で0.0%(95%CI:0.0, 14.2)でした。
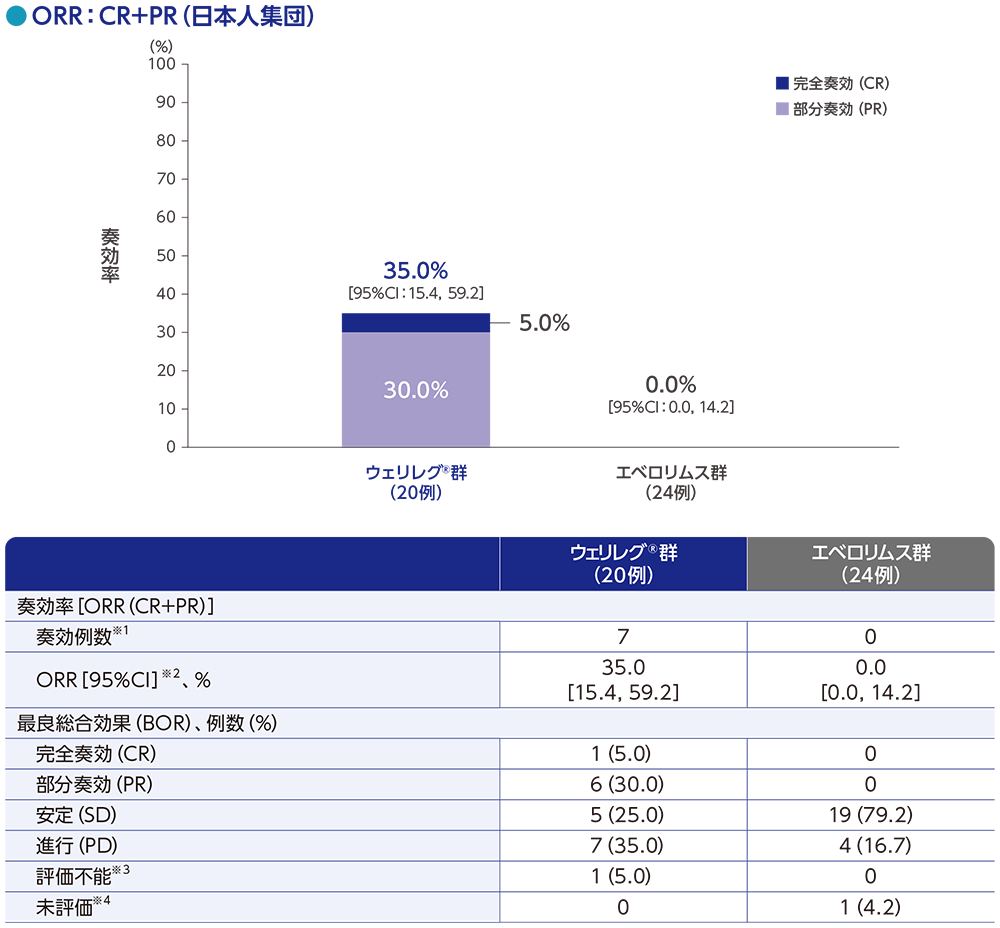
RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
※3 評価不能には、RECISTガイドライン1.1版に基づく奏効評価のためのデータが不十分な患者が含まれる
※4 未評価には、データカットオフ時にベースライン後の評価が行われていない患者が含まれる

サブグループ解析:日本人集団における奏効期間(DOR)
DOR中央値は、ウェリレグ®群で未到達(範囲:12.9, 23.0+)でした。

RECISTガイドライン1.1版に基づくBICRによる評価
データカットオフ日:2023年6月13日
※1 CR又はPRが認められた患者数
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す

サブグループ解析:日本人集団におけるEORTC QLQ-C30の全般的健康状態/HRQoLスコア
EORTC QLQ-C30の全般的健康状態/HRQoLスコアのTTD中央値※1は、ウェリレグ®群で15.67ヵ月(95%CI:0.49, NE)、エベロリムス群で3.75ヵ月(95%CI:0.99, NE)でした(ハザード比0.89、95%CI:0.39, 2.05)※2。
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量としたCox比例ハザードモデルに基づく
NE:Not Estimated

サブグループ解析:日本人集団におけるFKSI-DRSスコア
FKSI-DRSスコアのTTD中央値※1は、ウェリレグ®群で未到達(95%CI:3.71, NE)、エベロリムス群で未到達(95%CI:1.84, NE)でした(ハザード比0.74、95%CI:0.24, 2.26)※2。
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく
※2 投与群を共変量としたCox比例ハザードモデルに基づく
NE:Not Estimated

安全性:副作用(日本人集団)
ウェリレグ®群
ウェリレグ®群の副作用は、20例全例に認められ、10%以上に発現した主な副作用は、貧血16例(80.0%)、ALT増加、AST増加、食欲減退、疲労、倦怠感及び血小板数減少 各3例(15.0%)、呼吸困難、肝機能異常、低酸素症、発熱及び口内炎 各2例(10.0%)でした。
Grade 3以上の副作用は、7例(35.0%)に認められ、10%以上に発現した主なGrade 3以上の副作用は、貧血5例(25.0%)、低酸素症2例(10.0%)でした。
重篤な副作用は、4例(20.0%)に認められ、低酸素症2例(10.0%)、播種性血管内凝固、多臓器機能不全症候群及び発熱 各1例(5.0%)でした。
減量に至った副作用は2例(10.0%)に認められ、疲労、低酸素症 各1例(5.0%)でした。
休薬に至った副作用は7例(35.0%)に認められました。
投与中止に至った副作用は、多臓器機能不全症候群1例(5.0%)でした。
死亡に至った副作用は、多臓器機能不全症候群1例(5.0%)でした。
エベロリムス群
エベロリムス群の副作用は、24例全例に認められ、10%以上に発現した主な副作用は、口内炎11例(45.8%)、間質性肺疾患7例(29.2%)、血中クレアチニン増加6例(25.0%)、高血糖5例(20.8%)、血小板数減少、そう痒症及び脂質異常症 各4例(16.7%)、貧血、肝機能異常及び発疹 各3例(12.5%)でした。
Grade 3以上の副作用は、9例(37.5%)に認められ、10%以上に発現した主なGrade 3以上の副作用は、高血糖3例(12.5%)でした。
重篤な副作用は、6例(25.0%)に認められ、間質性肺疾患2例(8.3%)、肺炎、糖尿病、高血糖、高トリグリセリド血症及び薬疹 各1例(4.2%)でした。
減量に至った副作用は8例(33.3%)に認められ、 2例以上に発現した主な減量に至った副作用は、口内炎、血中クレアチニン増加、高血糖 各2例(8.3%)でした。
休薬に至った副作用は10例(41.7%)に認められました。
投与中止に至った副作用は、2例(8.3%)に認められ、血中クレアチニン増加及び間質性肺疾患 各1例(4.2%)でした。
死亡に至った副作用は、認められませんでした。
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日

■主な副作用(日本人集団)
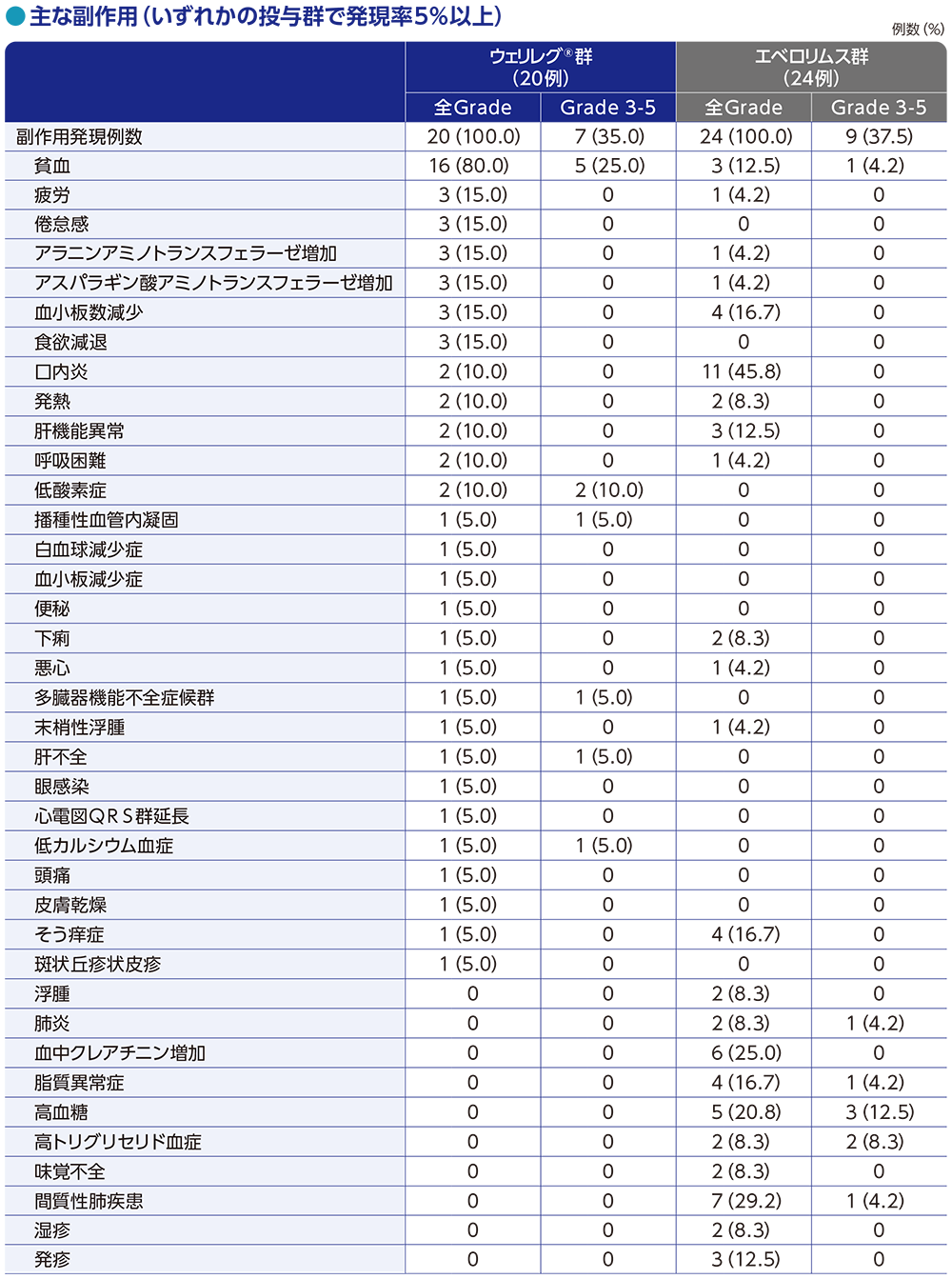
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日

■注意を要する有害事象(日本人集団)

MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。データ解析時点で有害事象が未回復の場合、又は有害事象が未回復のまま死亡した場合、データカットオフ日又は死亡日のいずれか早い方で打ち切りとした
※2 鉄及びビタミンサプリメント等
「+」は有害事象がデータカットオフ日または死亡日までに回復/治癒しなかったことを示す
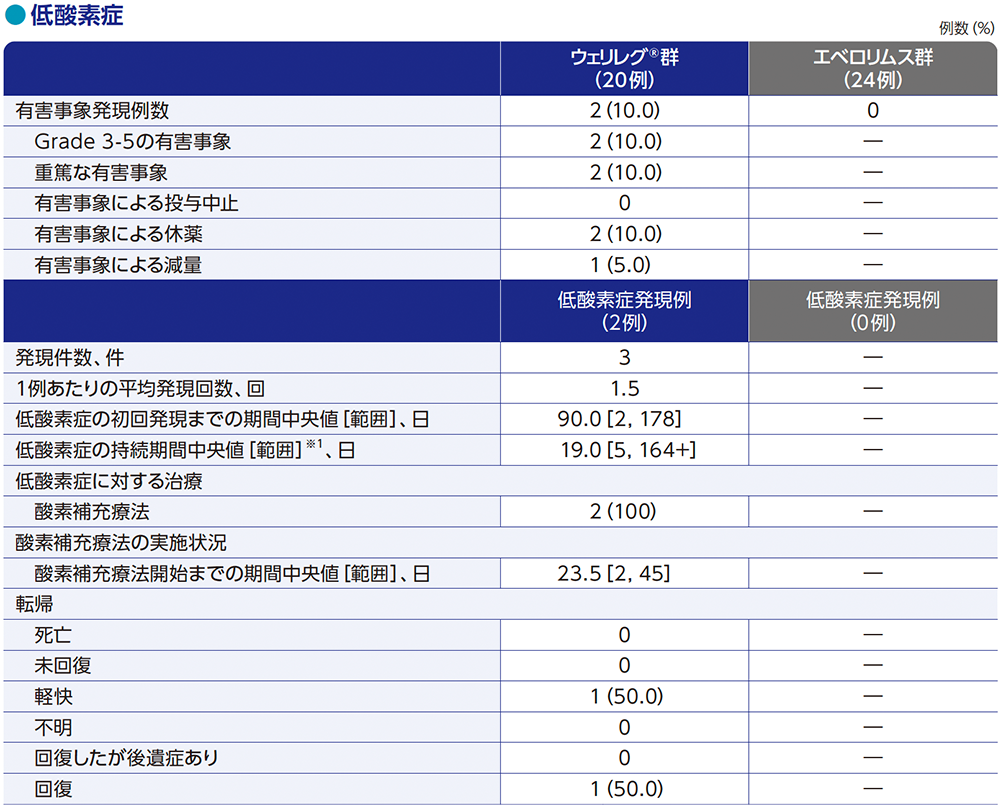
MedDRA v26.0、GradeはNCI CTCAE v5.0
データカットオフ日:2023年6月13日
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。データ解析時点で有害事象が未回復の場合、又は有害事象が未回復のまま死亡した場合、データカットオフ日又は死亡日のいずれか早い方で打ち切りとした
「+」は有害事象がデータカットオフ日または死亡日までに回復/治癒しなかったことを示す
関連コンテンツ

がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌における新規作用機序 HIF-2α阻害剤ウェリレグ®―LITESPARK-005試験―
本動画では、腎細胞癌の病態及びウェリレグ®の作用機序に加えて、腎細胞癌におけるウェリレグ®のエビデンスである「LITESPARK-005試験」の結果について、わ […]
ウェリレグ®・悪性腫瘍関連領域情報

がん化学療法後に増悪した根治切除不能又は転移性の腎細胞癌における新規作用機序 HIF-2α阻害剤ウェリレグ®―LITESPARK-005試験―
本動画では、腎細胞癌の病態及びウェリレグ®の作用機序に加えて、腎細胞癌におけるウェリレグ®のエビデンスである「LITESPARK-005試験」の結果について、わ […]
