海外第Ⅱ相試験<LITESPARK-004試験>
海外第Ⅱ相試験<LITESPARK-004試験;海外データ>
承認時評価資料:海外第Ⅱ相試験(LITESPARK-004試験)
試験概要
【目的】
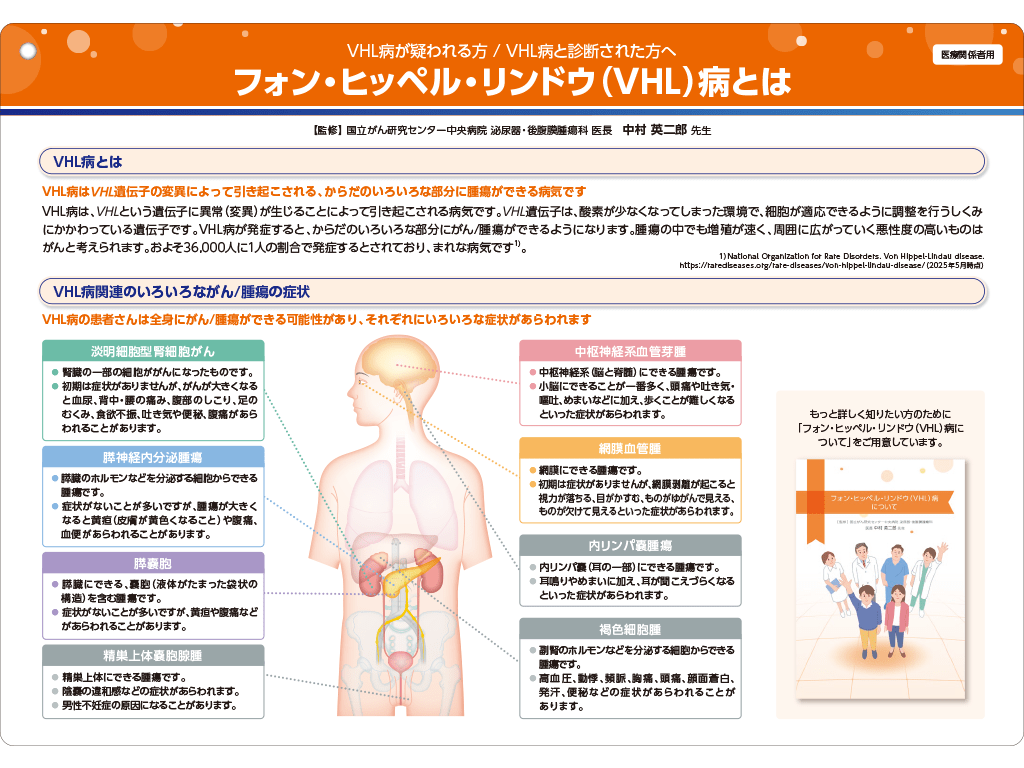
即時手術を必要としないVHL病関連腎細胞癌(RCC)患者を対象にウェリレグ®の有効性及び安全性を評価する。
【デザイン】
海外非盲検単群第Ⅱ相試験
[データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月)]
【対象】
1つ以上の測定可能な限局性RCC病変を有し、全身性抗がん療法歴がなく、即時手術を必要としないVHL病関連RCC患者61例(他のVHL病関連腫瘍を有する患者も含む)
【方法】
ウェリレグ®120mgを1日1回経口投与した。なお、副作用の管理を目的として、ウェリレグ®を1日1回80mg、その後40mgに減量することは可能とした。割り付け後3年間は12週ごと、その後は24週ごとに画像評価を実施した。すべての画像を中央画像判定機関(中央判定)に提出し、VHL病関連器官系[RCC、中枢神経系(CNS)血管芽腫、膵臓病変〔膵神経内分泌腫瘍(pNET)及び非pNET〕等]ごとに画像を評価した。また、網膜血管腫について中央判定の眼科医が眼底検査画像を評価した。疾患進行(PD)又は許容できない有害事象の発現等まで投与を継続した。
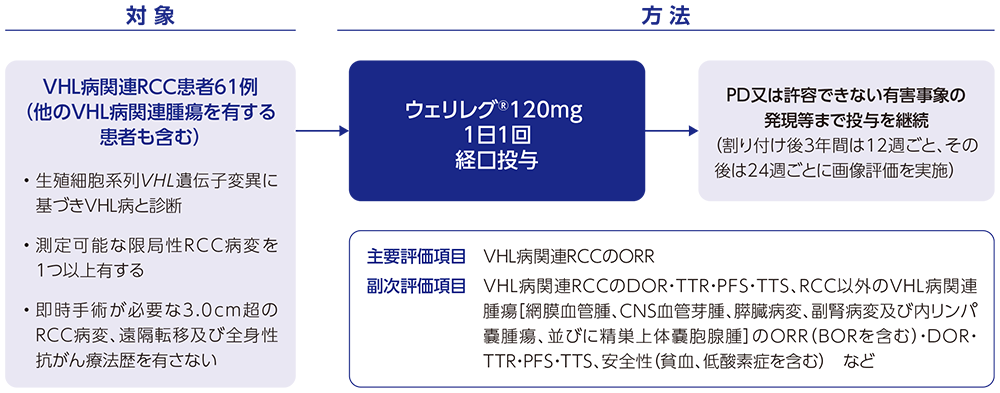
【評価項目】
主要評価項目:VHL病関連RCCの奏効率(objective response rate:ORR)
副次評価項目:VHL病関連RCCの奏効期間(duration of response:DOR)・奏効までの期間(time to response:TTR)・無増悪生存期間(progression-free survival:PFS)・手術までの期間(time to surgery:TTS)、RCC以外のVHL病関連腫瘍[網膜血管腫、CNS血管芽腫、膵臓病変(pNETの解析を含む)、副腎病変及び内リンパ嚢腫瘍、並びに精巣上体嚢胞腺腫]のORR[最良総合効果(best overall response:BOR)を含む]・DOR・TTR・PFS・TTS、安全性(貧血、低酸素症を含む)など
探索的評価項目:RCC及び/又は非RCC腫瘍に対して手術等を受けた患者数 など
【判定基準】
- VHL病関連RCC、CNS血管芽腫、膵臓病変、副腎病変及び内リンパ嚢腫瘍の奏効評価はRECISTガイドライン1.1版に基づき実施した。RCC、CNS血管芽腫、膵臓病変は独立判定委員会(Independent Review Committee:IRC)による中央判定、副腎病変及び内リンパ嚢腫瘍は治験担当医師判定により評価した。
- VHL病関連網膜血管腫の奏効評価は、IRCによる中央判定により実施した。
- VHL病関連精巣上体嚢胞腺腫の奏効評価は、超音波画像に基づき治験担当医師判定により実施した。
【解析計画】
解析対象集団:有効性及び安全性の解析はAPaT集団※を対象として実施した。
有効性評価の統計手法:ORRの95%信頼区間(95%CI)は、Clopper-Pearsonによる二項分布に基づく正確法で算出した。DOR、PFS及びTTSについてはKaplan-Meier法を用いて推定した。また、投与開始前に2回以上の画像評価を実施したVHL病関連RCC腫瘍患者における腫瘍の線形成長速度(linear growth rate:LGR)を評価した。投与前後の患者レベルの標的腫瘍のLGRについて、時間を連続変数、個々の腫瘍をカテゴリー変数として含めた線形回帰モデルを用いて算出した。
※ APaT(all participants as treated)集団:治験薬が1回以上投与されたすべての患者
患者背景
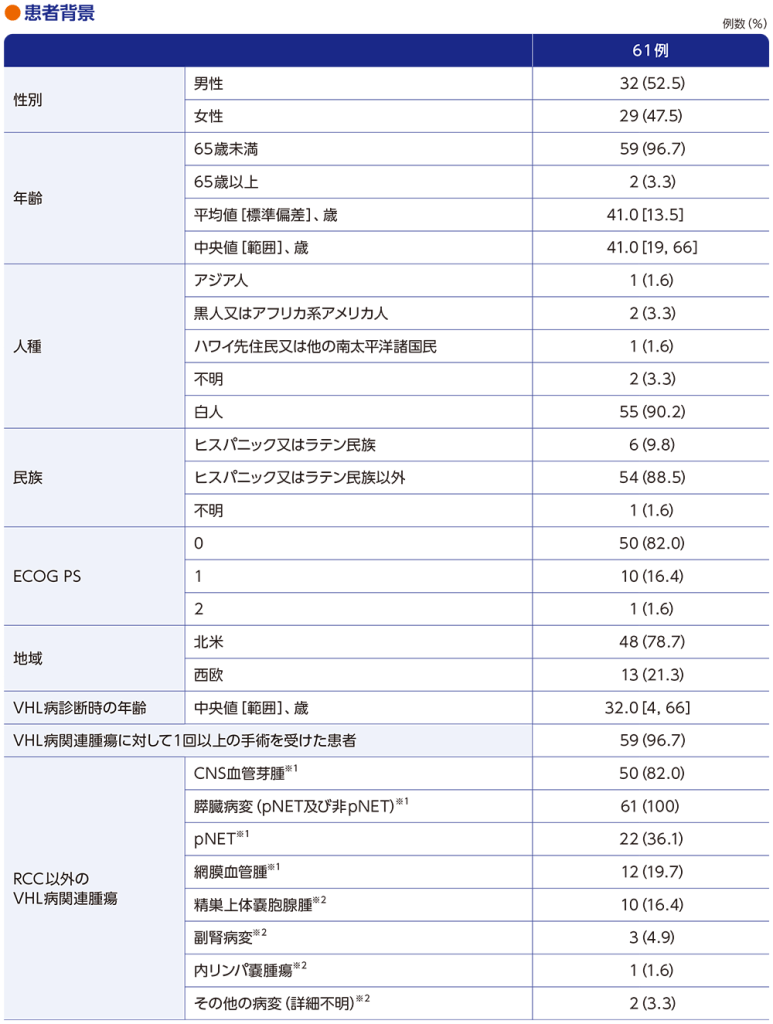
※1 中央判定
※2 治験担当医師判定
主要評価項目:VHL病関連RCCの奏効率(ORR)
VHL病関連RCC患者61例におけるORRは63.9%[95%CI:50.6, 75.8]でした。
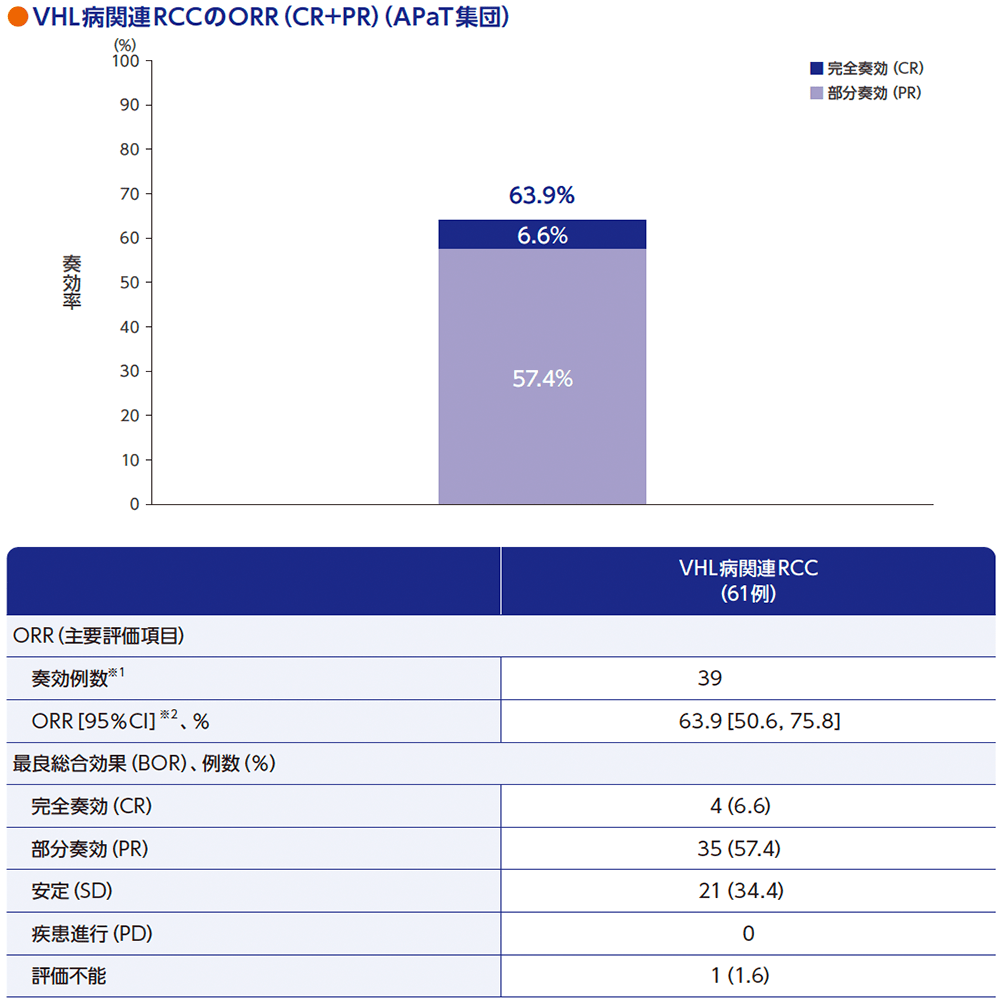
RECISTガイドライン1.1版に基づく中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
VHL病関連RCCの腫瘍径のベースラインからの変化率
標的病変の縮小は56例(91.8%)に認められました。
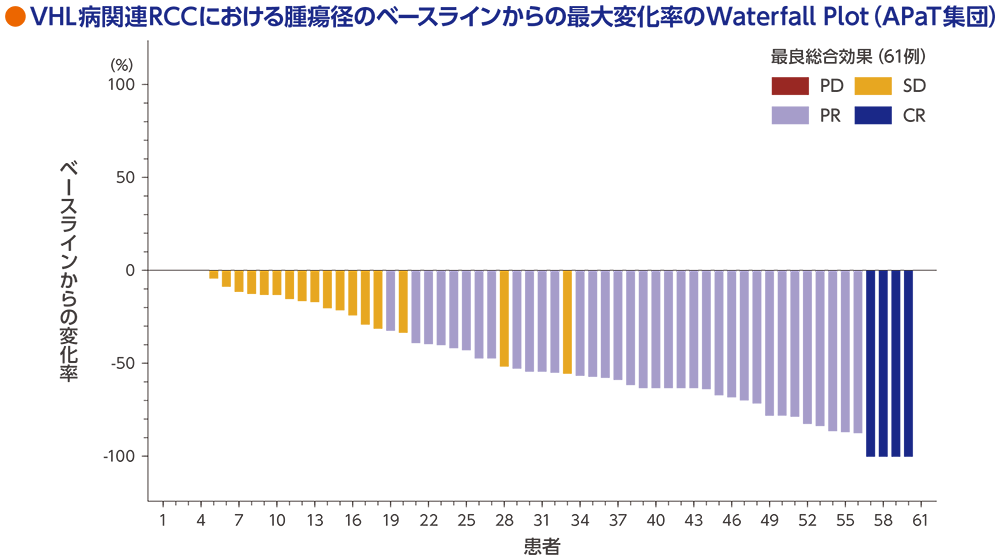
RECISTガイドライン1.1版に基づく中央判定による評価
ベースライン後の評価可能な病変の測定値又は標的病変のない患者、又はベースライン後のすべての時点で評価不能の患者は、図の右側に空白で表示した
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月 [範囲:4.2, 46.1ヵ月] )
腫瘍のLinear growth rate(LGR)中央値は、投与開始前で3.52mm/年[範囲:-3.06, 33.10]、投与開始後で-2.95mm/年[範囲:-7.64, 10.08]でした。
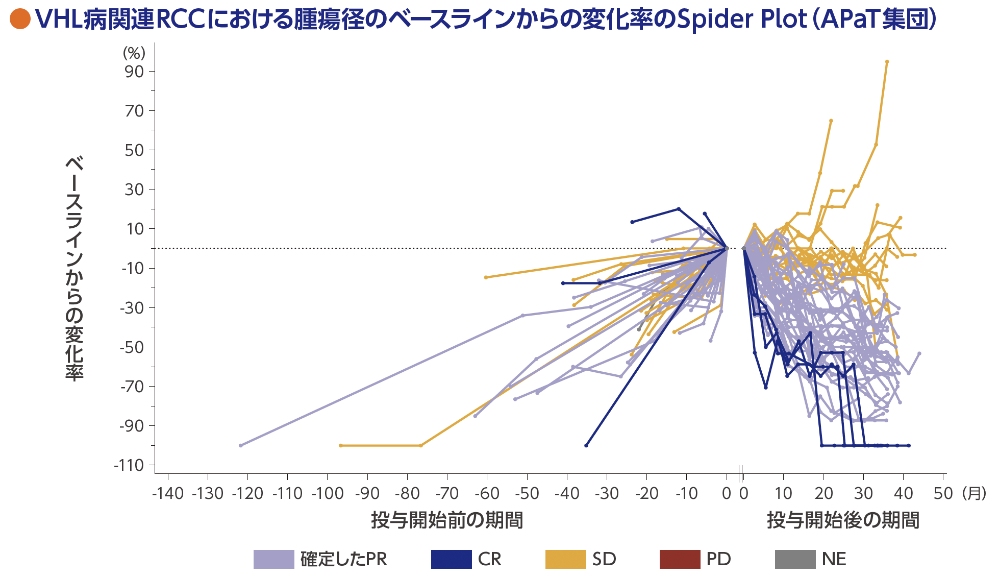
RECISTガイドライン1.1版に基づく中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月 [範囲:4.2, 46.1ヵ月] )
副次評価項目:VHL病関連RCCの奏効期間(DOR)・奏効までの期間(TTR)・無増悪生存期間(PFS)・手術までの期間(TTS)
- 奏効例39例におけるDOR中央値は未到達[範囲:5.4+, 35.8+ヵ月]でした。また、TTR中央値は11.1ヵ月[範囲:2.7, 30.5ヵ月]でした。
- PFS中央値は39.2ヵ月[95%CI:38.5, NE]でした。
- TTS中央値は未到達でした。なお、投与期間中における腎部分切除術は3例、腎凍結療法は1例であり、追跡期間中における腎部分切除術は3例でした。
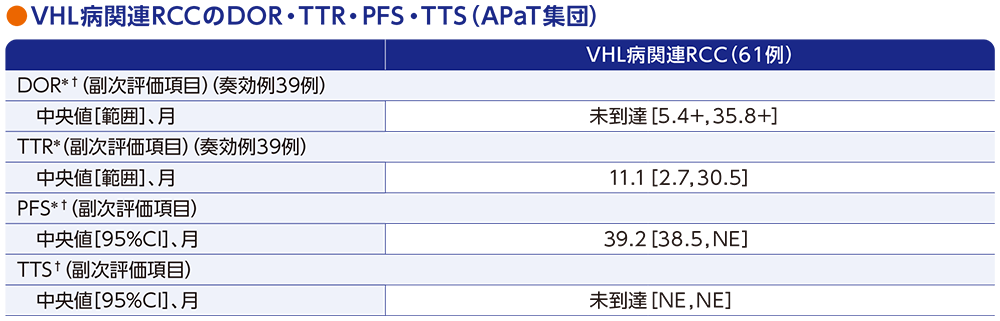
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
* RECISTガイドライン1.1版に基づく中央判定による評価
† Kaplan-Meier法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す
NE:Not Estimated
VHL病関連RCCの治療継続期間及び奏効評価
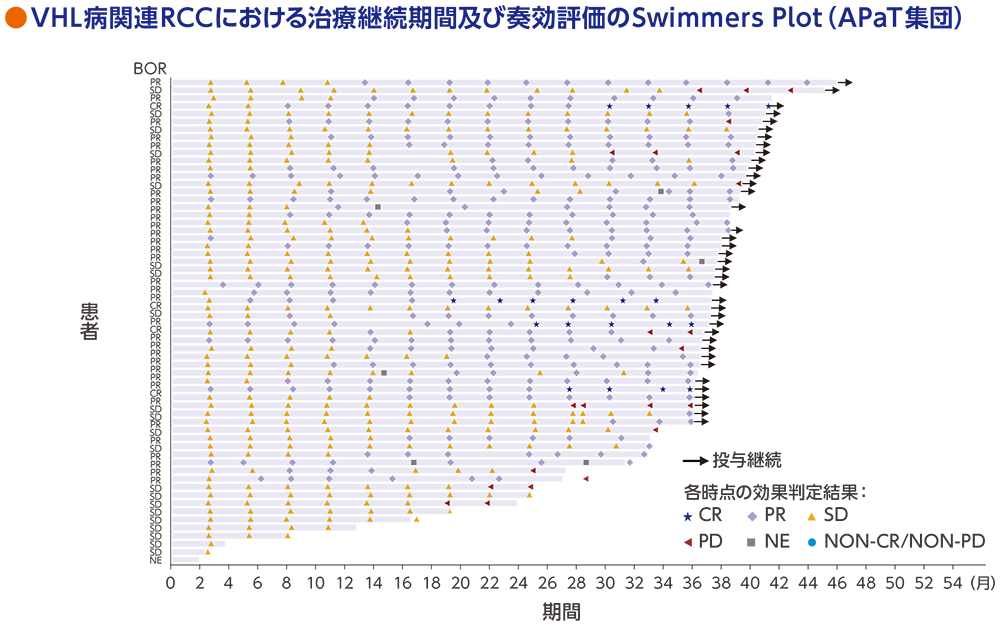
RECISTガイドライン1.1版に基づく中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
副次評価項目:VHL病関連CNS血管芽腫の奏効率(ORR)
VHL病関連CNS血管芽腫患者50例におけるORRは44.0%[95%CI:30.0, 58.7]でした。
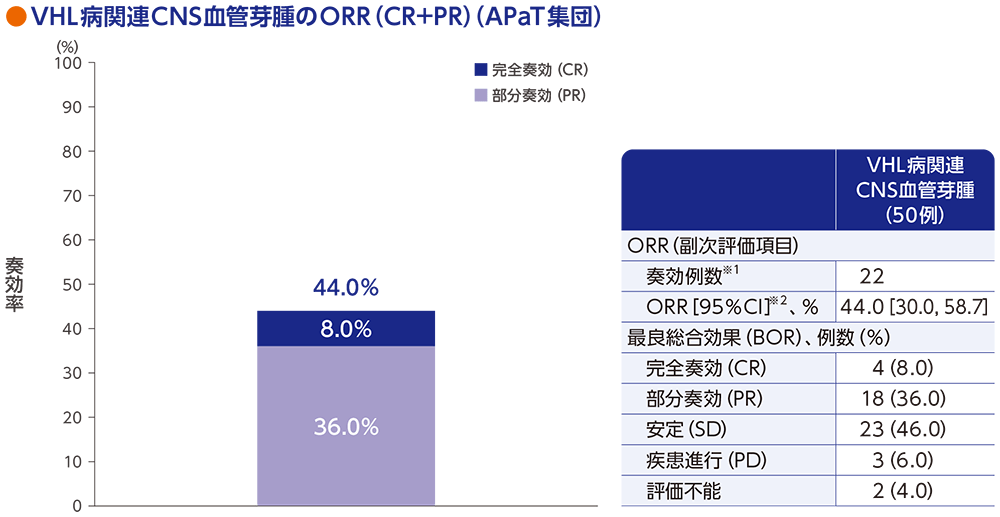
RECISTガイドライン1.1版に基づく中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
副次評価項目:VHL病関連CNS血管芽腫の奏効期間(DOR)・奏効までの期間(TTR)・無増悪生存期間(PFS)・手術までの期間(TTS)
- 奏効例22例におけるDOR中央値は未到達[範囲:3.7+, 38.7+ヵ月]でした。また、TTR中央値は5.4ヵ月[範囲:2.3, 33.1ヵ月]でした。
- PFS中央値は未到達でした。
- TTS中央値は未到達でした。なお、投与期間中において、1例が同一病変に対して2回の手術を受けました。
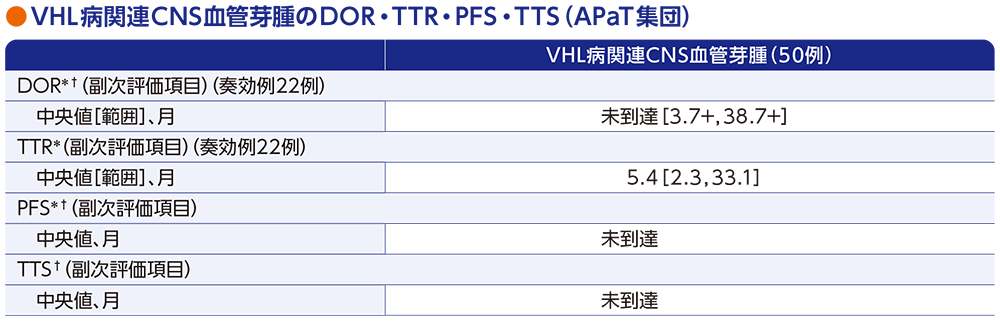
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
* RECISTガイドライン1.1版に基づく中央判定による評価
† Kaplan-Meier法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す
副次評価項目:VHL病関連膵臓病変(pNET及び非pNET)の奏効率(ORR)
VHL病関連膵臓病変患者61例におけるORRは83.6%[95%CI:71.9, 91.8]でした。
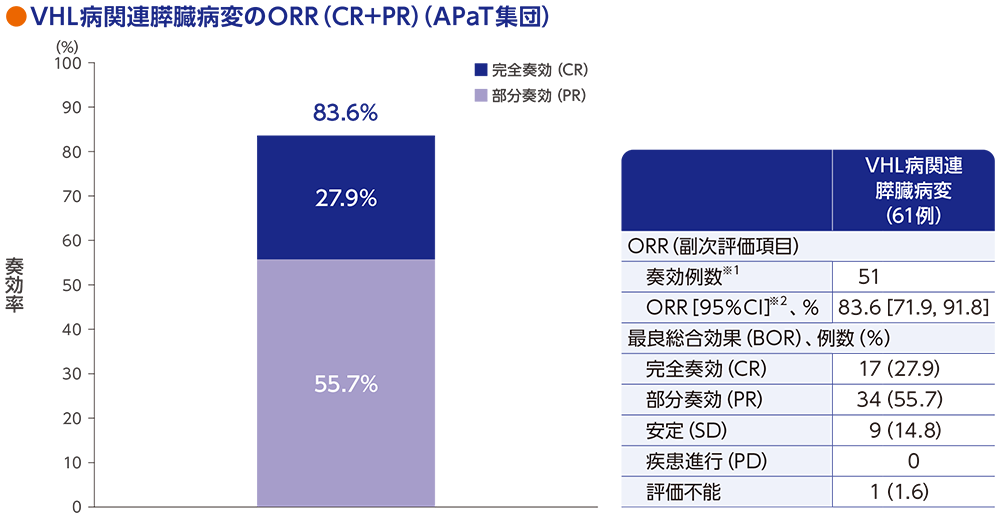
RECISTガイドライン1.1版に基づく中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
副次評価項目:VHL病関連膵臓病変(pNET及び非pNET)の奏効期間(DOR)・奏効までの期間(TTR)・無増悪生存期間(PFS)・手術までの期間(TTS)
- 奏効例51例におけるDOR中央値は未到達[範囲:2.6+, 37.3+ヵ月]でした。また、TTR中央値は8.3ヵ月[範囲:2.5, 32.9ヵ月]でした。
- PFS中央値は未到達でした。
- 投与期間中において、膵臓病変に対し、手術が実施された患者はいませんでした。
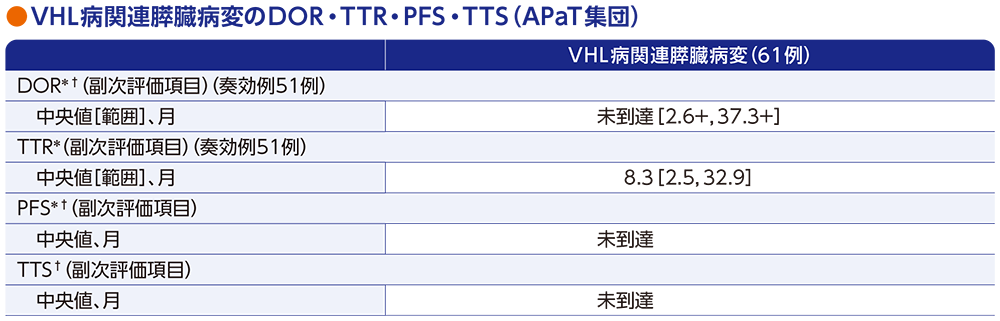
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
* RECISTガイドライン1.1版に基づく中央判定による評価
† Kaplan-Meier法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す
副次評価項目:VHL病関連膵神経内分泌腫瘍(pNET)の奏効率(ORR)
VHL病関連pNET患者22例におけるORRは90.9%[95%CI:70.8, 98.9]でした。
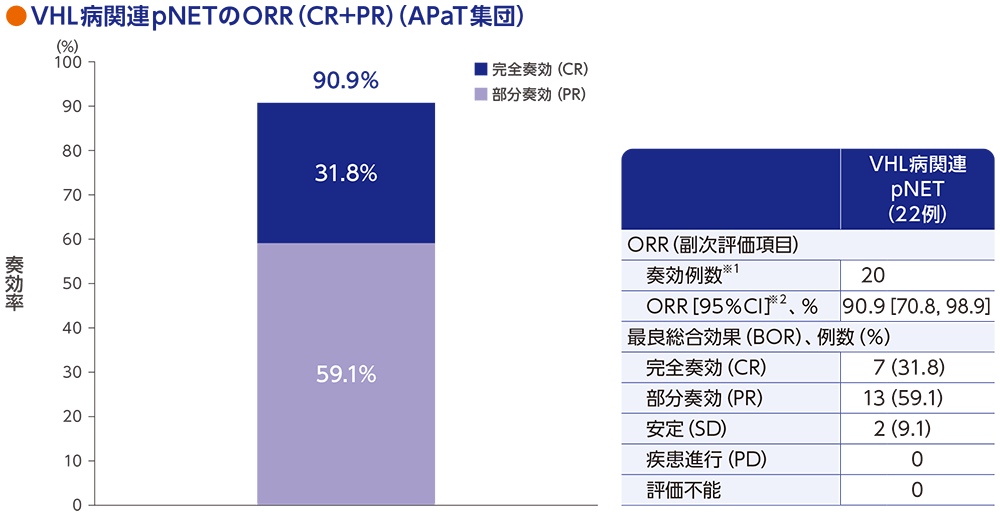
RECISTガイドライン1.1版に基づく中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
※1 CR又はPRが認められた患者数
※2 Clopper and Pearson法に基づく
副次評価項目:VHL病関連pNETの奏効期間(DOR)・奏効までの期間(TTR)・無増悪生存期間(PFS)・手術までの期間(TTS)
- 奏効例20例におけるDOR中央値は未到達[範囲:11.0+, 37.3+ヵ月]でした。また、TTR中央値は8.2ヵ月[範囲:2.5, 16.4ヵ月]でした。
- PFS中央値は未到達でした。
- 投与期間中において、pNETに対し、手術が実施された患者はいませんでした。
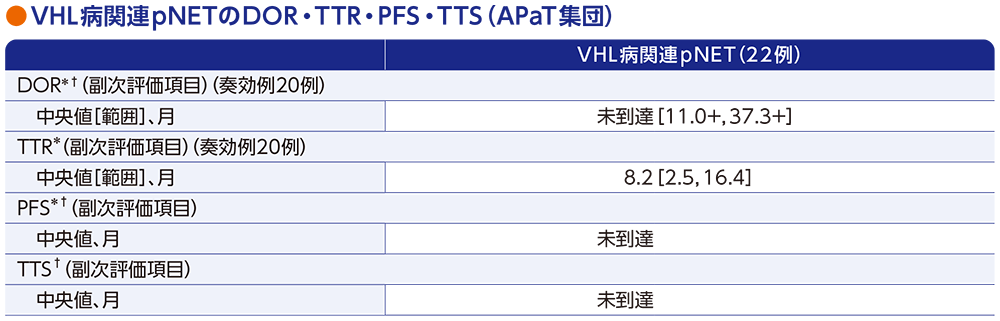
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
* RECISTガイドライン1.1版に基づく中央判定による評価
† Kaplan-Meier法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す
副次評価項目:VHL病関連網膜血管腫の最良総合効果(BOR)
VHL病関連網膜血管腫患者12例において、中央判定による眼底検査画像の追跡評価が可能でした。改善は全例[95%CI:73.5,100]に認められました。
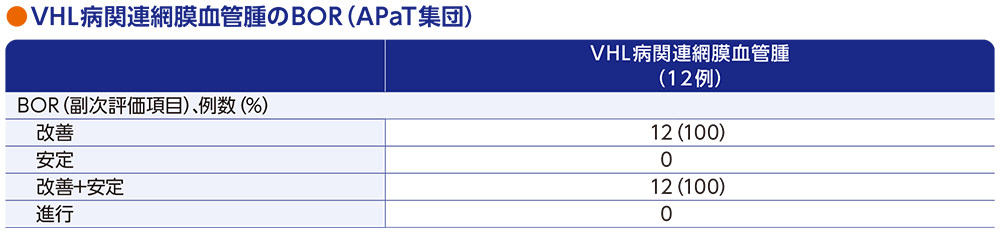
中央判定による評価
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
網膜血管腫の奏効評価方法は下表のとおりとしました。2眼球を評価する患者での効果は、1眼球が改善した場合は改善(もう1つの眼球が進行していない場合)、1眼球が進行の場合は進行(もう1つの眼球の評価結果にかかわらず)、2眼球が安定の場合は安定としました。

Wiley HE et al. Ophthalmology 2024; 131: 1324-1332
Reprinted from Ophthalmology, 131, Wiley HE, et al, Oral Hypoxia-Inducible Factor 2a Inhibitor Belzutifan in Ocular von Hippel-Lindau Disease, 1324-1332, Copyright 2024, with permission from Elsevier.
本試験はMSD社の資⾦提供により⾏われた。Eric JonaschはMSD社の相談役である。また、著者のうち、Wei Fu、Rodolfo F. Perini、Yanfang Liuは同社の社員である。その他の著者に資⾦援助などを受けている者が含まれる。

副次評価項目:VHL病関連網膜血管腫の奏効期間(DOR)・奏効までの期間(TTR)・手術までの期間(TTS)
- 奏効例12例におけるDOR中央値は未到達[範囲:14.3+, 33.3+ヵ月]でした。また、TTR中央値は2.7ヵ月[範囲:2.5, 8.3ヵ月]でした。
- 投与期間中において、網膜血管腫に対し、眼関連の手術を必要とした患者はいませんでした。
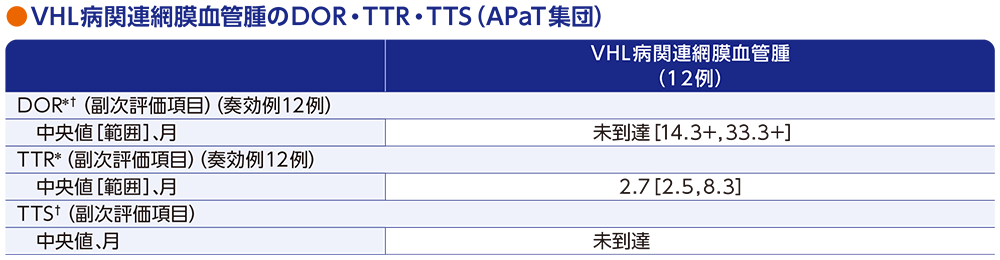
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
* 中央判定による評価
† Kaplan-Meier法に基づく
「+」は最後の疾患評価までPDがみられなかったことを示す
副次評価項目:VHL病関連の副腎病変及び内リンパ嚢腫瘍の最良総合効果(BOR)
BOR(治験担当医師判定)は副腎病変(3例)及び内リンパ嚢腫瘍(1例)のいずれも安定(SD)でした。
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
副次評価項目:VHL病関連精巣上体嚢胞腺腫の効果判定結果
精巣上体嚢胞腺腫患者(10例)で認められた16病変のうち10病変が133週時に治験担当医師判定による超音波画像の追跡評価が可能でした。効果判定結果(治験担当医師判定)は10病変中、改善が4病変、安定(SD)が6病変でした。
データカットオフ日:2022年4月1日(追跡期間中央値37.7ヵ月[範囲:4.2, 46.1ヵ月])
探索的評価項目:RCC及び/又は非RCC腫瘍に対して手術等を受けた患者数
投与期間中又は追跡期間中に、61例中9例がVHL病関連の手術等(計11件)を受けました。9例において、投与期間中に1回以上の手術等を受けた患者は7例であり、その内訳は腎部分切除術3例及び腎凍結療法1例(RCC)、同一病変に対する嚢胞ドレナージ及び血管腫切除術1例(CNS血管芽腫)、レーザー光凝固術2例(網膜血管腫)でした。また、追跡期間中に腎部分切除術(RCC)を受けた患者は3例でした[うち1例は投与期間中にレーザー光凝固術(網膜血管腫)も実施]。
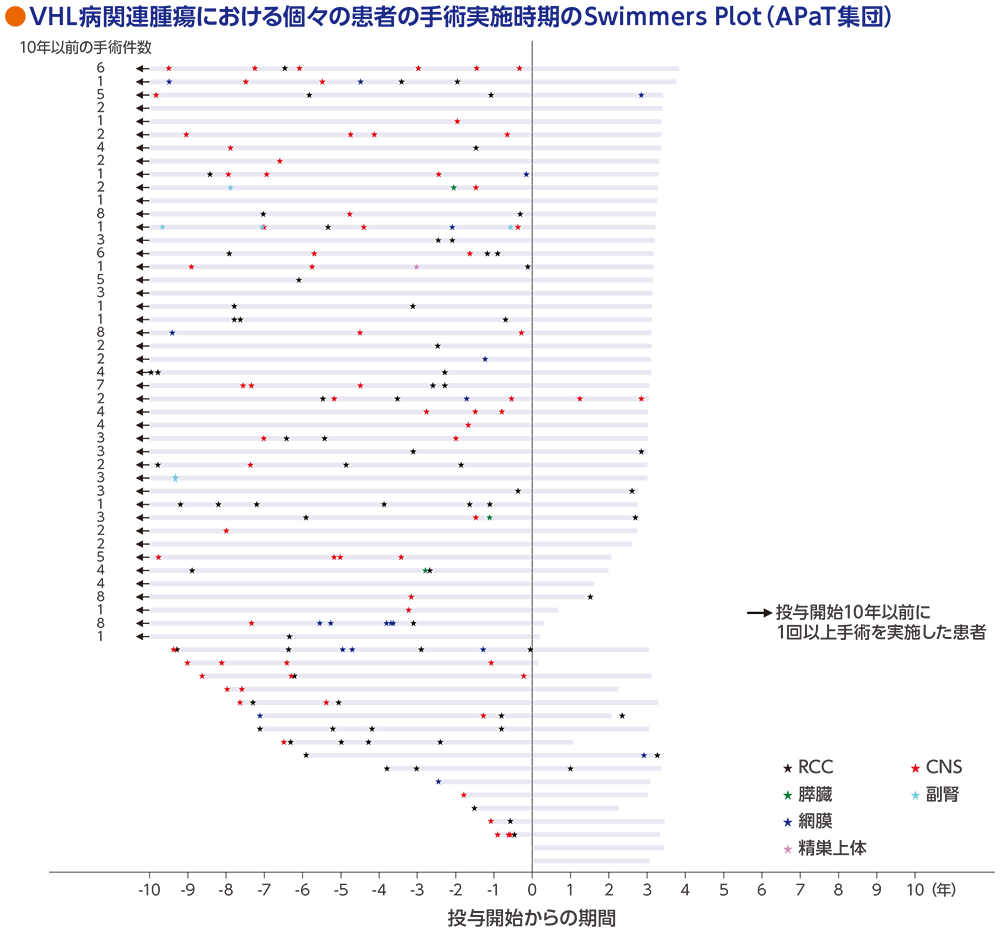
⼿術は放射線療法を除く腫瘍縮⼩術と定義した
データカットオフ⽇:2022年4⽉1⽇(追跡期間中央値37.7ヵ⽉[範囲:4.2, 46.1ヵ⽉])
安全性:副作用
副作用は61例全例(100%)に認められました。主な副作用(発現率20%以上)は貧血54例(88.5%)、疲労39例(63.9%)、悪心及び浮動性めまい 各15例(24.6%)でした。重篤な副作用は4例(6.6%)に認められ、その内訳は貧血、尿路感染、頭蓋内出血及び低酸素症 各1例(1.6%)でした。副作用による投与中止は2例(3.3%)に認められ、その内訳は浮動性めまい及び頭蓋内出血の各1例(1.6%)でした。また、副作⽤による減量・休薬はそれぞれ8例(13.1%)、13例(21.3%)に認められ、減量に至った主な副作用(発現例数2例以上)は疲労5例(8.2%)、貧血2例(3.3%)であり、休薬に至った主な副作用(発現例数2例以上)は疲労7例(11.5%)、悪心4例(6.6%)、頭痛及び貧血 各2例(3.3%)でした。本試験において、副作用による死亡は認められませんでした。
MedDRA/J version 25.0
(データカットオフ⽇:2022年4⽉1⽇)
■主な副作用(APaT集団)
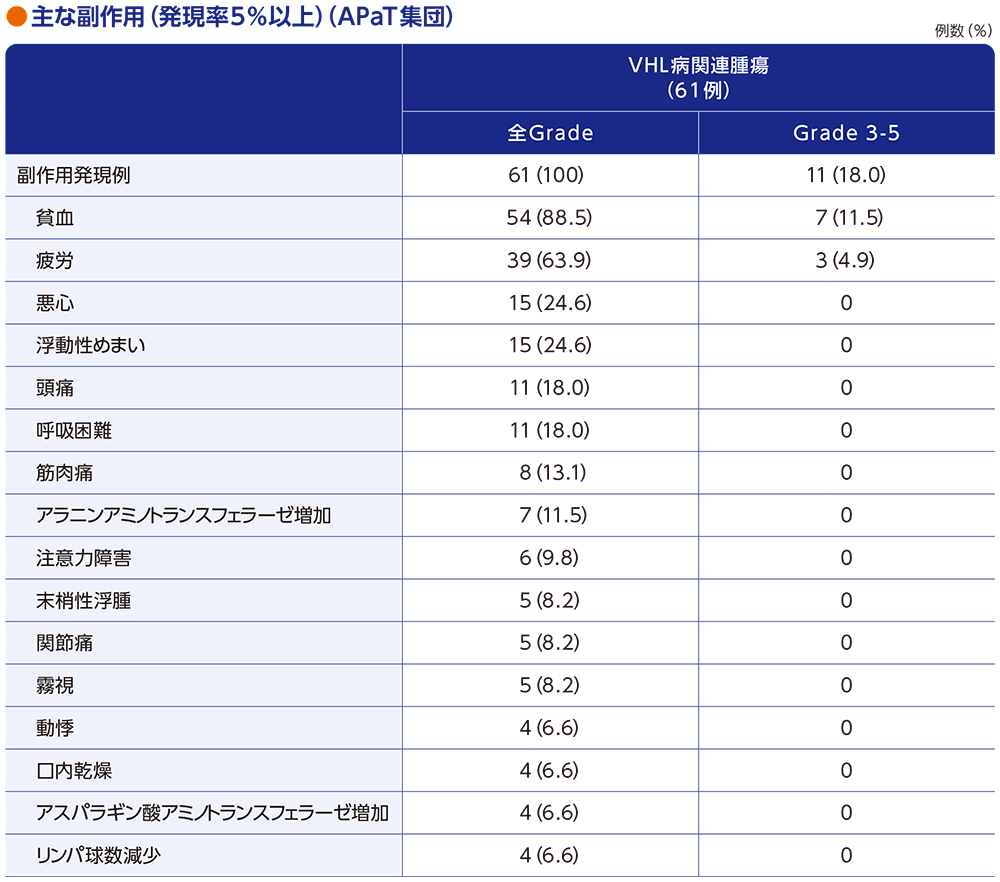
MedDRA/J version 25.0、Grade はCTCAE version 4.03
(データカットオフ⽇:2022年4⽉1⽇)
■注意を要する有害事象(APaT集団)
MedDRA/J version 25.0、GradeはCTCAE version 4.03
(データカットオフ日:2022年4月1日)
※1 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。データ解析時点で有害事象が未回復の場合、又は有害事象が未回復のまま死亡した場合、データカットオフ日又は死亡日のいずれか早い方で打ち切りとした
※2 ESA(erythropoiesis-stimulating agents):赤血球造血刺激因子製剤
「+」は有害事象がデータカットオフ日又は死亡日までに回復/治癒しなかったことを示す
MedDRA/J version 25.0、GradeはCTCAE version 4.03
(データカットオフ日:2022年4月1日)
※1 80mg1日1回投与への減量
※2 打ち切りデータはproduct-limit(Kaplan-Meier)法に基づく。データ解析時点で有害事象が未回復の場合、又は有害事象が未回復のまま死亡した場合、データカットオフ日又は死亡日のいずれか早い方で打ち切りとした
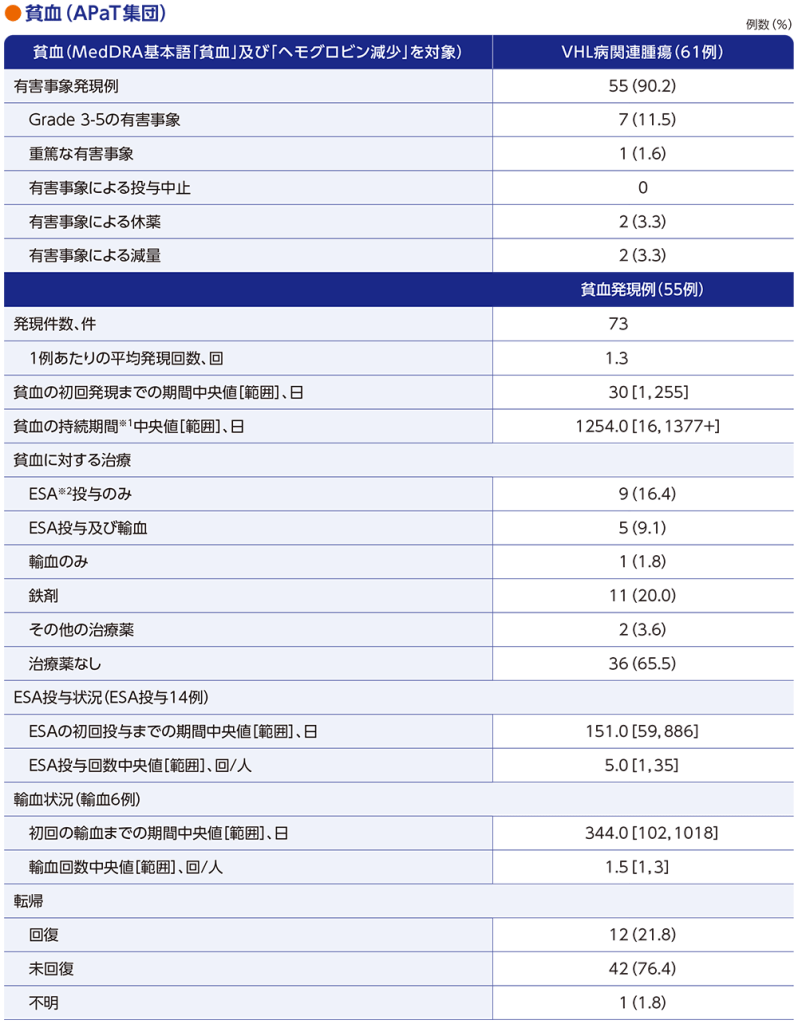
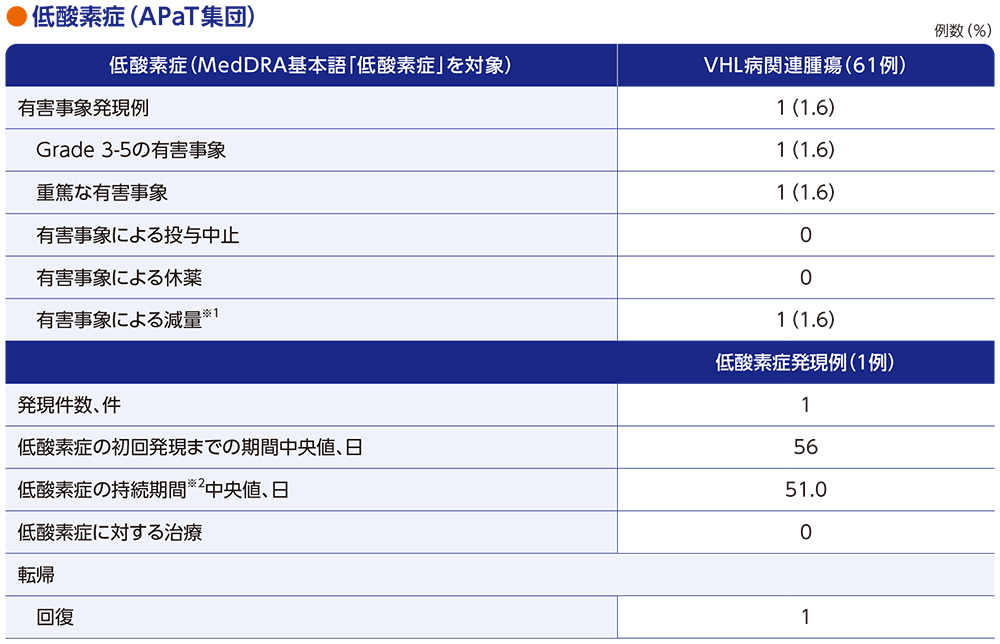
ウェリレグ®投与に伴う貧血の発現機序
通常時(正常な酸素環境/正常なVHL蛋白質機能)1)
通常時では、HIF-2αにVHL蛋白質が結合し、HIF-2αは分解されます。

低酸素環境/VHL蛋白質機能喪失:赤血球生成の増加1)
低酸素環境下、又はVHL遺伝子変異等*によるVHL蛋白質の機能が喪失している場合には、HIF-2αは分解を免れ、HIF-1βとのヘテロ二量体を形成します。HIF-2α-HIF-1βヘテロ二量体は、赤血球生成を制御する遺伝子など、様々な下流遺伝子の発現を誘導します。特にエリスロポエチン(EPO)産生には重要な役割を果たしており、HIF-2α-HIF-1βヘテロ二量体形成によりEPO遺伝子転写が誘導され、赤血球生成が増加します。
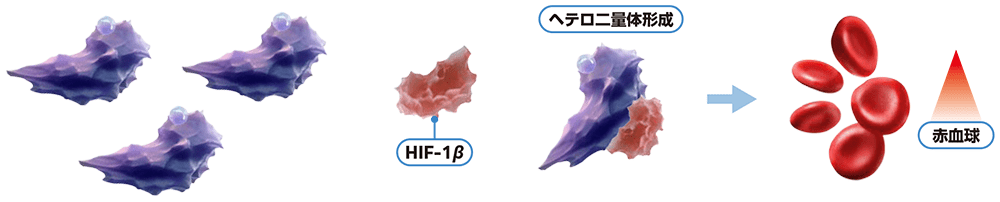
*エピジェネティックなサイレンシングを有することがあるため、VHL遺伝子に変異が認められない場合があります2)。
ウェリレグ®投与時:赤血球生成の減少1,3,4)
ウェリレグ®は、選択的HIF-2α阻害剤です。ウェリレグ®投与によりHIF-2α-HIF-1βヘテロ二量体形成が阻害されることによりEPO遺伝子転写が抑制され、赤血球生成が減少する可能性があります。

1)Kaelin Jr WG. J Clin Oncol 2018; 36: 908-910
著者はPeloton Therapeutics社(現MSD)から資金援助等を受けている。
2)Nguyen MP et al. Arch Pharm Res 2013; 36: 252-263
3)ウェリレグ®電子添文
4)社内資料:HIF-2αの選択的阻害
関連コンテンツ

フォン・ヒッペル・リンドウ病関連腫瘍の治療における新規作用機序 HIF-2α 阻害剤ウェリレグ®―LITESPARK-004試験―
本動画では、VHL病の病態及びウェリレグ®の作用機序に加えて、VHL病におけるウェリレグ®のエビデンスである「LITESPARK-004試験」の結果について、わ […]
