薬物動態
薬物動態
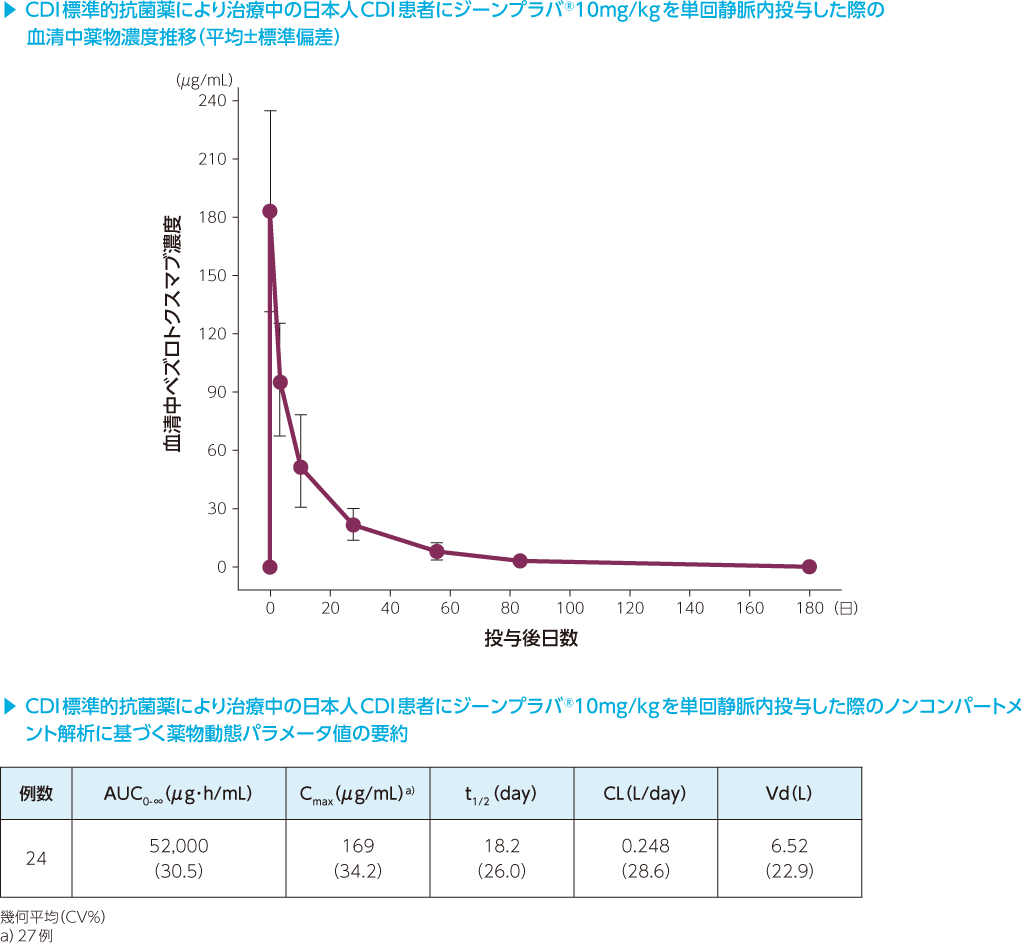
1. 血清中濃度 6)
血清中濃度推移
第Ⅲ相試験(002試験)において、日本人のCDI患者にジーンプラバ®10mg/kgを単回静脈内投与した際の血清中ベズロトクスマブ濃度推移及び薬物動態パラメータを以下に示しました。ベズロトクスマブの血清中半減期は18.2日でした。
2. 分布 6)
日本人CDI患者(24例)を対象に、ジーンプラバ®10mg/kgを単回静脈内投与したときの分布容積は6.52L(幾何平均)でした。
3. 代謝
ベズロトクスマブは一般的なタンパク分解プロセスによって異化されることから、ベズロトクスマブのクリアランスにCYPに代表される代謝酵素は寄与しません。ICH S6(R1)のガイダンス「バイオテクノロジー応用医薬品の非臨床における安全性評価」に基づき、ベズロトクスマブについて従来の代謝試験は実施していません。
4. 排泄 6)
ベズロトクスマブはタンパク製剤であるため、腎排泄又は胆汁排泄を受けないと考えられます。ICH S6(R1)のガイダンス「バイオテクノロジー応用医薬品の非臨床における安全性評価」に基づき、ベズロトクスマブについて従来の排泄試験は実施していません。
日本人CDI患者(24例)を対象に、ジーンプラバ®10mg/kgを単回静脈内投与したときのクリアランスは0.248L/日(幾何平均)でした。
5. 特殊集団
1)高齢者(日本人及び外国人データ)7)
年齢がベズロトクスマブの薬物動態パラメータに及ぼす影響を第Ⅲ相試験のCDI患者のデータを用いて母集団薬物動態解析により検討した結果、高齢患者(65歳以上)では非高齢患者(65歳未満)に比べてAUC0-∞(幾何平均)が13%低下し、後期高齢患者(75歳以上)では非後期高齢患者(75歳未満)に比べてAUC0-∞(幾何平均)が12%低下しましたが、いずれもベズロトクスマブの曝露量の変動許容範囲(0.6~1.6)に含まれました。このことから、年齢による用量調整は必要ありません。
2)腎機能障害(日本人及び外国人データ)8)
腎機能障害がベズロトクスマブの曝露量に及ぼす影響を、第Ⅲ相試験のCDI患者のデータを用いて母集団薬物動態解析により検討した結果、腎機能正常患者と比較してAUC0-∞(幾何平均)が、軽度腎機能障害患者(eGFR:60~90未満)で19%上昇、中等度腎機能障害患者(eGFR:30~60未満)で5%上昇、重度腎機能障害患者(eGFR:15~30未満)で5%低下、末期腎不全患者(eGFR:15未満)で16%低下しましたが、いずれもベズロトクスマブの曝露量の変動許容範囲(0.6~1.6)に含まれました。このことから、腎機能による用量調整は必要ありません。
3)肝機能障害(日本人及び外国人データ)9)
肝機能障害がベズロトクスマブの曝露量に及ぼす影響を、第Ⅲ相試験のCDI患者のデータを用いて母集団薬物動態解析により検討した結果、肝機能正常患者と比較して肝機能障害患者*ではAUC0-∞(幾何平均)が28%低下しましたが、ベズロトクスマブの曝露量の変動許容範囲(0.6~1.6)に含まれました。このこと及び抗体薬のクリアランスにCYPなどの肝代謝酵素が関与しないことから、肝機能による用量調整は必要ありません。
*ベースライン時に下記の4項目のうち2項目以上に該当する被験者を肝機能障害ありと定義
(1)アルブミン値:3.1g/dL以下
(2)アラニンアミノトランスフェラーゼ(ALT):基準値上限の2倍以上
(3)ビリルビン値:基準値上限の1.3倍以上
(4)重症度を問わずCharlson併存疾患指数により報告されている肝疾患あり
6)社内資料(薬物動態試験)
7)社内資料(臨床薬理試験 年齢)
8)社内資料(臨床薬理試験 腎機能障害)
9)社内資料(臨床薬理試験 肝機能障害)