PD-L1検査の臨床的意義
「警告・禁忌」等その他の項目はこちらをご参照ください。
本剤は、一部承認外の効能又は効果、用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。そのため、国内で承認されている効能又は効果、用法及び用量と異なる海外データも紹介しています。
PD-L1検査の臨床的意義
はじめに
監修:
国立がん研究センター中央病院 病理診断科 科長
谷田部 恭 先生
関西医科大学 病理学講座 教授
蔦 幸治 先生
近年、さまざまな分子標的治療薬が臨床応用されており、それに伴い治療の適否における病理診断の重要性はますます高まっています。肺癌領域においても、EGFR遺伝子変異、ALK融合遺伝子などを指標にした個別化医療が日常的に行われています。そんな中、2016年12月にキイトルーダ®が「PD-L1陽性の切除不能な進行・再発の非小細胞肺癌」*を効能又は効果として承認されました。
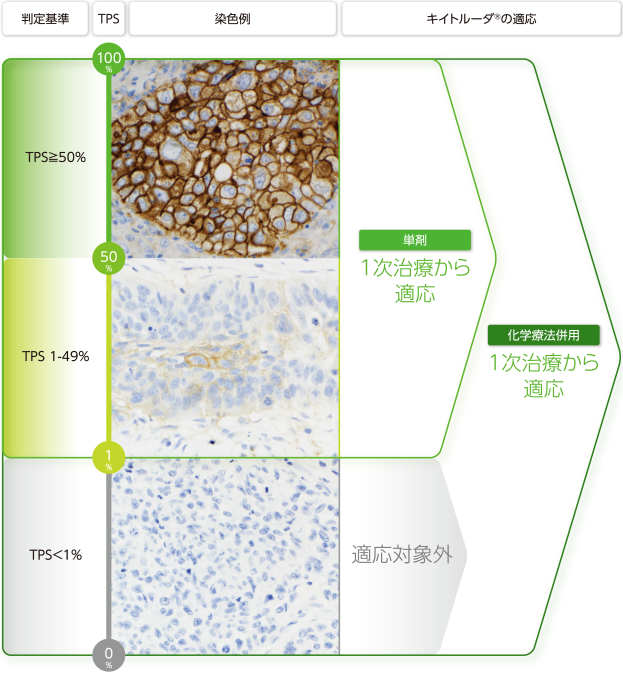
キイトルーダ®の非小細胞肺癌への適応は、コンパニオン診断薬であるPD-L1 IHC 22C3 pharmDx「ダコ」におけるTPS(Tumor Proportion Score)に依存しています。キイトルーダ®単剤の1次治療からの適応にはTPS≧1%が必要となります。これらの根拠は、国際共同試験であるKEYNOTE-024試験、KEYNOTE-042試験、KEYNOTE-010試験であり、1次治療および2次治療以降におけるキイトルーダ®の有用性が確認されています。
コンパニオン診断薬を用いた免疫組織染色であっても、検体の固定・包埋・薄切・染色などの条件により、施設間では差異がみられることが考えられます。そのような差異を限りなく減らしていくことが、 1つの課題であるのかと思います。また、PD-L1検査のタイミングも重要であり、PD-L1の発現はEGFR遺伝子変異陽性や、ALK融合遺伝子陽性と排他的でないことから、これらの遺伝子検査と同時にPD-L1検査を実施する必要性もあると考えられます。
*2018年12月に「切除不能な進行・再発の非小細胞肺癌」の効能又は効果の一部変更の承認を取得しました。
非小細胞肺癌に対する適応状況
キイトルーダ®の効能又は効果は「切除不能な進行・再発の非小細胞肺癌」です。
キイトルーダ®のTPS別にみた適応状況
PD-L1検査の有用性
● 効果予測因子になる
PD-L1陽性がキイトルーダ®の効果予測因子になり得ます1,2,9-16)。
このことから、キイトルーダ®単剤の対象となる患者を同定することができます。
● 治療選択に役立つ
PD-L1の発現率を確認することにより、治療選択ができ、キイトルーダ®の適正使用に役立ちます。
PD-L1検査の対象
切除不能な進行・再発の非小細胞肺癌患者(腺癌、扁平上皮癌およびその他組織型を含む)の腫瘍組織。
PD-L1検査のタイミング
PD-L1検査は、EGFR遺伝子検査やALK融合遺伝子検査と同時に、1次治療開始前に実施できます。
キイトルーダ®は、単剤であればPD-L1陽性(TPS≧1%)、キイトルーダ®+化学療法併用であればPD-L1発現状況に関わらず、1次治療および2次治療以降で使用可能です[KEYNOTE-010、024、189、407、042]3-16)。
キイトルーダ®の臨床試験におけるPD-L1のTPS別の分布は、TPS≧50%群、1-49%群、<1%群いずれも20~40%の範囲内でした[KEYNOTE-001、010、024、189、407、042]1-16)。
キイトルーダ®の臨床試験におけるPD-L1のTPS別の分布
PD-L1の発現は、EGFR遺伝子変異およびALK融合遺伝子変異と排他的ではありません[KEYNOTE-010試験]14,15)。
■海外第Ⅰ相試験〈KEYNOTE-001試験:パートC+F〉(海外データ)1,2)の概要
■化学療法未治療患者を対象とした化学療法併用試験[国際共同第Ⅲ相試験〈KEYNOTE-189試験〉]3-5)の概要
■化学療法既治療患者を対象とした化学療法併用試験[国際共同第Ⅲ相試験〈KEYNOTE-407試験〉]6-8)の概要
■化学療法未治療患者を対象とした単剤試験[国際共同第Ⅲ相試験〈KEYNOTE-024試験〉]9-11)の概要
■化学療法未治療患者を対象とした単剤試験[国際共同第Ⅲ相試験〈KEYNOTE-042試験〉]12,13)の概要
■化学療法既治療患者を対象とした試験[国際共同第Ⅱ/Ⅲ相試験〈KEYNOTE-010試験〉]14,15)の概要
引用文献
1)承認時評価資料:海外第Ⅰ相試験 パートC+F(KEYNOTE-001試験)
2)Garon EB et al. N Engl J Med 2015; 372: 2018-2028(本試験はMSD社の資金提供により実施された)
3)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-189試験)
4)Gandhi L et al. N Engl J Med 2018; 378: 2078-2092(本試験はMSD社の資金提供により実施された)
5)Gandhi L et al. N Engl J Med 2018; 378: 2078-2092 Supplementary Data(Protocol)
6)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-407試験)
7)Paz-Ares L et al. N Engl J Med 2018; 379: 2040-2051(本試験はMSD社の資金提供により実施された)
8)Paz-Ares L et al. N Engl J Med 2018; 379: 2040-2051 Supplementary Data(Protocol)
9)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-024試験)
10)Reck M et al. N Engl J Med 2016; 375: 1823-1833(本試験はMSD社の資金提供により実施された)
11)Reck M et al. N Engl J Med 2016; 375: 1823-1833 Supplementary Data(Protocol)
12)承認時評価資料:国際共同第Ⅲ相試験(KEYNOTE-042試験)
13)Mok TSK et al. Lancet 2019; 393: 1819-1830(本試験はMSD社の資金提供により実施された)
14)承認時評価資料:国際共同第Ⅱ/Ⅲ相試験(KEYNOTE-010試験)
15)Herbst RS et al. Lancet 2016; 387: 1540-1550(本試験はMSD社の資金提供により実施された)
16)Brahmer JR et al. Lancet Oncol 2017; 18: 1600-1609(本試験はMSD社の資金提供により実施された)
