効能又は効果、用法及び用量
効能又は効果、用法及び用量
4. 効能又は効果
○悪性黒色腫
○切除不能な進行・再発の非小細胞肺癌
○再発又は難治性の古典的ホジキンリンパ腫
○がん化学療法後に増悪した根治切除不能な尿路上皮癌
○がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形癌(標準的な治療が困難な場合に限る)注)
○根治切除不能又は転移性の腎細胞癌
○腎細胞癌における術後補助療法
○再発又は遠隔転移を有する頭頸部癌
○根治切除不能な進行・再発の食道癌
○治癒切除不能な進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する結腸・直腸癌
○PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌
○ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法
○がん化学療法後に増悪した切除不能な進行・再発の子宮体癌
○がん化学療法後に増悪した高い腫瘍遺伝子変異量(TMB-High)を有する進行・再発の固形癌(標準的な治療が困難な場合に限る)
○進行又は再発の子宮頸癌
○再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫
注)条件付き早期承認対象
5. 効能又は効果に関連する注意
<悪性黒色腫>
5.1 臨床試験に組み入れられた患者の病期等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.4、17.1.5参照]
<切除不能な進行・再発の非小細胞肺癌>
5.2 本剤の術後補助療法における有効性及び安全性は確立していない。
5.3 本剤を単独で投与する場合には、PD-L1の発現が確認された患者に投与すること。PD-L1を発現した腫瘍細胞が占める割合(TPS)について、「17. 臨床成績」の項の内容を熟知すること。十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
[17.1.8-17.1.10参照]
5.4 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.6、17.1.8-17.1.10参照]
<再発又は難治性の古典的ホジキンリンパ腫>
5.5 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.11、17.1.12参照]
<がん化学療法後に増悪した根治切除不能な尿路上皮癌>
5.6 本剤の一次治療における有効性及び安全性は確立していない。
5.7 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.13参照]
5.8 本剤の手術の補助療法としての有効性及び安全性は確立していない。
<がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)>
5.9 十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された進行・再発の固形癌患者に投与すること。検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるMSI検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.10 結腸・直腸癌以外の固形癌の場合、本剤の一次治療における有効性及び安全性は確立していない。
また、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.11 本剤の手術の補助療法における有効性及び安全性は確立していない。
5.12 臨床試験に組み入れられた患者のがん種等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.14、17.1.15参照]
<腎細胞癌における術後補助療法>
5.13 臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.18参照]
<再発又は遠隔転移を有する頭頸部癌>
5.14 本剤の術後補助療法における有効性及び安全性は確立していない。
5.15 本剤単独投与の延命効果は、PD-L1発現率(CPS)により異なる傾向が示唆されている。CPSについて、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.19参照]
5.16 「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.19参照]
<根治切除不能な進行・再発の食道癌>
5.17 がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対して、本剤を単独で投与する場合には、PD-L1発現率(CPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
[17.1.21参照]
5.18 本剤の手術の補助療法における有効性及び安全性は確立していない。
<治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌>
5.19 十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.20 本剤の術後補助療法における有効性及び安全性は確立していない。
<PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌>
5.21 PD-L1発現率(CPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
[17.1.23参照]
<ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法>
5.22 臨床試験に組み入れられた患者の再発高リスクの定義等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.24参照]
<がん化学療法後に増悪した切除不能な進行・再発の子宮体癌>
5.23 本剤の一次治療における有効性及び安全性は確立していない。
5.24 本剤の術後補助療法における有効性及び安全性は確立していない。
5.25 「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.25参照]
<がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)>
5.26 十分な経験を有する病理医又は検査施設における検査により、TMB-Highが確認された患者に投与すること。検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるTMB検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
5.27 本剤の一次治療における有効性及び安全性は確立していない。また、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.28 本剤の手術の補助療法における有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者のがん種等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。[17.1.26参照]
<進行又は再発の子宮頸癌>
5.30 本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。CPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.27参照]
5.31 本剤の術後補助療法における有効性及び安全性は確立していない。
<再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫>
5.32 臨床試験に組み入れられた患者の前治療歴等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.28、17.1.29参照]
6. 用法及び用量
<悪性黒色腫>
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、術後補助療法の場合は、投与期間は12ヵ月間までとする。
<切除不能な進行・再発の非小細胞肺癌、再発又は難治性の古典的ホジキンリンパ腫、がん化学療法後に増悪した根治切除不能な尿路上皮癌、がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)、再発又は遠隔転移を有する頭頸部癌、治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌、がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)、再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫>
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
<根治切除不能又は転移性の腎細胞癌、PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌、進行又は再発の子宮頸癌>
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
<腎細胞癌における術後補助療法>
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与期間は12ヵ月間までとする。
<根治切除不能な進行・再発の食道癌>
フルオロウラシル及びシスプラチンとの併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対しては、本剤を単独投与することもできる。
<ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法>
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与回数は、3週間間隔投与の場合、術前薬物療法は8回まで、術後薬物療法は9回まで、6週間間隔投与の場合、術前薬物療法は4回まで、術後薬物療法は5回までとする。
<がん化学療法後に増悪した切除不能な進行・再発の子宮体癌>
レンバチニブメシル酸塩との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
7. 用法及び用量に関連する注意
<切除不能な進行・再発の非小細胞肺癌>
7.1 本剤を他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し選択すること。[17.1.6、17.1.7参照]
<再発又は遠隔転移を有する頭頸部癌>
7.2 本剤の用法及び用量は「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、選択すること。[17.1.19参照]
<根治切除不能又は転移性の腎細胞癌>
7.3 併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し選択すること。[17.1.16、17.1.17参照]
<PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌>
7.4 併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し選択すること。[17.1.23参照]
<ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法>
7.5 本剤の用法及び併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し選択すること。[17.1.24参照]
<進行又は再発の子宮頸癌>
7.6 併用する他の抗悪性腫瘍剤は「17. 臨床成績」の項の内容を熟知し選択すること。[17.1.27参照]
<悪性黒色腫、再発又は難治性の古典的ホジキンリンパ腫、がん化学療法後に増悪した根治切除不能な尿路上皮癌、がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)、腎細胞癌における術後補助療法、治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌、がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)、再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫>
7.7 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
<効能共通>
7.8 本剤投与により副作用が発現した場合には、下表を参考に、本剤を休薬又は中止すること。
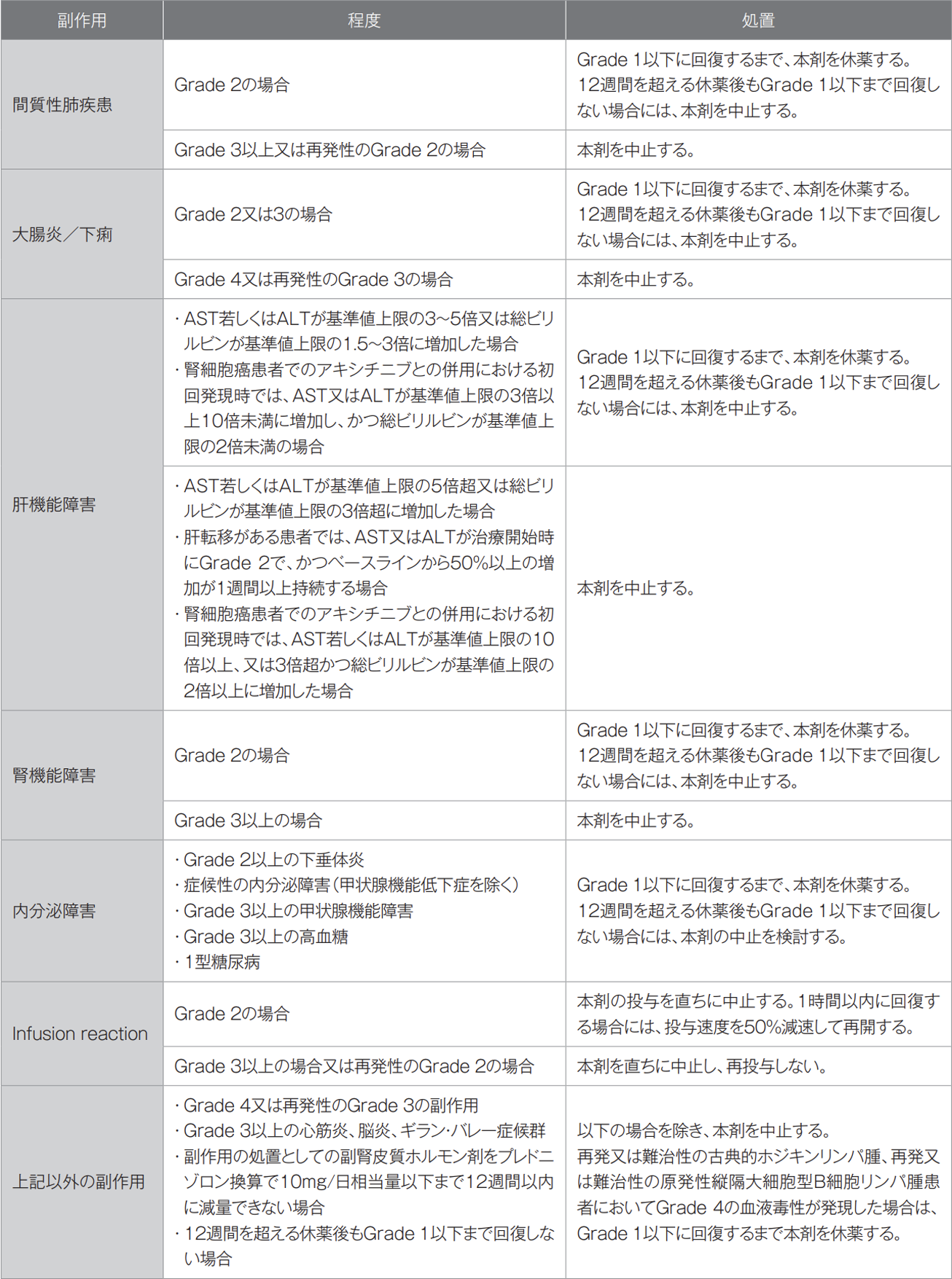
GradeはNCI-CTCAE(Common Terminology Criteria for Adverse Events)v4.0に準じる。
(2024年1月改訂(第17版))