STARTMRK試験
STARTMRK試験
抗HIV治療未経験患者を対象にしたエファビレンツ(EFV)対照第Ⅲ相試験(STARTMRK試験)(非劣性試験)(海外データ)1)~3)
[目 的]
対象患者におけるアイセントレス®(400mg 1日2回)とEFVの有効性と安全性を評価する。
[試験デザイン]
多施設共同、無作為化、二重盲検、実薬対照非劣性検証試験
[対 象]
HIV感染患者で、HIV治療経験がなく、血漿中HIV RNA量が5,000copies/mL以上で、EFV、TDF、あるいはFTCに耐性のない18歳以上の563例
[方 法]
アイセントレス® 400mg1日2回投与群(281例)、EFV600mg1日1回投与群(282例)に無作為に割り付け、両群ともTDF+F TCを併用し、240週間投与した。無作為化にあたっては、スクリーニング時のHIV RNA量( ≦50,000copies/mL 又は>50,000copies/mL)及び肝炎ウイルスの重複感染状況によって層別割付を実施した。
[評価項目]
主要評価項目:48週における血漿中HIV RNA量<50copies/mLの患者の割合
240週までの各時点におけるHIV-RAN量<50copies/mLの患者の割合安全性評価
副次評価項目:48週におけるCD4リンパ球数のベースラインからの変化量
血漿中HIV RNA量<50copies/mLに到達するまでの期間 など
[解析計画]
48週又は240週時におけるHIV RNA 量<50copies/mLの患者割合の両群の群間差の95%信頼区間の下限値が-12%を上回る場合にEFV群に対するアイセントレス® 群の非劣性が、0%を上回る場合にはEFV投与群に対するアイセントレス® 投与群の優越性が検証されるとした。また、血漿中HIV RNA量<50copies/mLに到達するまでの時間のKaplan-Meier推定値を各群ごとに算出し、ログランク検定を行った。
主要評価項目において、ベースライン血漿中HIV RNA量、ベースラインのCD4陽性リンパ球数、患者背景(年齢、性別、地域、人種を含む)、ウイルス性肝炎( B型/C型肝炎)の重複感染の状態及びHIVサブタイプ( サブタイプB以外とサブタイプBグループとを比較)について、サブグループ解析を行った。
[有効性]
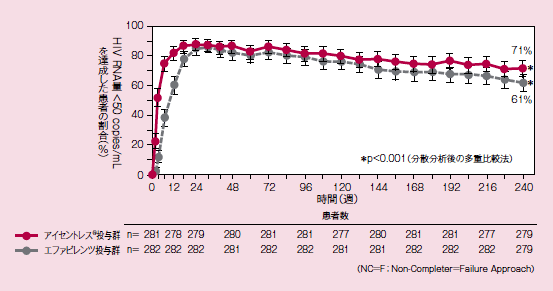
主要評価項目である48週における血漿中HIV RNA量<50copies/mLの患者の割合※は、アイセントレス®投与群86.1%、EFV投与群81.9%であり、両群の群間差の95%信頼区間の下限値が-12%を上回ったことから、EFV投与群に対するアイセントレス®投与群の非劣性が検証されました。※また、各時点における血漿中HIV RNA量<50copies/mLの患者の割合は図のように推移し、240週におけるHIV-RAN量<50copies/mLの患者の割合※は、アイセントレス®投与群71.0% 、EFV投与群61.3%であり、両群の群間差の95%信頼区間の下限値が0%を上回ったことから、EFV投与群に対するアイセントレス®投与群の優越性が検証されました。
一方、副次評価項目である48週におけるCD4陽性リンパ球数のベースラインからの平均変化量※は、アイセントレス®投与群で189.1cells/mm3 、EFV投与群では163.3cells/mm3でした。
また、HIV RNA量<50copies/mLに到達するまでの期間※は、アイセントレス®投与群がEFV投与群に比べ、有意に短いことが示されました(ログランク検定、p<0.0001)。
※いずれの評価項目においても、未完了例=失敗例として扱うObserved Failure法を採用した。
STARTMRK試験:投与群別の転帰(48及び240週時*)(主要/副次評価項目)
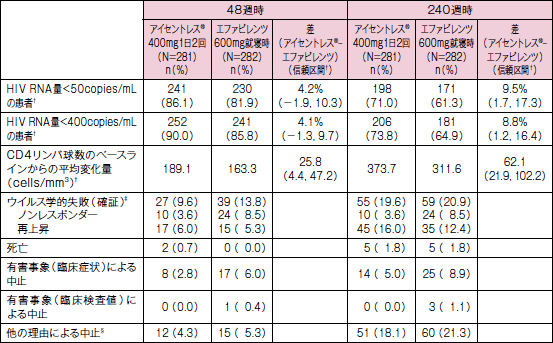
* 有効率の差[(アイセントレス®投与群)-(エファビレンツ投与群)]の95%信頼区間の下側下限が-12%を上回る場合にはエファビレンツ投与群に対するアイセントレス®投与群の非劣性が、0%を超える場合にはエファビレンツ投与群に対するアイセントレス®投与群の優越性が示されたと結論付けられる。
† 欠測値の取扱い方法:二者択一で評価を行う項目(患者割合の評価)については、未完了例=失敗例とした。ただし、規定した評価時点のデータが欠測であっても、その前後の来院ともHIV RNA量が<400copies/mL、又はHIV RNA量が<50copies/mLの場合は、当該欠測値を解析から除外した。CD4リンパ球数のベースラインからの変化量については、効果不十分のために割り付けられた治療を中止した患者では、ベースラインの値を評価値として扱うObserved Failure法を採用した(Observed Failure法:効果不十分による中止例=失敗例)。
‡ ウイルス学的失敗(a)治験薬投与の早期中止例では、中止時のHIV RNA量>50copies/mL、(b)24週時のHIV RNA量>50copies/mL、又はHIV RNA量がいったん<50copies/mLに到達後、>50copies/mLに再上昇した患者(1週間以上の間隔で2回連続的に行った測定において)をノンレスポンダーと定義した。
§ 追跡不能、同意の撤回、服薬不良、治験実施計画書からの逸脱、その他の理由を含む。
注:本剤及びエファビレンツは、エムトリシタビン+テノホビルと投与した。
n(%)=各部分集団の患者数
STARTMRK試験:血漿中HIV RNA量<50copies/mLを達成した患者の割合の推移(95%信頼区間)(NC=F法)(主要評価項目)
抗HIV治療未経験患者を対象にした複数の抗HIV薬による治療を行うSTARTMRK試験では、以下の背景因子及び予後因子のベースライン値にかかわらず、アイセントレス®+FTC+TDFの投与はウイルス学的抑制を示しました。:ベースライン血漿中HIV RNA量、ベースラインのCD4リンパ球数、患者背景(年齢、性別、地域、人種を含む)、ウイルス性肝炎(B型/C型肝炎)の重複感染の状態及びHIVサブタイプ(サブタイプB以外とサブタイプBグループとを比較)
アイセントレス® の有効性はすべてのHIVサブタイプにおいて認められ、サブタイプB及びサブタイプB以外の患者ではそれぞれ89.6%(155/173例)及び87.0%(40/46 例)が、240週時にHIV RNA量<50copies/mLに達しました(Observed Failure法)。
[安全性]
240週までの副作用発現率は、アイセントレス®投与群で52.0 % 、(146/281例)、EFV投与群で80.1%(226/282例)でした。主な副作用(発現率≧5%)は、表(STARTMRK試験:副作用発現例数(発現率≧5%)、18ページ)のとおりでした。
重篤な副作用は、アイセントレス®投与群で偶発的過量投与、貧血、精神障害、うつ病、乳癌および自殺企図が各1件、免疫再構築症候群が2件、EFV投与群7例で、大腿骨頸部骨折、胃腸障害、膵炎、エイズ関連カポジ肉腫、免疫再構築症候群およびニューモシスチス肺炎が各1件、精神障害が2件でした。試験薬の投与中止に至った副作用は、アイセントレス®投与群3例で不安が1件、記憶障害および精神障害が各2件、EFV投与群14例で倦怠感、下痢、薬疹、ジストニア、食欲減退、疼痛、統合失調感情障害、精神障害、骨減少症、うつ病、倦怠感、アレルギー性皮膚炎、斑状発疹および斑状丘疹が各1件、睡眠障害およびめまいが各2件でした。なお、試験期間中にアイセントレス®投与群とEFV投与群ともに5例の患者が死亡しましたが、いずれも薬剤との関連は認められませんでした。
STARTMRK試験:薬剤関連有害事象発現例数(発現率≧5%)
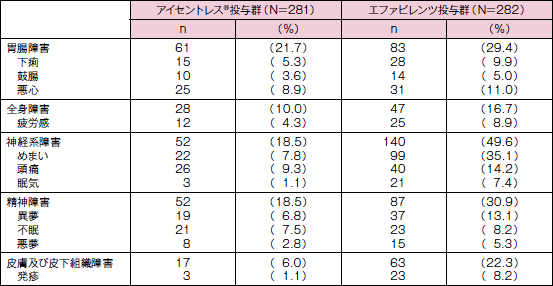
有害事象用語はMedDRA Version14.1に準拠して記載した。試験薬との関連について“疑いあり”、“可能性あり”、“確実”と評価され、各群で5%以上に報告された有害事象を一覧にした。1件以上の事象が認められた場合、臓器カテゴリーにおいて1回のみカウントした。異なるカテゴリーに同一症例が重複している可能性あり。
[脂質プロファイル](参考情報)
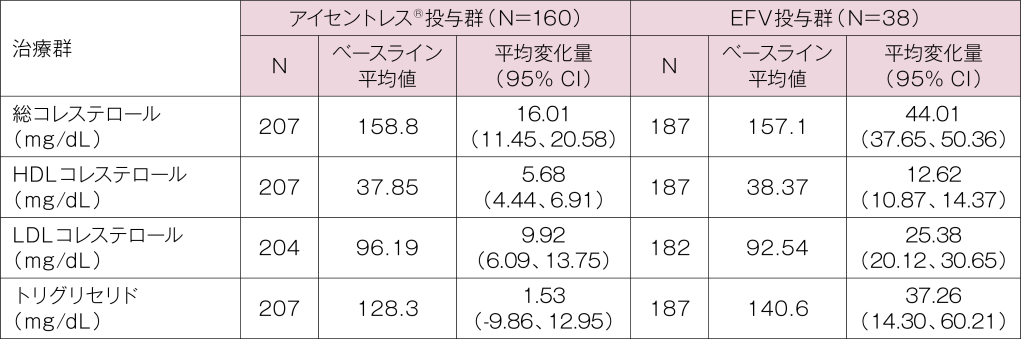
アイセントレス®投与群及びEFV投与群の240週時における総コレステロールのベースラインからの平均変化量はそれぞれ+16.01、+44.01mg/dLでした。同じくHDLコレステロールではそれぞれ+5.68、+12.64mg/dL、HDLコレステロールではそれぞれ+9.92、+25.38mg/dL、トリグリセリドではそれぞれ+1.53、+37.26mg/dLでした。
STARTMRK試験:各群の240週時におけるベースラインからの平均変化量
1)承認時評価資料(海外第Ⅲ相試験:STARTMRK)
2)Lennox JL, et al. Lancet 2009;374(9692):796-806.
(利益相反:Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.が本試験に資金提供。Lennox、DeJesus、Lazzarin、Madruga、BergerはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.の委託研究者で、Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.のコンサルタント、アドバイザーまたはスピーカー。PollardはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.の委託研究者。Zhao、Xu、Williiams-Diaz、Rodgers、Bamard、Miller、DiNubile、Nguyen、Leavitt、SklarはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.米国研究所員。)
3)Rockstroh JK, et al. J Acquir Immune Defic Syndr 2013;63(1):77-85.
(利益相反:Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.が本試験に資金提供。Rockstroh、DeJesus、Saag、Yazdanpanah、LennoxはMSD社の委託研究者でコンサルタント、スピーカー。YazdanpanahはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.から旅費を受領。Wan、Rodgers、Walker、Miller、DiNubile、Nguyen、Teppler、Leavitt、SklarはMerck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc., N.J., U.S.A.米国研究所員。)
「禁忌」等その他の項目は、添付文書をご参照ください。