ガーダシル®
臨床試験成績
HPV疾患予防効果①(子宮頸部疾患)
●海外第Ⅲ相臨床試験(015試験)の概要1)(海外データ)
| 【試験デザイン】 | 無作為化、二重盲検、プラセボ対照、多施設共同、国際共同、有効性試験(検証的) |
| 【対 象】 | 16~26歳の女性12,157例(1回以上接種人数):PPE(Per-Protocol Efficacy)解析対象集団※ |
| 【方 法】 | ガーダシル®またはプラセボを0、2、6ヵ月で3回筋肉内接種し、48ヵ月まで追跡し、有効性および安全性について検討した。 |
| 【解 析 計 画】 | 有効性および安全性は、PPE(Per-Protocol Efficacy)解析対象集団で検討した。予防効果(%)は、{1-(ガーダシル®群のイベント発生数/ガーダシル®群の追跡期間)/(プラセボ群のイベント発生数/プラセボ群の追跡期間)}×100によって算出した。また、ガーダシル®の予防効果の点推定値と多重性を調整した信頼区間を算出した。 ※:PPE(Per-Protocol Efficacy)解析対象集団:組み入れ1年以内にガーダシル®の3回接種をすべて受け、プロトコールから大きな逸脱がなく、評価項目に関連するHPVの型に対して初回接種前から3回接種の1ヵ月後(7ヵ月時)まで未感染であり、かつ初回接種前に血清抗体反応陰性であった被験者集団。 |
| 【主要評価項目】 | HPV16、18型に関連した CIN 1/2/3、AISまたは子宮頸がんの発生率(検証項目)および安全性 |
●海外第Ⅲ相臨床試験(015試験)におけるガーダシル®の予防効果1)(海外データ)
海外第Ⅲ相臨床試験(015試験)において、ガーダシル®群ではHPV16、18型関連の子宮頸部疾患の発生が2例認められました。ガーダシル®による予防効果は96.9%でした(表1)。
表1:海外第Ⅲ相臨床試験(015試験)におけるガーダシル®の予防効果【主要評価項目(検証項目)】
承認時評価資料
●海外第Ⅲ相臨床試験(015試験)における有害事象1)(海外データ)
副反応は、ガーダシル®群で6,075例中603例(10.0%)、プラセボ群で6,076例中536例(8.9%)に認められました。
注射部位の副反応は、ガーダシル®群で531例(8.8%)、プラセボ群で457例(7.6%)、注射部位以外の副反応は、ガーダシル®群で233例(3. 9%)、プラセボ群で221例(3. 7%)に認められました。
重篤な有害事象はガーダシル®群で3例に認められ、胃腸炎1例、頭痛および高血圧1例、注射部位疼痛および注射部位関節障害1例でした。試験中止に至った有害事象は、ガーダシル®群で5例に認められ、蕁麻疹1例、注射部位腫脹、浮動性めまいおよび注射部位紅斑1例、気管支刺激1例、手根管症候群1例、発疹1例でした。
死亡例はガーダシル®群で7例に認められましたが、いずれも治験担当医師により治験薬との因果関係が否定されました。
HPV疾患予防効果②(HPV6/11/16/18型に関連した性器周辺部病変)
一部承認外の成績が含まれるデータを含めて承認されたため、紹介するデータには承認外の効能又は効果が含まれます。
●海外第Ⅲ相臨床試験(020試験)の概要1)
| 【試験デザイン】 | 無作為化、プラセボ対照、多施設共同、二重盲検試験(検証的) |
| 【対 象】 | 16〜26歳の男性4,065例 |
| 【方 法】 | ガーダシル®またはプラセボを0、2、6ヵ月の3回筋肉内接種し、検討した。 |
| 【評 価 項 目】 | 主要評価項目:●有効性:HPV6/11/16/18型に関連した性器周辺部病変※1の発生率(検証項目) ●安全性:有害事象 副次評価項目:●HPV6/11/16/18型に関連した持続感染※2の発生率(検証項目) MSM※3サブスタディの評価項目: ●HPV6/11/16/18型に関連した肛門疾患の発生率 |
| 【解 析 計 画】 | ●有効性の主要な解析はPer-Protocol Efficacy(PPE)解析対象集団で実施した。PPE解析対象集団は、3回の治験薬接種を1年以内にすべて受け、有効性の評価に影響を与えるような治験実施計画書からの逸脱がなく、3回目の接種(初回接種から6ヵ月時)の接種後14~72日以内に採取されたスワブ検体での7ヵ月時のPCR結果があり、該当する各HPV型に対して、1日目に血清抗体反応陰性かつ1日目から7ヵ月までPCR陰性を示した被験者で構成された。 ●予防効果=(1-(ガーダシル®群のイベント発生数/ガーダシル®群の追跡期間)/(プラセボ群のイベント発生数/プラセボ群の追跡期間))×100(%) ●ワクチンの予防効果が20%以下であるという帰無仮説に対する片側検定(α = 2.5%)を用いて、主要および副次評価項目の仮説を検証した。副次仮説は主要仮説が成立した場合のみ検証した。主要仮説の検証では予防効果(VE)の点推定値および95%信頼区間を計算し、副次仮説の検証では、VEの点推定値および多重性を調整した信頼区間またはP値を計算した。 ●MSMサブスタディの有効性解析は、肛門疾患のイベント数が17件以上となった時点で実施した。MSMサブスタディではVEが0%以下であるという帰無仮説に対する片側検定(α = 2.45%)を用いて、MSMの評価項目の仮説を検証した。MSMサブスタディでは、VEの点推定値および95.1%信頼区間を計算した。 ●安全性は1回以上の治験薬接種を受け、接種後のデータが存在する被験者を安全性解析集団とした。接種後1~5日目の1%以上の割合で発現した注射部位の有害事象、接種後1~15日目の1%以上の割合で発現した注射部位以外の有害事象を要約した。各評価項目における群間差の点推定値および95%信頼区間を計算し、特定の注射部位の有害事象(疼痛、紅斑および腫脹)の発現割合の群間差の有意差検定を行った。また全治験期間中の死亡、重篤な副作用および新たな医学的事象を要約した。 |
※1:性器周辺病変は、1つの生検検体または切除した組織において次の両方の条件に該当する場合にイベントと定義した。1)病理審査委員会の合意により、尖圭コンジローマ、PI Nまたは陰茎、肛門周囲もしくは会陰のがんと診断された。および2)同じ組織片の隣接切片において、HPV6/11/16/18型の少なくとも1つが検出された。
※2:規定した来院間隔は6ヵ月であるが、各来院の許容範囲を±1ヵ月設けた。そのため検体採取の間隔は少なくとも4ヵ月以上となるが、6ヵ月以上の持続感染として取り扱った。
※3:men who have sex with men(男性と性交渉を行う男性)
●海外第Ⅲ相臨床試験(020試験)におけるガーダシル®の予防効果1)
(主要評価項目ほか)
主要評価項目においては、HPV6/11/16/18型に関連した性器周辺部病変の発生率に対するガーダシル®の予防効果は90.6%でした。性器周辺部病変の内訳は、尖圭コンジローマに対する予防効果は89.3%、PIN1/2/3に対する予防効果は100%でした。
また、 HPV6/11/16/18型に関連した持続感染の発生率に対する予防効果は、85.5%でした。
MSMサブスタディにおけるHPV6/11/16/18型に関連した肛門疾患の発生率に対する予防効果は、77.5%でした。
表2:海外第Ⅲ相臨床試験(020試験)におけるガーダシル®の予防効果
承認時評価資料
●海外第Ⅲ相臨床試験(020試験)における有害事象1)
接種後5日間の注射部位の副反応※はガーダシル®群で1,945例中1,166例(59.9%)、プラセボ群で1,950例中1,046例(53.6%)に認められました。主なものはガーダシル®群で疼痛1,113例(57.2%)、紅斑304例(15.6%)、腫脹219例(11.3%)、そう痒感22例(1.1%)、プラセボ群で疼痛991例(50.8%)、紅斑275例(14.1%)、腫脹187例(9.6%)、そう痒感23例(1.2%)でした。
接種後15日間の全身性の副反応はガーダシル®群で1,945例中274例(14.1%)に、プラセボ群で1,950例中284例(14.6%)に認められました。主なものはガーダシル®群で発熱93例(4.8%)および頭痛107例(5.5%)、プラセボ群で発熱98例(5.0%)および頭痛119例(6.1%)でした。
薬剤との関連性が否定されない死亡例はいずれの群においても認められませんでした。
接種後15日間の重篤な有害事象はガーダシル®群で5例6件(虫垂炎、非心臓性胸痛、蜂巣炎、過敏症、痙攣、水痘)、プラセボ群で1例(挫傷)に認められましたが、いずれも治験担当医師により、治験薬との因果関係が否定されました。
中止に至った副反応はガーダシル®群で2例6件(頭痛、倦怠感、筋肉痛、発熱、嘔吐、悪心)、プラセボ群で3例8件(浮動性めまい、呼吸困難、頭痛、疼痛、発熱、蕁麻疹、ウイルス感染、全身性そう痒症)に認められました。
※:治験担当医師により治験薬との因果関係が否定できないと判断された有害事象(いずれかの接種群で発現率1%以上)
海外長期フォローアップ試験(子宮頸部疾患)
●ガーダシル®長期フォローアップ試験(14年)の概要(海外データ)2)
| 【試験デザイン】 | 海外第Ⅲ相臨床試験(FUTURE Ⅱ:015試験)の延長試験 |
| 【対 象】 | 16〜26歳の女性を対象としたFUTURE Ⅱ試験(015試験)12,167例のうち、北欧地区(デンマーク、アイスランド、ノルウェー、スウェーデン) の16〜23歳の女性2,750例(1回以上接種人数):PPE(Per-Protocol Efficacy)解析対象集団※ |
| 【方 法】 | 省庁のデータベースを用いてフォローアップを実施、免疫原性については血清採取を行い評価した。 |
| 【主要評価項目】 | HPV16、18型に関連したCIN2/3、AISまたは子宮頸がんの発生 |
| 【解析計画】 | 1年以内にガーダシル®の3回接種をすべて受け、プロトコールから有効性の評価に影響する逸脱がなく、評価項目に関連するHPVの型に対して初回接種前から3回接種の1ヵ月後(7ヵ月時)まで未感染であり、かつ初回接種前に血清抗体反応陰性であった被験者集団で検討した。 |
※:PPE(Per-Protocol Efficacy)解析対象集団:組み入れ1年以内にガーダシル®の3回接種をすべて受け、プロトコールから大きな逸脱がなく、評価項目に関連するHPVの型に対して初回接種前から3回接種の1ヵ月後(7ヵ月時)まで未感染であり、かつ初回接種前に血清抗体反応陰性であった被験者集団。
CIN:cervical intraepithelial neoplasia(子宮頸部上皮内腫瘍) AIS:adenocarcinoma in situ(上皮内腺がん)
●ガーダシル®長期フォローアップ試験(14年)における有効性(海外データ)2)
北欧地区で実施された015延長試験では、14年の時点で、HPV16型、18型関連のCIN2または3、AISの発生は認められませんでした(表3)。
表3:ガーダシル®長期フォローアップ試験(14年) 有効性【主要評価項目(検証項目)】
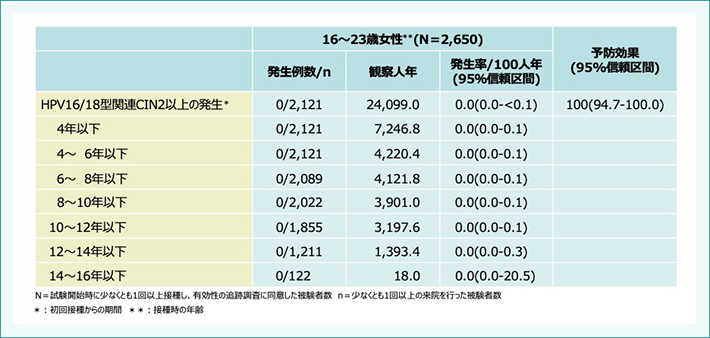
Kjaer SK et al. EClinicalMedicine. 2020; 23: 100401.
【利益相反】本試験はMSD社の資金援助および支援により実施された。本論文の著者に、MSD社の社員が含まれる。著者にMSD社より講演料、顧問料、カンファレンス参加料、研究助成金を受領している者が含まれる。
●ガーダシル®長期フォローアップ試験(14年)における安全性(海外データ)2)
本論文中に安全性に関する記載はありません。
安全性情報は、製品電子添文をご参照ください。
国内市販後臨床試験
●国内市販後臨床試験(国内第Ⅳ相臨床試験)の概要3)
日本においては、国内第Ⅳ相臨床試験が実施されています。本試験は、16〜26歳の女性1,030例を対象に実施され、観察期間は48ヵ月でした。主要評価項目はHPV6、11、16、および18型に関連したCIN2、3、AIS、または子宮頸がんの発生状況です。
| 【試験デザイン】 | 非盲検単群試験 |
| 【対 象】 | PPE(Per-Protocol Efficacy)解析対象集団:16~26歳の女性1,030例(1回以上接種した人数)で、1年以内にガーダシル®の3回接種をすべて受け、プロトコールから有効性の評価に影響する逸脱がなく、評価項目に関連するHPVの型に対して初回接種前から3回接種の1ヵ月後(7ヵ月時)まで未感染であり、かつ初回接種前に血清抗体反応陰性であった被験者集団。 |
| 【方 法】 | ガーダシル®を0、2、6ヵ月で3回筋肉内接種し、48ヵ月まで追跡し、有効性と安全性について検討した。 |
| 【解 析 計 画】 | PPE(Per-Protocol Efficacy)解析対象集団を有効性解析対象とした。ガーダシル®の予防効果の点推定値と95%信頼区間をポアソン分布により算出した。 |
| 【主要評価項目】 | HPV6型、11型、16型および18型に関連したCIN2/3、AISまたは子宮頸がんの発生率 |
●国内第Ⅳ相臨床試験におけるガーダシル®の予防効果(16〜26歳)3)
国内第Ⅳ相臨床試験では、HPV6、11、16、18型関連の子宮頸部疾患の発生は認められませんでした。また、尖圭コンジローマを含む外性器病変の発生も認められませんでした(表4)。
表4:国内第Ⅳ相臨床試験におけるガーダシル®の予防効果(16〜26歳)
Sakamoto M et al. J Infect Chemother. 2019; 25: 520-525. より作成
【利益相反】著者にMSD社より研究助成費、科研費、講師謝礼を受領している者が含まれる。著者にMSD社の社員が含まれる。
●国内第Ⅳ相臨床試験における有害事象(16〜26歳)3)
国内第Ⅳ相臨床試験における有害事象の概要はご覧の通りです(表5)。 1つ以上の有害事象は1,029例中344例(33.4%)に認められました。主な副反応は頭痛24例(2.3%)、倦怠感18例(1.7%)、発熱13例(1.3%)でした。重篤な有害事象は8例(人工妊娠中絶4例、自然流産1例、扁桃周囲炎1例、くも膜下出血1例、胎位異常1例)でした。死亡例はくも膜下出血1例、ワクチン関連の有害事象による中止例は蕁麻疹1例でした。(表6) 。
表5:国内第Ⅳ相臨床試験における有害事象の概要(16〜26歳)3)
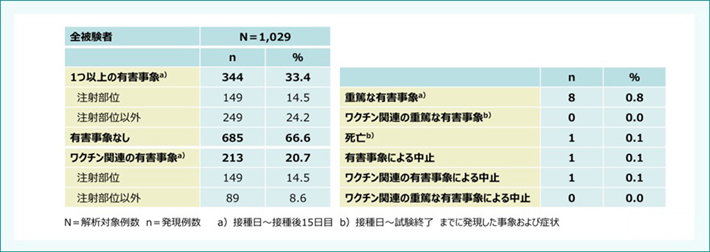
Sakamoto M et al. J Infect Chemother. 2019; 25: 520-525. より作成
【利益相反】著者にMSD社より研究助成費、科研費、講師謝礼を受領している者が含まれる。著者にMSD社の社員が含まれる。
表6:国内第Ⅳ相臨床試験における有害事象(16〜26歳)
被験者の1%以上に認められたワクチン関連の有害事象(ワクチン接種後15日まで)
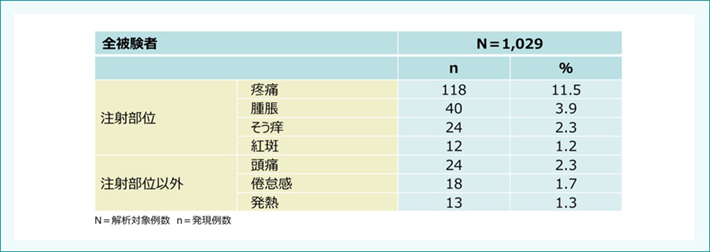
Sakamoto M et al. J Infect Chemother. 2019; 25: 520-525. より作成
【利益相反】著者にMSD社より研究助成費、科研費、講師謝礼を受領している者が含まれる。著者にMSD社の社員が含まれる。
参考文献
1) 承認時評価資料
2) Kjaer SK et al. EClinicalMedicine. 2020; 23: 100401.
3) Sakamoto M et al. J Infect Chemother. 2019; 25: 520-525.