第1日夜の入眠効果、睡眠維持効果
第1日夜の入眠効果、睡眠維持効果
<028試験(第Ⅲ相国際共同試験)と029試験(海外第Ⅲ相試験)の併合解析>
ベルソムラ®は、第1日夜から、入眠までの時間、中途覚醒時間を短縮させました。
ベルソムラ®投与第1日夜の持続睡眠潜時のベースラインからの変化量は-28.0(分)であり、プラセボ群に比べて入眠までの時間を短縮させました(PSGによる客観的評価)。
ベルソムラ®投与第1日夜の中途覚醒時間のベースラインからの変化量は-55.1(分)であり、プラセボ群に比べて中途覚醒時間を短縮させました(PSGによる客観的評価)。
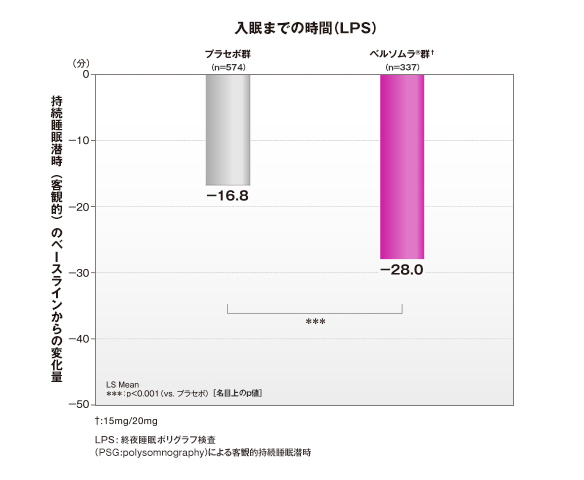
入眠までの時間(LPS)
ベースライン(分)
- 第1日夜:ベルソムラ®群† 67.3(n=337)、プラセボ群 67.4(n=574)
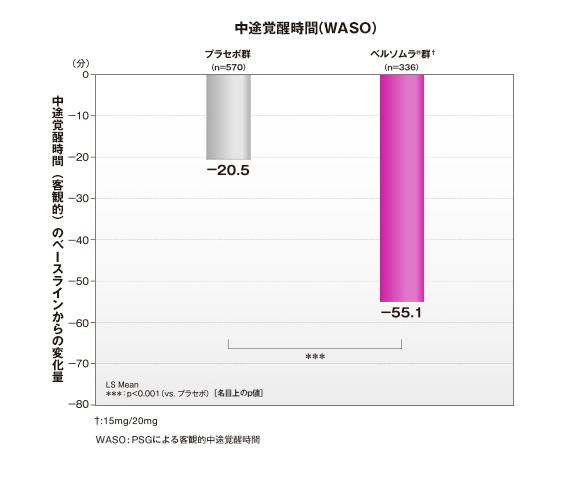
中途覚醒時間(WASO)
ベースライン(分)
- 第1日夜:ベルソムラ®群† 119.4(n=336)、プラセボ群116.7(n=570)
安全性
【028試験】
治療期および延長期(0~6ヵ月)の副作用は、ベルソムラ® 群 † 254例中53例(20.9%)、プラセボ群384例中57例(14.8%)に認められた。ベルソムラ® 群 † の主な副作用は、傾眠12例(4.7%)、頭痛10例(3.9%)、疲労6例(2.4%)、プラセボ群では、傾眠13例(3.4%)、頭痛12例(3.1%)であった。
【029試験】
治療期の副作用は、ベルソムラ® 群 † 239例中58例(24.3%)、プラセボ群383例中63例(16.4%)に認められた。ベルソムラ® 群 † の主な副作用は、傾眠19例(7.9%)、頭痛11例(4.6%)、口内乾燥6例(2.5%)、異常な夢6例(2.5%)、疲労5例(2.1%)、プラセボ群では、傾眠11例(2.9%)、頭痛12例(3.1%)、疲労8例(2.1%)であった。
028試験および029試験における6ヵ月間のベルソムラ®群の重篤な有害事象は3例(心房細動、肺炎、足関節部骨折が各1例)、投与中止に至った有害事象は15例(複数例に認められたものは頭痛、便秘が各2例)であった。
†:15mg/20mg
第Ⅲ相二重盲検比較試験(028、029試験における併合データ)
対 象 :
原発性不眠症患者2,030例(うち日本人247例)※[028試験:1,022例(うち日本人247例)/029試験:1,019例]
(※ このうち、ベルソムラ®高用量(18歳以上65歳未満:40mg、65歳以上:30mg)のデータは、本邦で承認外のため紹介していません)
試験デザイン :
(028試験/029試験共通)ベルソムラ®通常用量(18歳以上65歳未満:20mg、65歳以上:15mg)、高用量(18歳以上65歳未満:40mg、65歳以上:30mg)、あるいはプラセボを3ヵ月間1日1回就寝前に投与する治療期の後、退薬期間を1週間設けた。
(028試験)治療期の後に任意の二重盲検延長期を3ヵ月間設けた。
評価項目 :
(028試験/029試験共通)1ヵ月時および3ヵ月時の主観的総睡眠時間(sTSTm)および客観的中途覚醒時間(WASO)のベースラインからの変化量(睡眠維持効果)ならびに主観的睡眠潜時(sTSOm)および客観的持続睡眠潜時(LPS)のベースラインからの変化量(入眠効果)。第1週時におけるsTSTmおよび第1日夜におけるWASOのベースラインからの変化量(睡眠維持効果)ならびに第1週時におけるsTSOmおよび第1日夜におけるLPSのベースラインからの変化量(入眠効果)、ベルソムラ®の安全性と忍容性。
解析計画 :
各治療群とプラセボ群の差のより正確な推定値を算出するために、類似した試験デザインの第Ⅲ相有効性試験(028試験および029試験)の併合解析を実施した。試験、ベースライン値、年齢区分(65歳未満、65歳以上)、地域(北米、EU、その他)、コホート(PQ、Q)、性別、投与群、時点および投与群と時点の交互作用の項を共変量とした混合効果モデルに基づきp値を算出した。この併合解析では多重性に対処する正式な検定方法は採用しなかった。名目上のp値は仮説を正式に検証するためではなく効果の強さを図るためである。
承認時評価資料
【使用上の注意(抜粋)】5.高齢者への投与
高齢者での薬物動態試験において、非高齢者と比較して血漿中濃度が高くなる傾向が認められている。一般に高齢者では生理機能が低下していることも考慮し、患者の状態を観察しながら慎重に投与すること。〔「薬物動態」の7.(1)の項参照〕
【禁忌を含む使用上の注意】等はこちらをご参照ください。
本剤は、国内及び国外で実施された臨床成績をもとに承認されました。承認時に評価された海外データを紹介していますが、一部国内の承認内容と異なる成績が含まれています。