尿路感染症
臨床成績

1)承認時評価資料:複雑性尿路感染症を対象とした国内第Ⅲ相臨床試験(014試験)
試験概要

ME集団:
適切に尿検体が採取され、該当する来院時に判定できる尿培養結果を有するCE集団の部分集団の患者
CE集団:
試験手順を遵守し、規定された来院時期の来院範囲内に臨床効果の結果(判定不能を除く)を有するmMITT集団の部分集団の患者
mMITT集団:
治験薬を1回以上投与され、ベースライン時の尿検体で尿路感染症の原因菌が1つ以上検出された患者(≥105CFU/mL)
1. 細菌学的効果
TOC時点のME集団における細菌学的効果(有効率)は80.7%、疾患別有効率は腎盂腎炎80.6%及び膀胱炎80.8%であった。
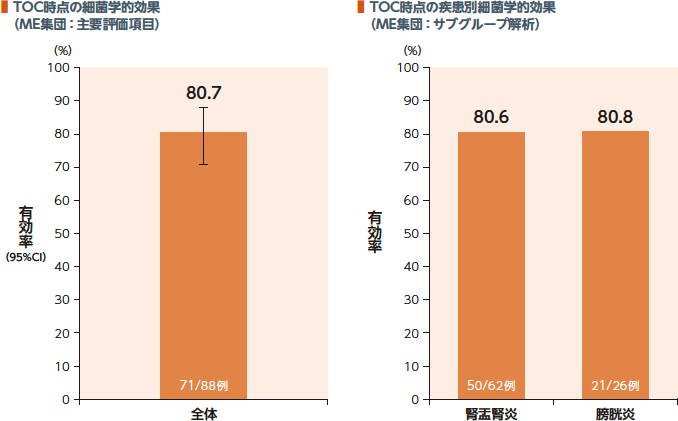
細菌学的効果:
細菌学的効果判定において、「消失(尿培養においてベースラインで105CFU/mL以上確認された原因菌が104CFU/mL未満に減少した)」と判定された場合を有効とした。
TOC時点のmMITT集団における細菌学的効果(有効率)は75.8%、疾患別有効率は腎盂腎炎73.9%及び膀胱炎80.8%であった。
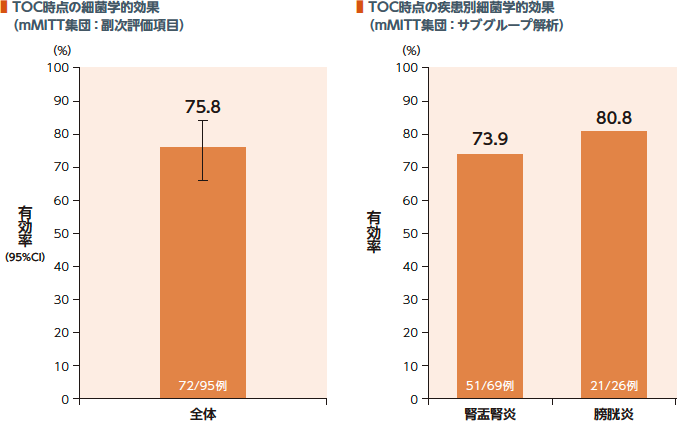
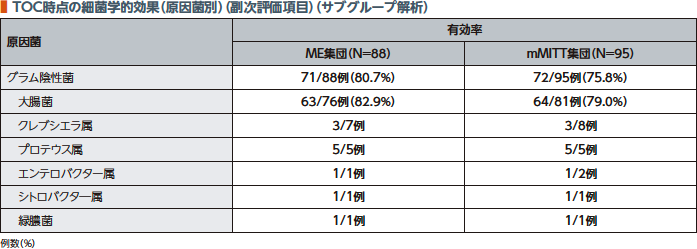
TOC時点のグラム陰性菌に対する細菌学的効果(有効率)はME集団で80.7%、mMITT集団で75.8%であった。
2. 臨床効果
TOC時点のCE集団における臨床効果(有効率)は96.6%であった。
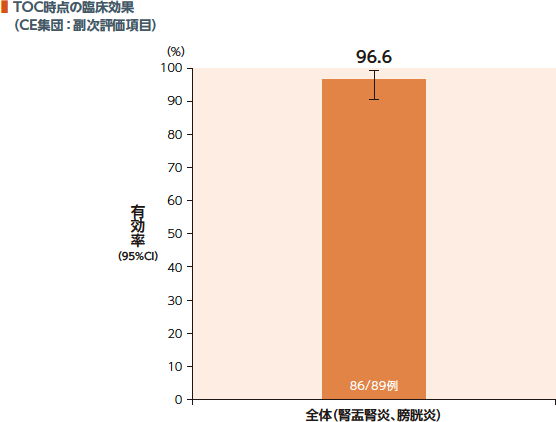
臨床効果:
臨床効果判定において、「臨床的治癒[尿路感染に関するすべての臨床症状・徴候が消失、改善(臨床症状・徴候の改善とは、ベースライン時のすべての臨床症状・徴候の程度が悪化することなく軽減し、EOT時点(最終投与後1日以内)後に追加の抗菌薬治療が不要と定義する)又は感染症発症前の状態まで回復し、尿路感染症治療のための追加又は他の抗菌薬(治験薬を除く)治療が不要である]」と判定された場合を有効とした。
3. 安全性
副作用は114例中20例(17.5%)に認められた。主な副作用は、下痢6例(5.3%)、ALT増加6例(5.3%)、AST増加4例(3.5%)であった。投与中止に至った副作用は頭痛1例、肝機能異常1例であった。重篤な副作用、死亡に至った副作用は認められなかった。

1)承認時評価資料:複雑性尿路感染症を対象とした国内第Ⅲ相臨床試験(014試験)
試験概要

敗血症評価対象集団:
ベースライン時に本解析における敗血症の診断基準を満たす尿路感染症患者
尿路性敗血症に対する臨床効果及び細菌学的効果
国内第Ⅲ相臨床試験での敗血症の診断基準を満たす尿路感染症患者のサブグループ解析におけるTOC時点の臨床効果(有効率)は57.1%、細菌学的効果(有効率)は100%であった。
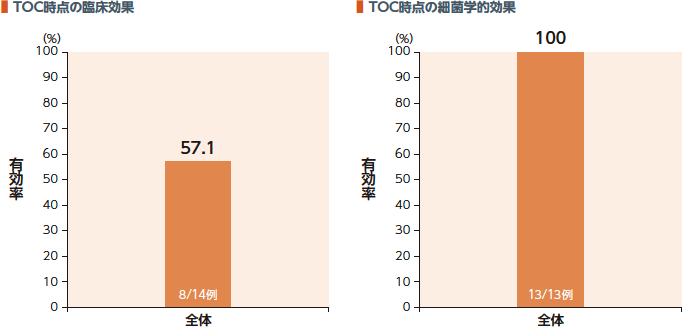
臨床効果:
臨床効果判定において、「臨床的治癒(TOC時点で、臨床所見から敗血症が疑われない。つまり、敗血症の診断基準の5項目(体温、白血球数、脈拍数、呼吸数及び収縮期血圧)のいずれの基準にも該当しない。)」と判定された場合を有効とした。
細菌学的効果:
細菌学的効果判定において、「消失(TOC時点の血液培養において、ベースラインのすべての血液培養分離菌が消失(血液培養陰性)」と判定された場合を有効とした。
6. 用法及び用量(抜粋)
〈敗血症、肺炎〉
通常、成人には1回3g(タゾバクタムとして1g/セフトロザンとして2g)を1日3回60分かけて点滴静注する。
2)承認時評価資料:腎盂腎炎を含む複雑性尿路感染症を対象とした海外第Ⅲ相臨床試験(CXA-cUTI-10-04/05試験)
試験概要

ME集団(TOC時点):
TOC時点のCE集団のうち、治験実施計画書の手順を遵守し、TOC時点で適切に収集された尿培養検体及び評価可能な尿培養結果を有するすべての患者
CE集団(TOC時点):
mMITT集団のうち、治験実施計画書の手順を遵守し、規定された来院時期の許容範囲内にTOC時点の評価結果を有するすべての患者。CE集団のTOC時点のすべての患者は、臨床的な評価結果を有する
mMITT集団:
MITT集団のうち、ベースライン時の尿検体から原因菌が検出されたすべての患者
MITT集団:
ITT集団のうち、投与量にかかわらず治験薬を投与されたすべての患者
ITT集団:
治験薬投与の有無にかかわらず、無作為割り付けされたすべての患者
※国内承認用法及び用量外
1. 細菌学的効果
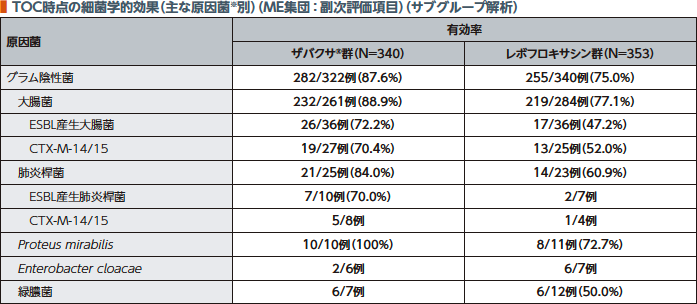
TOC時点のME集団における細菌学的効果(有効率)において、ザバクサ®群はレボフロキサシン群に対して非劣性であることが検証された。ザバクサ®群の疾患別有効率は腎盂腎炎86.4%及び膀胱炎76.7%であった。
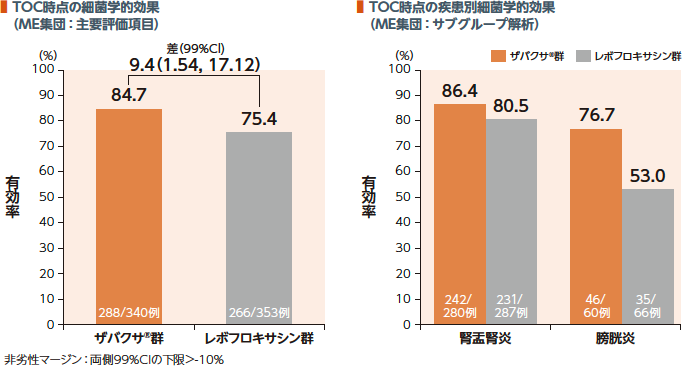
細菌学的効果:
細菌学的効果判定において、「消失(尿培養においてベースラインで105CFU/mL以上確認された原因菌が103CFU/mL未満に減少した)」と判定された場合を有効とした。
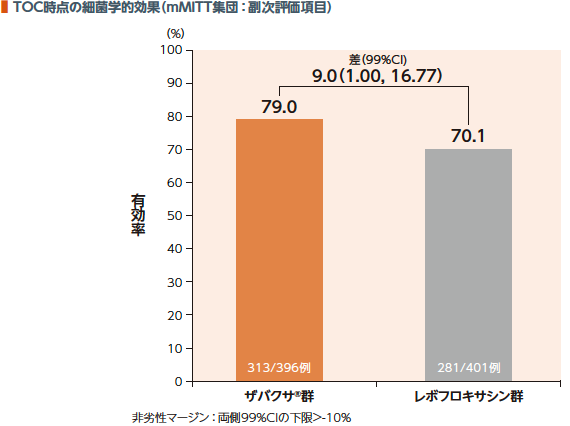
TOC時点のmMITT集団における細菌学的効果(有効率)は、ザバクサ®群が79.0%、レボフロキサシン群が70.1%であった。
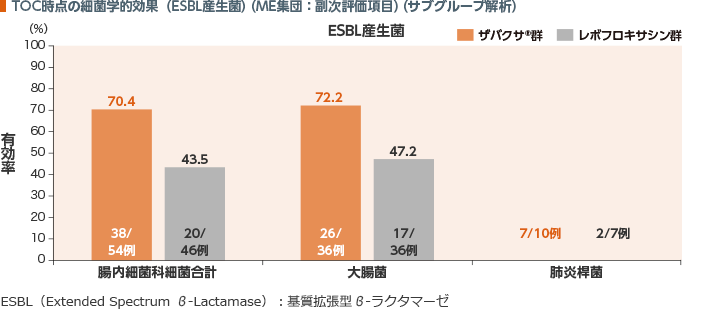
TOC時点のME集団におけるESBL産生腸内細菌科細菌に対する細菌学的効果(有効率)は、ザバクサ®群が70.4%、レボフロキサシン群が43.5%であった。
TOC時点のME集団におけるグラム陰性菌に対する細菌学的効果(有効率)は、ザバクサ®群が87.6%、レボフロキサシン群が75.0%であった。
※ザバクサ®適応菌種のみ
例数(%)
2. 臨床効果
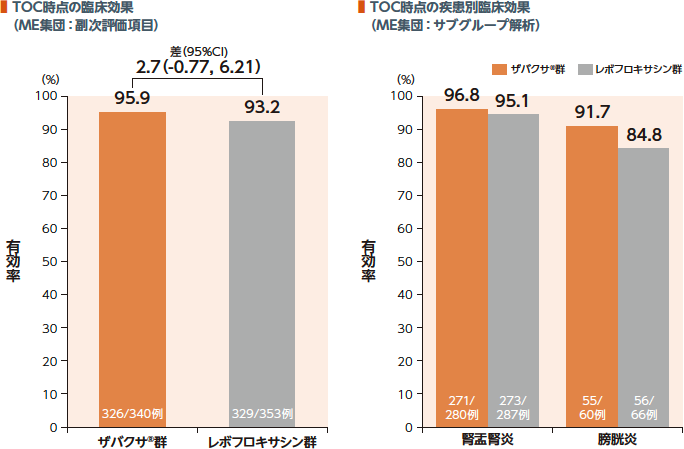
TOC時点のME集団における臨床効果(有効率)はザバクサ®群が95.9%、レボフロキサシン群が93.2%であった。
ザバクサ®群の疾患別有効率は腎盂腎炎96.8%及び膀胱炎91.7%であった。
臨床効果:
臨床効果判定において、「臨床的治癒[尿路感染に関するすべての臨床症状・徴候が消失、改善(臨床症状・徴候の改善とは、ベースライン時のすべての臨床症状・徴候の程度が悪化することなく軽減し、EOT時点(最終投与後1日以内)後に追加の抗菌薬治療が不要と定義する)又は感染症発症前の状態まで回復し、尿路感染症治療のための追加又は他の抗菌薬(治験薬を除く)治療が不要である]」と判定された場合を有効とした。
3. 安全性
副作用はザバクサ®群で530例中55例(10.4%)、レボフロキサシン群で532例中63例(11.8%)に認められた。主な副作用はザバクサ®群で頭痛10例(1.9%)、悪心7例(1.3%)、AST増加7例(1.3%)、レボフロキサシン群で下痢19例(3.6%)、頭痛4例(0.8%)であった。重篤な副作用はザバクサ®群でクロストリジウム・ディフィシレ大腸炎1例、偽膜性大腸炎1例、レボフロキサシン群では認められなかった。投与中止に至った副作用は、ザバクサ®群で3例3件(嘔吐、注入部位血栓及び偽膜性大腸炎各1件)、レボフロキサシン群で6例6件(下痢2件、注入部位紅斑1件、薬剤過敏症2件、アレルギー性皮膚炎1件)であった。ザバクサ®群で1例に死亡が認められたが、薬剤との因果関係はなしと判定された。
レボフロキサシン注射液の国内における用法及び用量
通常、成人にはレボフロキサシンとして1回500mgを1日1回、約60分間かけて点滴静注する。
【禁忌を含む使用上の注意】等はこちらをご参照ください。