KEYNOTE-001試験
本剤は、一部承認外の効能又は効果、用法及び用量による臨床試験の成績も含めた臨床データパッケージで評価され、承認されました。
そのため、国内で承認されている効能又は効果、用法及び用量と異なる海外データも紹介しています。
非小細胞肺癌:海外臨床試験成績:海外第Ⅰ相試験<KEYNOTE-001試験:パートC+F>(海外データ)
承認時評価資料:海外第Ⅰ相試験パートC、F(KEYNOTE-001試験)
Garon EB et al. N Engl J Med 2015; 372: 2018-2028
Garon EB et al. J Clin Oncol 2019; 37: 2518-2527
本試験はMSD社の資金提供により行われた。Edward B GaronはMSD社より助成金を受領している。Enriqueta Felip、Ruth Z Rutledge、Jin Zhang、Jared K Lunceford、Reshma Rangwala、Gregory M Lubiniecki、Kenneth EmancipatorはMSD社の社員である。5年間フォローアップの解析報告は、Edward B GaronはMSD社より助成金を受領している。その他の著者にMSD社より助成金などを受領している者が含まれる。
※本試験は局所進行又は遠隔転移のある固形がん、悪性黒色腫、非小細胞肺癌患者を組み入れたパートA-Fで構成されています。ここではPD-L1陽性の切除不能な進行又は再発の非小細胞肺癌を対象としたパートC、Fについてご紹介します。
試験概要
【目的】
●安全性及び忍容性、有効性の検討
化学療法既治療の非小細胞肺癌患者に対するキイトルーダ®の有効性及び安全性を検討する。
●バイオマーカーの検討
有効性バイオマーカー候補(PD-L1)とキイトルーダ®の抗腫瘍効果との関連を検討する。
【デザイン】多施設共同非盲検第Ⅰ相試験(パートC、F)(データカットオフ日:2015年1月23日)[5年間フォローアップ解析結果(データカットオフ日:2018年11月5日)]
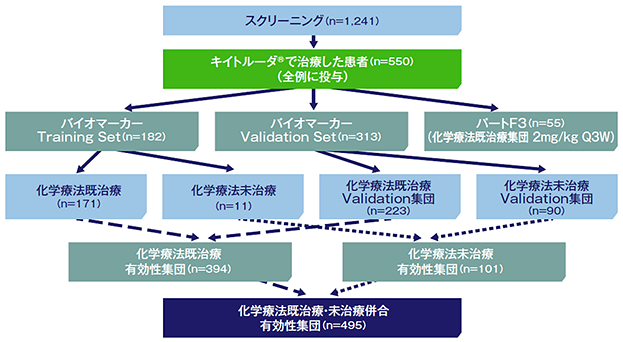
【対象】非小細胞肺癌患者550例
【方法】
●安全性及び忍容性、有効性の検討
パートCでは非小細胞肺癌の既治療患者を組み入れ、キイトルーダ®10mg/kgを3週間間隔(Q3W)で投与した。
パートF1は非小細胞肺癌の未治療患者を組み入れ、パートF2では非小細胞肺癌で2レジメン以上の前治療歴がある患者を組み入れ、PD-L1発現陽性の患者にキイトルーダ®10mg/kgを2週間間隔(Q2W)又はQ3Wで投与した。さらにパートF2では非小細胞肺癌で2レジメン以上の前治療歴があり、かつPD-L1発現陰性の患者に10mg/kg Q2Wを投与した。
パートF3では非小細胞肺癌の既治療がありかつPD-L1発現陽性の患者にキイトルーダ®2mg/kg Q3Wを投与した。
なお、キイトルーダ®は病勢進行(PD)又は許容できない副作用が認められるか、医師より治療中止が必要と判断されるまで点滴静注する。
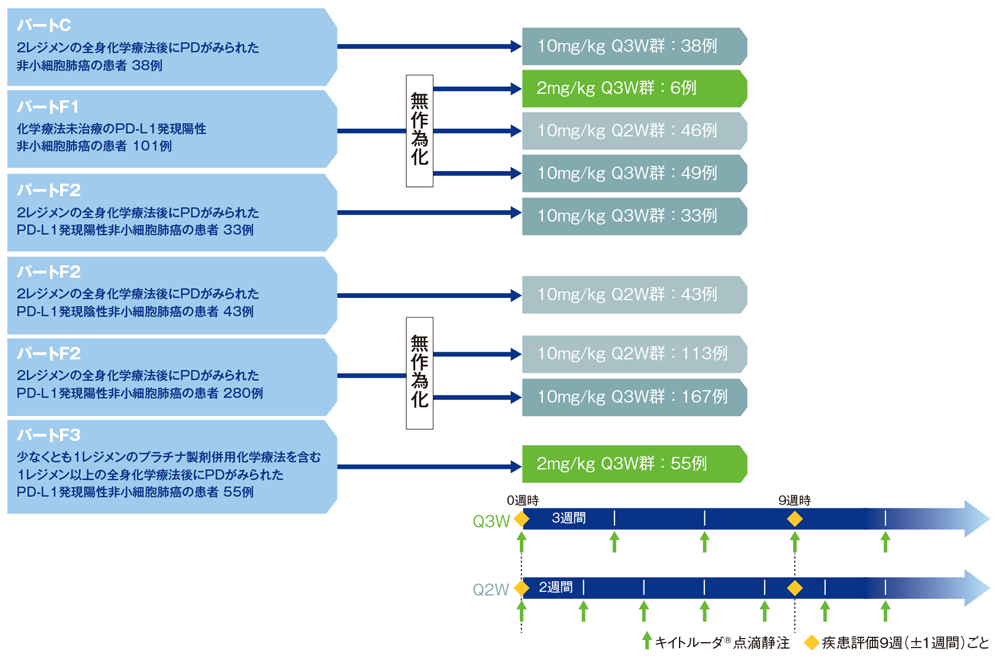
●バイオマーカーの検討:試験概要(パートC、F1、F2)
本試験ではバイオマーカー解析を目的として、パートC、F1、F2の患者を併合し、Training Set※とValidation Set※※を構成した。
Training setでは、22C3抗ヒトPD-L1抗体を用いた免疫組織化学染色法(IHC)によってPD-L1の発現を測定し、奏効率(ORR)の評価を用いて、PD-L1高発現に対するカットオフ値を決定した。
Validation setでは、Training setで設定したPD-L1発現のカットオフ値の臨床的な実用性を確認するために、抗腫瘍効果との関連を検討した。PD-L1高発現における奏効率の95%信頼区間(95%CI)の下限が15%以上であった場合はPD-L1発現陽性にステップダウンして解析を行うことを規定した。
※PD-L1高発現に対するカットオフ値を決定するための解析対象とした集団
※※Training setで設定したカットオフ値の臨床的な実用性を確認するための解析対象とした集団
【評価項目】主要評価項目:安全性、奏効率(overall response rate;ORR)
副次評価項目:irRC(免疫療法のための治療効果判定基準)によるORR、PD-L1発現別のORR及び病勢コントロール率(disease control rate;DCR)、奏効期間(duration of response;DOR)、全生存期間(overall survival;OS)、無増悪生存期間(progression-free survival;PFS)、薬物動態
【判定基準】主要評価項目における奏効及び病勢進行は独立判定委員会(IRC)がRECISTガイドライン1.1版を用いて評価した。副次評価項目はIRCがRECISTガイドライン1.1版及びirRCを用いて評価した。
【解析計画】解析対象集団:安全性及び有効性の解析はAPaT集団*1を対象として実施した。
有効性評価の統計手法:パートC及びFにおける主要解析集団をPD-L1高発現の集団とし、主要評価項目であるORRは各患者集団、場合によっては各用法・用量でORRの95%CIも算出し、解析を行った。なお、信頼区間の推定には二項分布の確率計算による正確法を用いた。PD-L1の発現レベルはPA*2、CTA*3、CRA*4を用いて測定し、PD-L1高発現のカットオフ値は、腫瘍細胞のうちPD-L1発現陽性細胞の割合を反映するTPS(tumor proportion score)スコアを使用してROC(receiver operating characteristic)曲線を用いて解析した。
サブグループ解析としてPD-L1発現レベル別のORRを検討し、PFS、OS、奏効期間及び奏効までの期間はKaplan-Meier法を用いて推定した。事前に規定された解析結果とともに、フォローアップ解析(データカットオフ日:2018年11月5日)から得られたOS及びDORの結果を示す。
*1 APaT(all patients as treated)集団:治験薬を少なくとも1回投与されたすべての割り付けされた患者
*2 Prototype Assay
*3 Clinical Trial Assay
*4 Commercial Ready Assay
4. 効能又は効果(抜粋)
切除不能な進行・再発の非小細胞肺癌
5. 効能又は効果に関連する注意 (抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
5.2 本剤の術後補助療法における有効性及び安全性は確立していない。
5.3 本剤を単独で投与する場合には、PD-L1の発現が確認された患者に投与すること。PD-L1を発現した腫瘍細胞が占める割合(TPS)について、「17. 臨床成績」の項の内容を熟知すること。十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html[17.1.8-17.1.10参照]
5.4 臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.6、17.1.8-17.1.10参照]
6. 用法及び用量(抜粋)
〈切除不能な進行・再発の非小細胞肺癌〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
バイオマーカーの検討:PD-L1に対するカットオフ値
バイオマーカー Training Set
バイオマーカーTraining Set における奏効率(ORR)とPD-L1発現量の解析(ROC 解析)
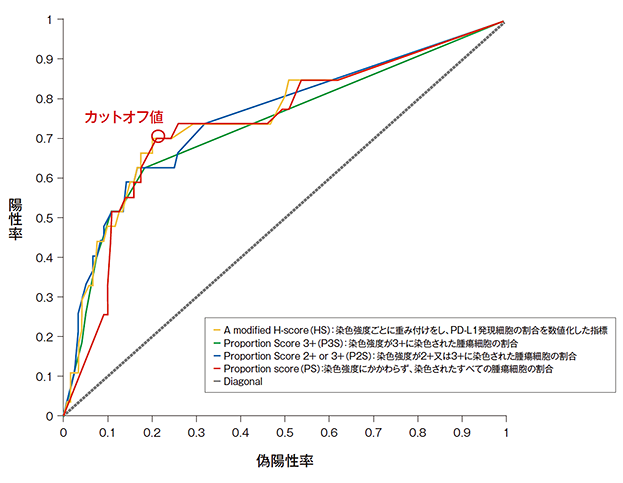
- バイオマーカーTraining Setを構成する182例のうち、少なくとも1回のキイトルーダ®の投与を受け、irRC評価でベースライン時に測定可能病変を有しており、Clinical Trial Assay(CTA)で測定可能な検体を有していた患者146例について、少なくとも19週の経過観察を終了した後、irRCを用いた治験担当医師評価に基づきROC曲線を解析したところ、Youden Indexにより47.5%のTPS*1が適切なカットオフ値であることが示されました。切り上げて50%とし、コンパニオン診断薬のスコアを簡素化しました(以降、TPS≧50%*2をPD-L1高発現としました)。
*1 TPS:tumor proportion score
*2 腫瘍細胞のうちPD-L1発現陽性細胞の割合が50%以上(TPS≧50%)
PD-L1の発現はPD-L1 IHC 22C3 pharmDx「ダコ」の試作キットを用いて検査された
バイオマーカー Validation Set:サブグループ解析
PD-L1発現レベル別の奏効率(ORR)
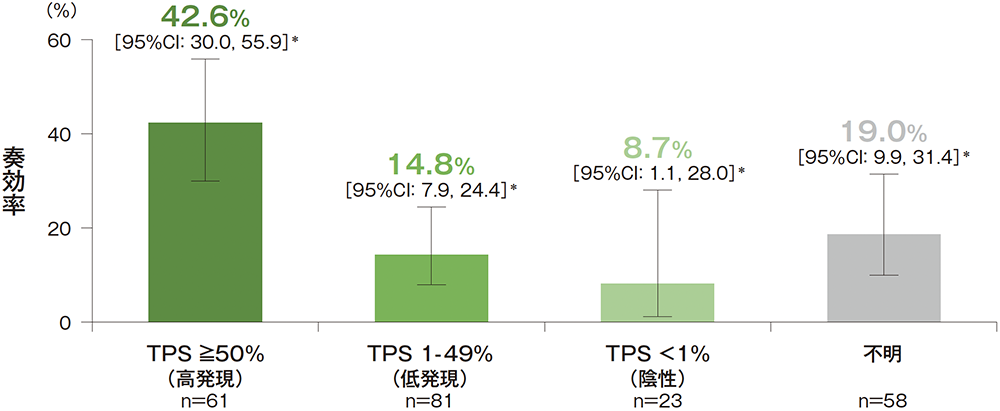
- バイオマーカーTraining Setで設定したPD-L1発現のカットオフ値の臨床的な実用性を確認するために、223例の既治療患者及び90例の未治療患者の集団からなるバイオマーカーValidation SetをCommercial Ready Assay(CRA)を用いてプロスペクティブに解析しました。結果、バイオマーカーValidation Setを構成する既治療の患者集団での奏効率(ORR)は、主要有効性解析対象集団であるPD-L1高発現(TPS≧50%)の患者集団で42.6%(95%CI:30.0, 55.9)*、PD-L1低発現(TPS 1-49%)の患者集団で14.8%(95%CI:7.9, 24.4)*、PD-L1発現陰性の患者集団で8.7%(95%CI:1.1, 28.0)*であり、TPS≧50%のカットオフ値の妥当性が臨床的に確認されました。
*二項分布の確率計算による正確法
主要評価項目 PD-L1高発現患者(TPS≥50%)における奏効率:ORR
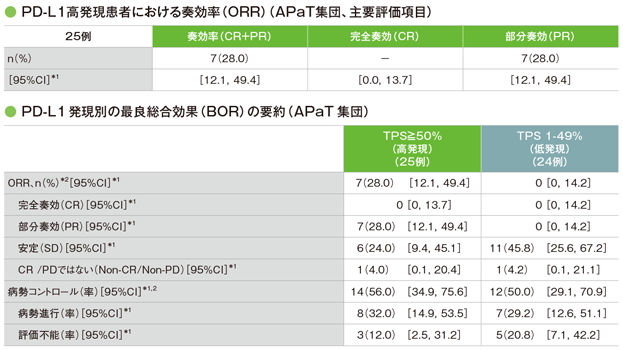
承認外のため、TPS<1%の4例と不明の2例の結果は削除して掲載した
*1 二項分布の確率計算による正確法
*2 副次評価項目はPD-L1発現別のORR及び病勢コントロール率
(追跡期間中央値:7.7ヵ月)
- PD-L1高発現患者におけるORRは、28.0%(95%CI:12.1, 49.4)*1でした。
安全性(主要評価項目)(パートC+F1+F2+F3併合解析:APaT集団)
キイトルーダ®2mg/kg Q3W群で副作用は31/61例(50.8%)に認められました。重篤な副作用は6例(9.8%)に認められ、2例以上にみられた重篤な副作用は、大腸炎、肺臓炎各2例(3.3%)でした。副作用による中止は4例(6.6%)で、その内訳は肺臓炎2例(3.9%)、心肺停止、急性腎不全各1例(1.6%)でした。副作用による死亡は心肺停止1例(1.6%)でした。
キイトルーダ®10mg/kg Q3W群で副作用は201/287例(70.0%)に認められました。主な副作用(発現率10%以上)は、疲労65例(22.6%)、食欲減退36例(12.5%)、そう痒症33例(11.5%)、発疹30例(10.5%)でした。
重篤な副作用は27例(9.4%)に認められ、2例以上にみられた重篤な副作用は、肺臓炎8例(2.8%)、副腎機能不全、甲状腺機能低下症、悪心、低ナトリウム血症各2例(0.7%)でした。副作用による中止は11例(3.8%)で、その内訳は肺臓炎6例(2.1%)、全身性浮腫、血清病、関節硬直、間質性肺疾患、過角化、発疹各1例(0.3%)でした。
副作用による死亡は呼吸不全、間質性肺疾患各1例(0.3%)でした。
キイトルーダ®10mg/kg Q2W群で副作用は148/202例(73.3%)に認められました。主な副作用(発現率10%以上)は、疲労35例(17.3%)、関節痛、そう痒症各22例(10.9%)でした。重篤な副作用は13例(6.4%)に認められ、2例以上にみられた重篤な副作用は、肺臓炎4例(2.0%)でした。副作用による中止は8例(4.0%)で、その内訳は肺臓炎3例(1.5%)、自己免疫性溶血性貧血、好中球減少症、大腸炎、胃内容排出障害、体重減少、神経痛各1例(0.5%)でした。副作用による死亡は認められませんでした。