用量反応試験
[臨床試験] 国内後期第Ⅱ相臨床試験(用量反応試験)
ベースライン時から12週後のHbA1cの変化量(主要評価項目)
(国内後期第Ⅱ相臨床試験)
HbA1cの推移
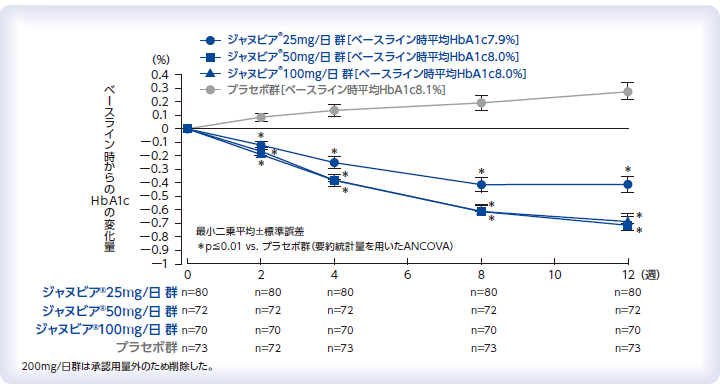
Iwamoto Y et al. Endocr J 2010; 57(5): 383-394.
[国内後期第Ⅱ相臨床試験:用量反応試験(A202試験:承認時評価資料)]
本試験はMSDの資金提供により行われた。著者にMSD社員を含む。
著者にMSDより講演料等を受領しているものが含まれる。
【目的】
12週投与時におけるベースラインからのHbA1c値低下効果に関して、プラセボ群と比較することによる用量反応性の検討及びジャヌビア®の安全性と忍容性の検討
【試験】
無作為プラセボ対照二重盲検比較試験(用量反応試験)
【対象】
食事/運動療法の実施のみでは血糖コントロール不十分な2型糖尿病患者[HbA1c6.9%以上10.5%未満、空腹時血糖値270mg/dL以下]363例[有効性FAS解析対象例内訳:プラセボ群73例、ジャヌビア®25mg群80例、50mg群72例、100mg群70例、200mg群68例]
【方法】
2週間の観察期間(プラセボ投与)の後、ジャヌビア®各投与群又はプラセボ群に無作為に割り付け、1日1回朝食前に12週間経口投与を行った。他の血糖降下薬は併用禁止(単独療法)とした。
【評価項目】
<主要評価項目>HbA1cのベースライン時からの変化量(12週後)
【解析計画】
合計350例(各群70例)を5用量群に1:1:1:1:1の割合で無作為に割り付け、有効性解析はFAS(無作為化され試験薬が1回以上投与され、ベースライン時及び投与後の測定が1回以上行われた全例)で実施した。主要評価項目であるベースライン時から12週後のHbA1cの変化量はANCOVAモデルにより、治療群、経口血糖降下薬による治療の有無、ベースライン時のHbA1c値を共変量として解析し、p値はBonferroni法で調整した。欠測値はLOCF法を用いて補足し、p≦0.050(両側)を統計学的に有意とした。
安全性
本試験において臨床症状の副作用はジャヌビア®25mg群6/80例(7.5%)、50mg群3/72例(4.2%)、100mg群5/70例(7.1%)、200mg群1/68例(1.5%)、プラセボ群3/73例(4.1%)に認められ、主なものは25mg群で便秘2例(2.5%)、50mg群で低血糖症など1例(1.4%)、100mg群で低血糖症3例(4.3%)、200mg群で低血糖症など1例(1.5%)、プラセボ群で低血糖症など1例(1.4%)であった。臨床検査値の副作用は、それぞれ25mg群で3/80例(3.8%)[総蛋白減少、白血球数増加、尿中蛋白陽性が各1件(1.3%)]、50mg群で6/72例(8.3%)[主なものはALT増加3件、AST増加3件(各4.2%)、LDL増加2件(2.8%)]、100mg群で1/70例(1.4%)[血中クレアチンホスホキナーゼ増加1件(1.4%)]、200mg群で2/68例(2.9%)[血中ビリルビン増加など1件(1.5%)]、プラセボ群で2例(2.7%)[血中カルシウム減少など1件(1.4%)]であった。
すべての群において重篤な副作用(死亡を含む)及び投与中止に至った副作用は報告されなかった。
【承認された用法及び用量】
通常、成人にはシタグリプチンとして50mgを1日1回経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら100mg 1日1回まで増量することができる。
本剤のご使用にあたり、【禁忌】等その他項目は電子添文をご参照ください。
他の経口血糖降下薬併用時のHbA1c改善効果
グリメピリド、ピオグリタゾン、メトホルミン、ボグリボース、又は速効型インスリン分泌促進薬との併用試験の結果[二重盲検比較試験(12週時)]
![グリメピリド、ピオグリタゾン、メトホルミン、ボグリボース、又は速効型インスリン分泌促進薬との併用試験の結果[二重盲検比較試験(12週時)] グリメピリド、ピオグリタゾン、メトホルミン、ボグリボース、又は速効型インスリン分泌促進薬との併用試験の結果[二重盲検比較試験(12週時)]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2021/02/januvia_strong_chart_02.png?w=610)
Tajima N et al. Diabetol Int 2011; 2(1): 32-44
[国内第Ⅲ相臨床試験:グリメピリドとの併用試験(ONO-5435-09試験:承認時評価資料)]†
Kashiwagi A et al. J Diabetes Investig 2011; 2(5): 381-390
[国内第Ⅲ相臨床試験:ピオグリタゾンとの併用試験(P055 試験:承認時評価資料)]†
Kadowaki T et al. J Diabetes Investig 2013; 4(2): 174-181
[国内第Ⅲ相臨床試験:メトホルミンとの併用試験(ONO-5435-08試験:承認時評価資料)]†
Tajima N et al. J Diabetes Investig 2013; 4(6): 595-604
[国内第Ⅲ相臨床試験:ボグリボースとの併用試験(P104試験:承認時評価資料)]†
Tajima N et al. Diabetol Int 2016; 7(2): 155-166
[第Ⅲ相臨床試験:速効型インスリン分泌促進薬との併用試験(ONO-5435-17試験:承認時評価資料)]†‡
† 本試験はMSDの資金提供により行われた。著者にMSD社員を含む。
‡著者にMSDよりコンサルタント料等を受領しているものが含まれる。より作表
【目的】
グリメピリド、ピオグリタゾン、メトホルミン、ボグリボース、速効型インスリン分泌促進薬をそれぞれ併用投与した際のジャヌビア®の有効性及び安全性の評価(それぞれは独立した別の試験)
【試験】
無作為プラセボ対照二重盲検比較試験
【対象】
食事/運動療法に加え、経口血糖降下薬†の単独療法で血糖コントロール不十分な2型糖尿病患者[グリメピリド併用試験、速効型インスリン分泌促進薬併用試験はHbA1c7.4%以上10.5%未満、ピオグリタゾン併用試験、メトホルミン併用試験、ボグリボース併用試験はHbA1c6.9%以上10.5%未満]
【方法】
プラセボに経口血糖降下薬†を2週間併用した観察期間の後、ジャヌビア®50mg群又はプラセボ群に無作為に割り付け、1日1回朝食前に12週間経口投与を行った。試験期間中の経口血糖降下薬†の用量変更及び追加は禁止とした。
†併用薬はそれぞれグリメピリド1~6mg/日、ピオグリタゾン15~45mg/日、メトホルミン500mg以上/日、ボグリボース0.2mg又は0.3mg1日3回、ナテグリニド180~360mg/日又はミチグリニド15~60mg/日であり、試験期間中は用量を一定とした。それぞれは独立した別々の試験。
【評価項目】
<主要評価項目>
グリメピリド、ピオグリタゾン、メトホルミン、ボグリボース併用試験:ベースライン時からのHbA1cの変化量(12週)
速効型インスリン分泌促進薬併用試験:安全性及び忍容性
<副次評価項目>
グリメピリド、ピオグリタゾン、メトホルミン、ボグリボース併用試験:ベースライン時からの食後2時間血糖値及び空腹時血糖値の変化量(12週)
速効型インスリン分泌促進薬併用試験:ベースライン時からのHbA1c、食後2時間血糖値、空腹時血糖値の変化量(12週)
【解析計画】
グリメピリド併用試験:主要評価項目の解析は、投与群及び糖尿病前治療の有無を因子、ベースライン時のHbA1cを共変量とし、ANCOVAにより評価した。
ピオグリタゾン併用試験:主要評価項目の解析は、投与群、ベースライン時の値、ピオグリタゾン以外の経口血糖降下薬の使用の有無を共変量とし、ANCOVAにより評価した。
メトホルミン併用試験:主要評価項目の解析は、投与群、メトホルミン以外の経口血糖降下薬の使用の有無を因子、ベースライン時のHbA1cを共変量とし、ANCOVAにより評価した。
ボグリボース併用試験:主要評価項目の解析は、投与群、期間(カテゴリー変数)、期間と投与群の交互作用、ボグリボース以外の経口血糖降下薬の使用の有無、経口血糖降下薬の使用状況と投与群の交互作用を共変量とし、制約つき経時データ解析(cLDA)モデルにより評価した。
速効型インスリン分泌促進薬併用試験:副次評価項目の解析は投与群、他の糖尿病治療薬による治療歴の有無、速効型インスリン分泌促進薬の種類(ナテグリニド、ミチグリニド)、時点、及び時点と投与群、時点と他の糖尿病治療薬による治療歴、及び時点と速効型インスリン分泌促進薬の種類との交互作用の項を含むcLDAモデルにより評価した。
安全性
グリメピリド併用:試験において臨床症状の副作用はジャヌビア®群9/71例(12.7%)、プラセボ群4/67例(6.0%)に認められ、主なものはジャヌビア®群で低血糖症2件(2.8%)、腹部膨満など1件(1.4%)、プラセボ群で急性心筋梗塞など1件(1.5%)などであった。臨床検査値の副作用はそれぞれ3例(4.2%)[主なものはALT増加など1件(1.4%)]、2例(3.0%)[主なものはALT増加など1件(1.5%)]であった。重篤な臨床症状の副作用は1例1件(プラセボ群、急性心筋梗塞)、投与中止に至った副作用は認められなかった。死亡は認められなかった。
ピオグリタゾン併用:本試験において臨床症状の副作用はジャヌビア®群4/66例(6.1%)、プラセボ群5/68例(7.4%)に認められ、ジャヌビア®群では低血糖症、便秘、浮腫、体重増加が各1件(1.5%)、プラセボ群では低血糖が2件(2.9%)、右脚ブロック、回転性めまい、腹部膨満、血圧低下、心電図T波逆転が各1件(1.5%)であった。臨床検査値の副作用は両群とも報告されなかった。重篤な副作用、投与中止に至った副作用及び死亡は認められなかった。
メトホルミン併用:本試験において臨床症状の副作用はジャヌビア®群1/77例(1.3%)、プラセボ群5/72例(6.9%)に認められ、ジャヌビア®群では単純ヘルペス1件(1.3%)、プラセボ群では腹部膨満、腹痛、便秘、下痢、倦怠感、血圧上昇、心電図ST部分下降が各1件(1.4%)であった。臨床検査値の副作用はそれぞれ4/76例(5.3%)[主なものはALT増加など1件(1.3%)]、プラセボ3/72例(4.2%)[主なものは血中トリグリセリド増加など1件(1.4%)]で認められた。重篤な副作用、投与中止に至った副作用及び死亡は認められなかった。
ボグリボース併用:本試験において臨床症状の副作用はジャヌビア®群6/70例(8.6%)、プラセボ群3/63例(4.8%)に認められた。ジャヌビア®群では腹痛、嘔吐、肝機能異常、低血糖症、頭痛、湿疹、蕁麻疹が各1件(1.4%)、プラセボ群では便秘、下痢、発汗障害、湿疹が各1件であった。臨床検査値の副作用はそれぞれ1例(1.4%)[ALT増加]、1例(各1.6%)[血中クレアチニン増加、血中尿素増加が各1件]であった。
投与中止に至った副作用はジャヌビア®群1例(1.4%)[蕁麻疹]で認められた。重篤な副作用及び死亡は認められなかった。
速効型インスリン分泌促進薬併用:本試験において臨床症状の副作用はジャヌビア®群4/75例(5.3%)、プラセボ群4/80例(5.0%)に認められた。ジャヌビア®群で低血糖症3件(4.0%)、下腹部痛、上腹部痛、口内炎、浮動性めまいが各1件(1.3%)、プラセボ群では便秘、低血糖症、浮動性めまい、末梢性ニューロパチーが各1件(1.3%)であった。臨床検査値の副作用は、それぞれ1例(1.3%)[ジャヌビア®群:血中ブドウ糖減少、プラセボ群:白血球数減少]に認められた。投与中止に至った副作用、重篤な副作用及び死亡は認められなかった。
インスリン製剤との併用試験の結果[二重盲検比較試験(16週時)]
![インスリン製剤との併用試験の結果[二重盲検比較試験(16週時)] インスリン製剤との併用試験の結果[二重盲検比較試験(16週時)]](https://www.msdconnect.jp/wp-content/uploads/sites/5/2021/02/januvia_strong_chart_03.png)
Kadowaki T et al. Diabetol Int 2013; 4(3): 160-172
[国内第Ⅲ相臨床試験:インスリン製剤との併用試験(ONO-5435-15 試験:承認時評価資料)]
本試験はMSDの資金提供により行われた。著者にMSD社員を含む。
【目的】
インスリン製剤と併用投与した際のジャヌビア®の有効性及び安全性の評価
【試験】
無作為プラセボ対照二重盲検比較試験
【対象】
食事/運動療法に加え、インスリン製剤[混合型(速効型又は超速効型のインスリンの含有率が25%又は30%)、中間型又は持効型のいずれか単剤を使用]で血糖コントロール不十分な2型糖尿病患者[HbA1c7.9%以上10.5%未満、空腹時血糖値126mg/dL以上220mg/dL以下]266例[有効性FAS解析対象例内訳:プラセボ併用群137例、ジャヌビア®併用群129例]。
【方法】
経口血糖降下薬を併用している場合は12週間以上のwash-outを行い、2又は12週間を観察期間とし、インスリン製剤を使用している患者にプラセボを2週間併用した後、ジャヌビア®50mg群又はプラセボ群に無作為に割り付け、1日1回朝食前に16週間経口投与を行った。インスリン製剤の投与量は、治験期間を通じて一定とした。
【評価項目】
<主要評価項目>ベースライン時からのHbA1cの変化量(16週)
<副次評価項目>ベースライン時からの食後2時間血糖値及び空腹時血糖値の変化量(16週)
【解析計画】
主要評価項目の解析は、投与群、時点、時点と投与群の交互作用の項を含むcLDAモデルを用い、糖尿病治療薬による治療歴の有無、インスリンの種類により調整した。このモデルにより群間差(最小二乗平均値及び95%信頼区間)を算出した。有意水準はp<0.05(両側)とした。
安全性
本試験において臨床症状の副作用はジャヌビア®群21/129例(16.3%)、プラセボ群16/137例(11.7%)に認められた。主なものはジャヌビア®群では低血糖症15例(11.6%)、多汗症3例(2.3%)、空腹2例(1.6%)、プラセボ群では低血糖症9例(6.6%)、多汗症4例(2.9%)、便秘2例(1.5%)等であった。臨床検査値の副作用はそれぞれ3例(2.3%)[血中ブドウ糖減少、血中乳酸脱水素酵素増加、γGTP増加、ヘマトクリット減少、ヘモグロビン減少、赤血球数減少、血中アルカリホスファターゼ増加が各1件(0.8%)]及び1例(0.7%)[白血球数増加]であった。投与中止に至った副作用、重篤な副作用及び死亡は認められなかった。
4. 効能又は効果
2型糖尿病
6. 用法及び用量
通常、成人にはシタグリプチンとして50mgを1日1回経口投与する。なお、効果不十分な場合には、経過を十分に観察しながら100mg1日1回まで増量することができる。
10. 相互作用
本剤は主に腎臓から未変化体として排泄され、その排泄には能動的な尿細管分泌の関与が推察される。[16.5.1、16.5.2 参照]
10.2 併用注意(併用に注意すること)
| 機序・危険因子薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 糖尿病用薬: インスリン製剤 スルホニルウレア剤 チアゾリジン系薬剤 ビグアナイド系薬剤 α-グルコシダーゼ阻害剤 速効型インスリン分泌促進薬 GLP-1受容体作動薬 SGLT2阻害剤等 [11.1.3 参照] | 低血糖の発現に注意すること。特に、インスリン製剤、スルホニルウレア剤又は速効型インスリン分泌促進薬と併用する場合、低血糖のリスクが増加するため、これらの薬剤の減量を検討すること。 | 糖尿病用薬( 特に、インスリン製剤、スルホニルウレア剤又は速効型インスリン分泌促進薬)との併用時には、本剤の血糖降下作用の増強により、低血糖のリスクが増加するおそれがある。 |
本剤のご使用にあたり、【禁忌】等その他項目は電子添文をご参照ください。